鴨瘟強毒與疫苗毒的囊膜糖蛋白序列比較
姜甜甜,張大丙
(中國農業大學動物醫學院 農業部動物流行病學與人畜共患病重點實驗室,北京 海淀100193)
鴨瘟(Duck plague)又稱為鴨病毒性腸炎(Duck viral enterits,DVE),是鴨、鵝、天鵝等的一種急性、接觸傳染性疾病,以血管損傷、組織出血、消化道黏膜糜爛、淋巴器官受損和實質器官退行性病變為主要特征[1]。人們習慣將本病病原稱為鴨瘟病毒(Duck plague virus,DPV)或鴨腸炎病毒(Duck enteritis virus,DEV)[1],但國際病毒分類委員會2011年第11次分類報告已將該病原種名改稱為鴨皰疹病毒1型(Anatid herpesvirus 1,AnHV1)[2],分類上歸屬于皰疹病毒科、α-皰疹病毒亞科、馬立克氏病毒屬(http://ictvonline.org)。AnHV1基因組長約160kb,約含78個 ORF[3-4],在已測序的強毒株和弱毒疫苗株之間,5個ORF(UL2、UL12、US10、UL47和 UL41)表現出明顯的序列差異(插入/缺失和堿基置換),提示這5個ORF可能與毒力有關,相對于弱毒疫苗株,強毒株的UL2含有一個528-bp的插入序列[4]。
為有效防制鴨瘟,20世紀60年代國內外研究者即已研制了鴨瘟弱毒疫苗和滅活疫苗并應用于生產實踐[1,5],我國使用鴨瘟雞胚化弱毒疫苗和雞胚成纖維細胞苗防制本病[6],多年來的實踐證明,其效果良好。據文獻報道,不同的AnHV1毒株毒力有所不同,但免疫學特性和抗原相關性似乎相同[1]。
2011年8月和10月,某地區免疫過鴨瘟疫苗的14周齡櫻桃谷北京鴨后備種鴨群和1個50周齡的櫻桃谷北京鴨種鴨群發病,剖檢可見食道黏膜縱褶和泄殖腔黏膜有鴨瘟的典型出血病變,其他病變包括心外膜有出血點,脾臟發黑,腸黏膜充血、出血和炎癥,肝臟隱約可見不明顯的出血斑點,從大體病變判斷,頗似鴨瘟。為獲得準確診斷結果,并了解免疫鴨群發病是否因AnHV1變異所致,本文采用PCR方法對4份肝臟樣品進行了分子檢測,在此基礎上,比較了1株分離株和3個疫苗株的UL2和糖蛋白編碼基因序列,以期為尋找可能的發病原因提供信息。
1 材料與方法
1.1 臨床樣品 采集4只病(死)鴨的肝臟,加入磷酸鹽緩沖液研磨成勻漿,12 000r/min離心10min,取上清,用于PCR檢測和病毒分離。
1.2 參考毒株和參考序列 以3個不同生產廠家的鴨瘟雞胚化弱毒疫苗或雞胚成纖維細胞苗凍干制品作為AnHV1參考毒株,分別稱為A株、B株和C株。用滅菌生理鹽水將凍干苗重懸,離心取上清備用。從GenBank下載AnHV1德國強毒株2085株[4]和中國弱毒疫苗株VAC株[3]的基因組序列用于引物設計和序列比較,序列登錄號分別為JF999965和EU082088。
1.3 DNA提取 用酚∶氯仿∶異戊醇(25∶24∶1)法提取DNA,用無水乙醇沉淀DNA,隨后將DNA溶解于雙蒸水。
1.4 臨床樣品的PCR檢測 為檢測臨床樣品是否含鴨瘟病毒,用3株疫苗株作為陽性對照,按文獻[7]合成引物P1和P2,經PCR檢測 AnHV1的UL6基因,預期擴增長度為416bp。PCR反應體系為25μL,包括12.5μL 2×NI-TaqPCR Master-Mix(加拿大新產業公司)、5μL DNA模板、上下游引物(20μmol/L)各1μL和5.5μL ddH2O。PCR反應條件為:94℃預變性2min,35個循環(94℃50s、54℃90s、72℃ 2min)后,72℃延伸5min。PCR產物用1%瓊脂糖凝膠電泳進行檢測。
1.5 病毒分離 選1份PCR陽性樣品進行病毒分離。將處理獲得的上清液經絨毛尿囊膜接種9日齡鴨胚5枚,每胚接種0.2mL,置37℃溫箱培養,收獲死亡的鴨胚尿囊液、絨毛尿囊膜和胚體,制成勻漿,離心取上清。
1.6 UL2序列的擴增 為了解分離株的分子特性,基于AnHV1 2085株和VAC株的基因組序列設計引物對UL2f/UL2r(表1),擴增 W1株的UL2及其兩側序列,用3株疫苗作為弱毒株對照,W1株和疫苗株的預期擴增長度分別為1 311bp和783 bp。PCR反應體系見1.4,PCR反應條件為:94℃預變性5min,35個循環(94℃30s、58℃30s、72℃1min)后,72℃延伸5min。PCR產物用1%瓊脂糖凝膠電泳進行檢測。
1.7 糖蛋白編碼基因的擴增 為比較W1株與3株疫苗的糖蛋白編碼基因序列,基于AnHV1 2085株和VAC株的基因組序列合成13對引物,用于擴增W1株與3株疫苗11個糖蛋白編碼基因,因其中5對引物擴增疫苗株的結果為陰性,故另外設計5對引物(表1)。PCR體系見1.4,PCR反應條件為:94℃預變性5min,35個循環(94℃30s、51~60℃30s、72℃2min)后,72℃延伸5min。PCR產物用1%瓊脂糖凝膠電泳進行檢測。
1.8 測序和序列分析 用膠回收試劑盒(北京全式金生物技術有限公司)回收PCR產物,連接于pGEM-T載體(Promega),轉化大腸桿菌 DH5α(北京博邁德生物技術有限公司),鑒定后,由北京擎科公司測序。
用DNAMAN軟件進行序列編輯和ORF預測,用BLASTP在GenBank中進行序列相似性檢索,用CLUSTALW比較序列同源性。
2 結果
2.1 PCR檢測 用引物對P1和P2經PCR檢測了4份肝臟組織樣品,均擴增出預期長度的條帶,從3株弱毒疫苗株亦擴增出預期長度的條帶(圖1)。測序和序列分析結果顯示,4份樣品的擴增產物為AnHV1的416bp UL6基因序列,4份樣品的UL6序列與AnHV1 2085株對應序列的同源性為100%,與AnHV1VAC株對應序列的同源性為99%。
2.2 病毒分離 用1份病料接種9日齡鴨胚后7 d,有4枚鴨胚死亡,胚體出血(圖2),收獲接種后72 h死亡的鴨胚,將分離株稱為W1株。
2.3 UL2序列分析 用引物對UL2F和UL2R經PCR從W1株和3株疫苗中均擴增出預期長度的條帶,如圖3所示,W1株的擴增產物長度為1 311 bp,該序列與AnHV1 2085株基因組對應區域的核苷酸序列同源性為100%;而3株疫苗的產物長度均為783bp,與AnHV1弱毒疫苗株VAC株基因組對應區域之間的核苷酸序列同源性皆為99%。
去掉擴增產物5′端的157bp序列(79bp UL3和78bp的非編碼區),獲得 W1株792bp UL2(1~792位)、70bp非編碼區(793~862位)和292bp UL1(863~1154位)序列以及3株疫苗株的348bp UL2(1~348位)和292bp UL1(335~626位)序列。由此可見,W1株和德國強毒株2085株的UL2與UL1之間均存在一個長度為70bp的非編碼區,而所測3株疫苗株與文獻報道的疫苗VAC株相同,即UL2基因與其下游的UL1基因重疊14個堿基。

表1 擴增AnHV1UL2和糖蛋白編碼基因所用引物
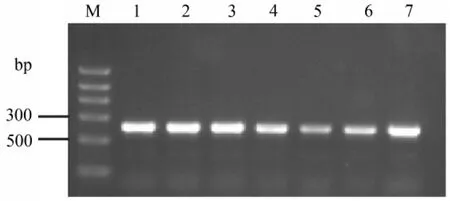
圖1 AnHV1臨床樣品的PCR檢測
序列比對結果顯示,在該區域,W1株和德國強毒株2085株均比3株疫苗株長528bp;疫苗株所缺失的部分對應于 W1株UL2的3′部分(282~792位)和UL2~UL1非編碼區的5′端(793~809位)。
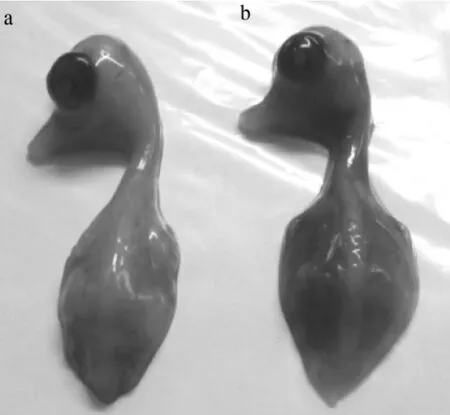
圖2 ANHV1感染的11日齡死亡鴨胚
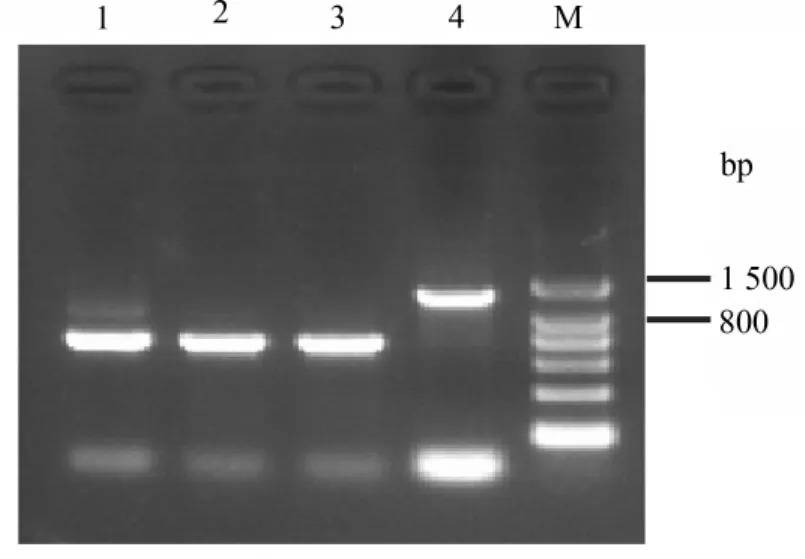
圖3 UL2序列的PCR擴增
2.4 糖蛋白序列分析 序列分析結果表明,分離株W1株與疫苗株A株、B株和C株之間gB、gC、gD、gG、gH、gM、gN和gL蛋白的氨基酸序列完全相同,而gE、gI、gK的氨基酸序列同源性為99%(表2);W1與3株疫苗株之間gE、gI和gK蛋白分別存在2個(T48I、S451P)、3個(I168N、S301R、G338D)和1個(V84A)氨基酸置換。
W1株與文獻報道的弱毒疫苗株(VAC株)之間糖蛋白gB、gC、gD、gG、gH 和gN的氨基酸序列同源性為100%,gE、gK、gL和gM的氨基酸序列同源性為99%株(Vac株和其他毒株的gI蛋白存在長度差異)(表2);W1株與 VAC株之間gE、gK、gL和gM 蛋白分別存在2個 (T48I、S451P)、1個(V84A)、1個(G231V)和1個(V170I)氨基酸置換。
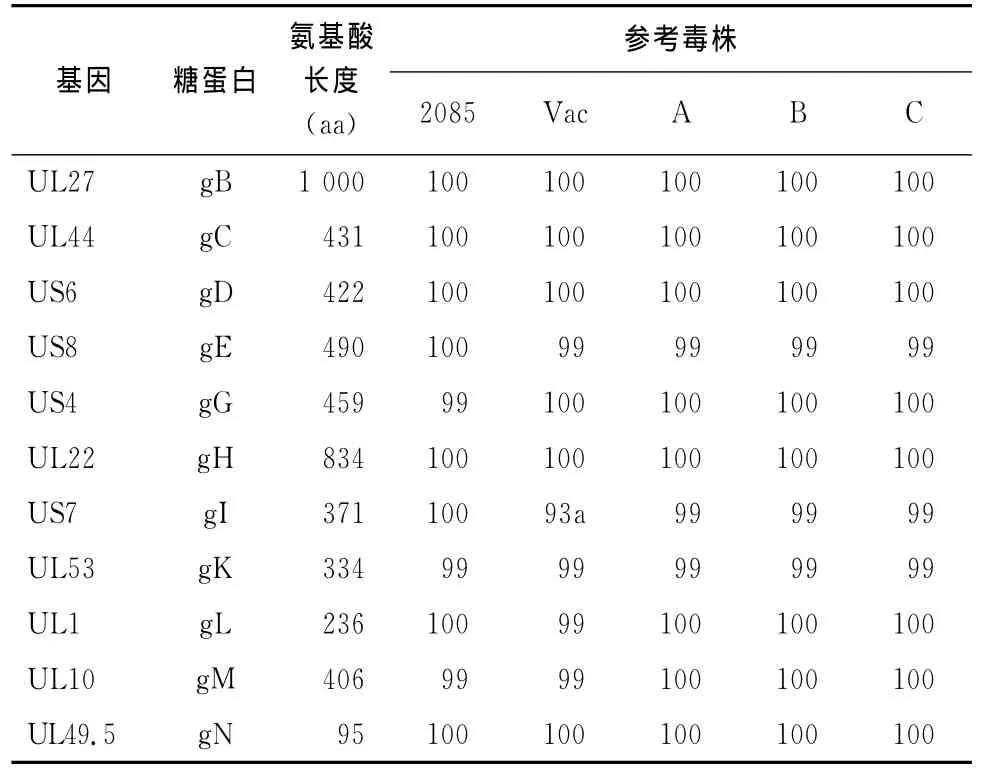
表2 W1株與參考毒株11個糖蛋白的氨基酸序列同源性 (%)
分離株W1株與德國強毒株8025株之間gB、gC、gD、gE、gH、gI、gL和gN蛋白的氨基酸序列完全相同,gG、gK和gM蛋白的氨基酸序列同源性為99%(表2)。分離株 W1株與德國強毒株8025株之間gG、gK和gM蛋白分別存在1個(C14R)、1個(V84A)和2個氨基酸(L23S和H126R)的置換。
3 討論
本次的病例具有鴨瘟的部分典型病變,如食道黏膜縱褶條帶狀出血和泄殖腔黏膜環狀出血,但還缺乏鴨瘟的其他一些特征性病變,如腺胃和肌胃交界處的灰黃色壞死帶或出血帶、肝臟出血或壞死病變以及腸道的環狀出血帶等[1],出現這種相對不典型的病變可能與進行過疫苗免疫有關。用PCR可從4份臨床樣品中檢出AnHV1的特異性UL6序列,表明臨床樣品中含有AnHV1;相對于弱毒疫苗株,分離株W1株的UL2含有一個528-bp的插入序列,符合AnHV1強毒株的分子特征[4]。據此可做出診斷,即本次發病與AnHV1感染有關。
我國生產的鴨瘟疫苗具有良好的免疫效果,在防控鴨瘟的過程中曾發揮了至關重要的作用。一般認為,不同的AnHV1毒株毒力不同,但具有共同的免疫學特性[1]。然而,近年來,我國養鴨生產中不時出現免疫過鴨瘟弱毒疫苗的鴨群仍發生鴨瘟的現象,本研究涉及的兩個鴨群即是如此,是否存在An-HV1流行毒株抗原性變異的情況也是需要考慮的因素。用疫苗進行免疫攻毒試驗或用中和試驗比較野毒與疫苗毒之間的血清學相關性無疑有助于了解免疫鴨群發生鴨瘟的原因所在,但免疫攻毒試驗存在生物安全問題,而中和試驗則需制備相應的抗血清。由于皰疹病毒的囊膜糖蛋白是宿主免疫系統識別的主要抗原[8],因此,測定并比較野外分離株與弱毒疫苗株的囊膜糖蛋白序列亦可提供有用的線索。
研究結果表明,AnHV1共編碼11種囊膜糖蛋白,即 gB、gC、gD、gE、gG、gH、gI、gK、gL、gM 和gN[3-4]。測序和序列分析顯示,W1株與弱毒疫苗株A株、B株和C株之間共有8個囊膜糖蛋白(gB、gC、gD、gG、gH、gM、gN和gL)的氨基酸序列完全相同,另外3個囊膜糖蛋白(gE、gI和gK)的氨基酸序列同源性為99%,這一結果說明,相對于我國養鴨生產中常用的弱毒疫苗株,分離株W1株的囊膜糖蛋白序列未發生明顯的變異。比較W1株和德國強毒株2085株[4]以及文獻報道的弱毒疫苗株[3]之間的囊膜糖蛋白序列,亦可看出,不同AnHV1毒株的囊膜糖蛋白序列具有高度的保守性。
對偽狂犬病病毒、馬立克氏病病毒和單純皰疹病毒的研究表明,gB、gD和gC蛋白可誘導機體產生保護性中和抗體,單純皰疹病毒的gC蛋白還可誘導宿主產生細胞免疫反應[9-13]。因此,根據 W1株與弱毒疫苗株(A株、B株、C株以及VAC株)之間gB、gC和gD等糖蛋白的氨基酸序列同源性為100%的結果,可以初步認為,本次鴨瘟的發生與病原的變異無關。開展更多毒株的監測分析工作將有利于闡明免疫鴨群的發病原因,而做好鴨瘟疫苗的生產、運輸和保存工作并合理使用鴨瘟疫苗對于發揮鴨瘟疫苗的免疫效果至關重要。
[1] Saif Y M.禽病學[M].11版.高福,蘇敬良,索勛,譯.北京:中國農業出版社,2004:520-528.
[2] Davison A J,Eberle R,Ehlers B,etal.The order Herpesvirales.Archives of Virology[J].2009,154:171-177.
[3] Li Y,Huang B,Ma X,etal.Molecular characterization of the genome of duck enteritis virus[J].Virology,2009,391,151-161.
[4] Wang J,H?per D,Beer M,etal.Complete genome sequence of virulent duck enteritis virus(DEV)strain 2085and comparison with genome sequences of virulent and attenuated DEV strains[J].Virus Research,2011,160,316-325.
[5] 黃引賢,歐守杼,鄺榮祿,等.鴨瘟病毒的研究 [J].華南農學院學報,1980,1,21-36.
[6] 中國獸藥典委員會.中華人民共和國獸藥典[M].2005年版.三部.北京:中國農業出版社,2006.
[7] Plummer P J,Alefantis T,Kaplan S,etal.Detection of duck enteritis virus by polymerase chain reaction[J].Avian Diseases,1998,42,554-564.
[8] 殷震,劉景華.動物病毒學[M].2版.北京:科學出版社,1997:1051-1066.
[9] Brockmeier S L,Lager K M,Tartaglia J,etal.Vaccination of pigs against pseudorabies with highly attenuated vaccinia(NYVAC)recombinant viruses [J].Veterinary Microbiology,1993,38,41-58.
[10]Riviere M,Tartaglia J,Perkus M E,etal.Protection of mice and swine from pseudorabies virus conferred by vaccinia virusbased recombinants[J].Journal of Virology,1992,66,3424-3434.
[11]Nazarian K,Lee L F,Yanagida N,etal.Protection against Marek's disease by a fowlpox virus recombinant expressing the glycoprotein B of Marek′s disease virus[J].Journal of Virology,1992,66,1409-1413.
[12]NauwynekK H J.Functional aspects of Aujeszky′s disease(pseudorabies)viral proteins with relation to invasion,virulence and immunogenicity[J].Veterinary Microbiology,1997,55,3-11.
[13]Mettenleiter T C.Immunobiology of pseudorabies(Aujeszky′s Disease)[J].Veterinary Immunology and Immunopathology,1996,54,221-229.

