不同程度奶牛乳腺炎的相關性試驗
程艷艷,張志剛,劉本君,高 利
(東北農業大學動物醫學學院,黑龍江 哈爾濱150030)
奶牛乳房炎通過影響牛奶的產出率和質量對奶業造成巨大的經濟損失。乳房炎是源于細菌感染或擠奶方式不正確造成機體產生免疫應答[1],有報道稱,機體的免疫反應會導致機體氧自由基的產生增多[2]及許多相關因子的變化[3-4]。自由基在體內有很強的氧化反應能力,一旦體內的自由基產生過多,易對蛋白質、脂質和核酸等產生傷害,從而引起機體的氧化應激和脂質過氧化[5]。過氧化物酶被認為是細胞內抵御氧化損傷的第一道防線,因此它的活性直接體現了機體抗氧化能力[6]。但是目前關于不同程度奶牛乳房炎和奶牛抗氧化能力關系的報道非常有限,本試驗通過研究二者的相關性并探討所測定的指標是否可以作為判定乳腺損傷的依據。
1 材料與方法
1.1 試驗動物分組 利用乳汁體細胞計數儀檢測法對40頭試驗奶牛進行分組,分為4組:C組(SCC<5×105個/mL)、Ⅰ組(5×105<SCC<1.5×106個/mL)、Ⅱ組(1.5×106<SCC<5×106個/mL)和Ⅲ組(SCC>5×106個/mL)。
1.2 血樣的采集 選擇阿城區某奶牛示范基地的荷斯坦奶牛40頭(年齡和泌乳期相近)。頸靜脈采集C組、Ⅰ組、Ⅱ組、Ⅲ組各10頭奶牛的血液,采樣前消毒取血部位,對每頭牛約取15mL血液。對采集血樣的奶牛和試管進行號碼標記,將采集的血樣室溫下靜止。
1.3 乳樣的采集 采集C組、Ⅰ組、Ⅱ組、Ⅲ組各10頭奶牛的乳汁,采樣前對乳區進行清洗,然后用70%酒精消毒乳區,棄掉頭2把乳汁,進行全天采樣,從早上6點開始,每間隔5h進行取樣,取樣3次,每次20mL,最后混入無菌奶瓶中。將采集的乳樣放到有冰塊的泡沫箱中,將乳樣帶回實驗室檢測。
1.4 血樣的處理及測定 頸靜脈采集血液,在室溫下自然凝固1~2h,冰浴30min,然后3 000r/min離心10min,分離血清,4℃保存,待測。樣品采用南京建成生物工程研究所超氧化物歧化酶 (superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛 (malonal-dehyde,MDA)試劑盒進行測定。
1.5 乳樣的處理及測定 將乳樣3 000r/min離心5min,除去上層乳脂,然后于16 000r/min高速離心機中離心10min,收集上清,4℃保存,待測。如檢測時間較長,要將樣品置于-80℃冰箱中保存備用。樣品采用南京建成生物工程研究所SOD、GSH-Px和MDA的試劑盒進行測定。
1.6 數據分析 利用軟件SPSS 13.0軟件統計分析進行分析處理,數據用±SD表示。
2 結果
2.1 血清中SOD、GSH-Px活性及MDA水平 見圖1~3。

圖1 血清各組中SOD活性

圖2 血清各組中GSH-Px活性
由圖1、2可看出,本試驗中Ⅰ、Ⅱ、ⅲ組相比于對照組SOD、GSH-Px酶活性依次降低,且P<0.05。由圖3可得出,Ⅰ、Ⅱ、Ⅲ組相比于對照組MDA水平依次升高,且P<0.05。

圖3 血清各組中MDA含量
2.2 乳清中SOD、GSH-Px活性及MDA水平 見圖4~6。

圖4 乳清各組中SOD含量
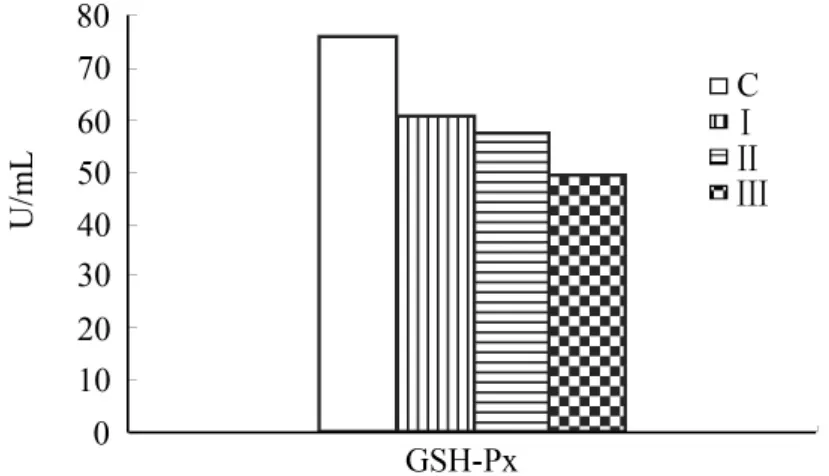
圖5 乳清各組中GSH-Px含量
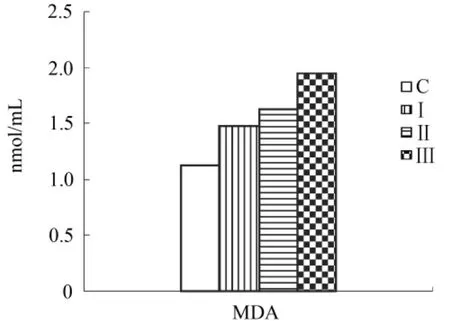
圖6 乳清各組中MDA含量
由圖4、5可看出,與對照組相比,Ⅰ、Ⅱ、Ⅲ組SOD、GSH-Px酶活性依次降低(P<0.05)。圖6顯示,Ⅰ、Ⅱ、Ⅲ組相比于對照組MDA水平依次升高(P<0.05)。
3 討論
在試驗中奶牛患有乳腺炎時,血清及乳清中SOD、GSH-Px的活性顯著低于對照組,且隨著炎癥程度的加重,SOD、GSH-Px的活性也逐漸降低,說明奶牛在患有乳腺炎時,機體內抗氧化酶活力顯著降低。這主要是因為奶牛發生乳腺炎時,體內大量的自由基異常生成并超過了機體的清除能力,于是機體內的SOD和GSH-Px被大量消耗[7]。
MDA水平的增加可能源于自由基產生過多,SOD和GPX-Px酶活性降低,致使機體產生氧化損傷,細胞內的自由基受內源性的過氧化物酶如SOD和GPX-Px等控制,然而自由基產生突破抗氧化防線,細胞內則發生氧化應激,MDA是氧化應激引起的脂質過氧化的產物[8]。本試驗結果提示,奶牛在患有乳腺炎時過氧化物和自由基參與了乳腺炎的發生過程,并且使機體組織細胞受到氧化損傷。
奶牛發生乳腺炎時,動物機體和乳腺組織均產生了過多的自由基,機體的總抗氧化能力下降,抗氧化系統活性物質嚴重不足,已經不能有效地清除體內過多的自由基,導致乳腺上皮細胞的細胞膜無法有效防御自由基的攻擊,以至于過多的自由基使乳腺上皮細胞細胞膜的通透性異常,從而引起乳腺細胞分泌異常乳。因此,檢測血液中和乳汁中SOD和GSH-Px酶活性和MDA的含量變化可以指示乳房炎的嚴重程度,這些指標也可以作為判定乳腺炎奶牛乳腺損傷的依據。
[1] 劉春元,鐵煥錄.奶山羊乳房炎的綜合防治[J].中國獸醫雜志,2012,48(1):37-38.
[2] Bouwstra R J,Nielen M,Newbold J R,etal.Vitamin E supplementation during the dry period in dairy cattle.Part II:Oxidative stress following vitamin E supplementation may increase clinical mastitis incidence postpartum [J].J Dairy Sci,2010,93:5696-5706.
[3] 李曉蕾,張宇,劉本軍,等.不同程度乳腺炎血清中相關細胞因子的試驗[J].中國獸醫雜志,2011,47(10):7-8.
[4] 張宇,王洪偉,魏成威,等.不同乳腺炎乳中部分相關酶變化的試驗[J].中國獸醫雜志,2011,47(3):23-25.
[5] Kaufmann J A,Bickford P C,Taglialatela G.Free Radical-Dependent Changes in Constitutive Nuclear Factor Kappa B in the Aged Hippocampus[J].Neuroreport,2002,13:1917-1920.
[6] Jomova K,Jenisova Z,Feszterova M,etal.Arsenic:toxicity,oxidative stress and human disease[J].J Appl Toxicol,2011,31:95-107.
[7] Mukherjee R.Selenium and vitamin E increases polymorphonuclear cell phagocytosis and antioxidant levels during acute mastitis in riverine buffaloes[J].Vet Res Commun,2008,32:305-313
[8] Halliwell B.Free radicals and antioxidants:apersonal view[J].Nutr Rev,1994,52:253-267.

