ELISA檢測卵黃和血清中禽呼腸孤病毒抗體相關(guān)性試驗
焦玉蘭,朱秀同,趙玉龍,任 欣,楊保收,梁 武
[瑞普(保定)生物有限公司,河北 保定071000]
目前,禽呼腸孤病毒(REOV)檢測方法主要采取PCR檢測及血清ELISA檢測法。采用PCR檢測抗原法,缺少敏感性、特異性試驗數(shù)據(jù);而血清檢測法,由于采集血清,費時費力,且易引起雞的應(yīng)激反應(yīng),導(dǎo)致雞只生產(chǎn)性能下降,甚至誘發(fā)疾病[1],且給獸醫(yī)生物制藥廠家的原材料檢測造成一定的困難。針對上述問題,農(nóng)業(yè)部獸醫(yī)局召開了獸醫(yī)生物制品原材料檢測方法研討會,會議中,與會專家就SPF種蛋檢測方法進行了評價[2],提出了ELISA檢測REOV卵黃抗體的新的思路與方法。
卵黃抗體是指雞、鴨、鵝等蛋禽卵黃中存在的抗體,也稱卵黃免疫球蛋白[3],利用禽呼腸孤病毒具有可垂直傳播的特性[4],以及ELISA檢測方法簡便、準(zhǔn)確、快捷[5]的優(yōu)勢,本試驗通過進行ELISA檢測卵黃和對應(yīng)血清中REOV抗體相關(guān)性試驗 ,以期確定卵黃抗體和血清抗體的對應(yīng)關(guān)系,并依此建立ELISA試劑盒檢測卵黃抗體的處理方法及判定標(biāo)準(zhǔn)。
1 材料
1.1 種蛋 150日齡SPF產(chǎn)蛋雞34只,由山東賽福實驗動物有限公司配合完成,血清經(jīng)ELISA檢測REOV抗體陰性,每15d采集血清和收集種蛋1次,做好標(biāo)記,血清和種蛋編號一一對應(yīng),共收集3次。
130日齡普通初產(chǎn)產(chǎn)蛋雞30只,購自河北保定清苑某養(yǎng)雞場,血清經(jīng)ELISA檢測REOV抗體陽性,每15d采集血清和收集種蛋,做好標(biāo)記,血清和種蛋編號一一對應(yīng)。共收集4次。
1.2 試劑 氯仿(天津市北方天醫(yī)化學(xué)試劑廠);生理鹽水(自配);REOV-ELISA檢測試劑盒(IDEXX公司),批號:BG636;去離子水(自制)。
1.3 儀器設(shè)備 酶標(biāo)分析儀(DNM-9602型),100~1 000μL移液器及槍頭,100μL移液器及槍頭,0.5~300μL移液器及槍頭,2.5μL移液器及槍頭,0.5~10μL移液器及槍頭,封口膜,2mL離心管,1.5mL離心管,移液槽,低溫高速離心機(型號:Sigma),電熱恒溫水浴鍋(型號:DK-98-1型)。
2 試驗方法
2.1 種蛋REOV卵黃抗體檢測操作方法
2.1.1 樣品處理 采用氯仿抽提卵黃抗體方法,300 μL卵黃+600μL生理鹽水+900μL氯仿,充分振蕩后,37℃水浴30min,期間攪拌2~3次,然后4 000r/min離心20min,取上層水相,即為卵黃抗體。
2.1.2 試劑盒操作程序 (一)樣品準(zhǔn)備:在檢測前,用樣品稀釋液將卵黃抗體作1∶100倍稀釋(5μL的樣品用樣品稀釋液稀釋到500μL)。每個樣品都要換一個吸頭。樣品加入抗原包被孔之前要充分混合均勻。(二)操作步驟:試劑盒各組分放置至室溫(18℃~25℃),顛倒搖動混合均勻。(1)取出包被板,在表上記錄樣品位置。(2)加100μL不需稀釋的陰性對照血清至A1孔和B1孔。(3)加100μL不需稀釋的陰性對照血清至C1孔和D1孔。(4)加100μL稀釋好的樣品至相應(yīng)的孔內(nèi)。樣品采用雙孔檢測。(5)在室溫(18℃~25℃)孵育30min。(6)吸出所有孔內(nèi)的液體排到適當(dāng)?shù)膹U液缸。(7)用大約300 μL蒸餾水或去離子水洗滌微孔共3~5次,并將孔內(nèi)液體完全吸干。(8)每孔加入100μL酶標(biāo)羊抗雞抗體(HRPO)。(9)在室溫(18℃~25℃)孵育30 min。(10)重復(fù)步驟(6)和(7)。(11)每孔加入100 μL TMB底物溶液。(12)在室溫(18℃~25℃)孵育15min。(13)每孔加入100μL終止液終止反應(yīng)。(14)空氣調(diào)零,在650nm,A(650)測量和記錄吸光值。
2.1.3 判定標(biāo)準(zhǔn) 只有在陽性對照孔所得的均值減去陰性對照孔所得值的均值(PCX-NCX)必須大于0.075時,陰性對照孔所得值的均值必須小于或等于0.150時,測定結(jié)果才有效。樣品的S/P值小于或等于0.2,判為陰性。樣品的S/P值大于或等于0.2,判為陽性,表示免疫過或感染過REO。
計算:
(1)陰性對照平均值(NCX)=A1孔 A(650)+B1孔A(650)/2;(2)陽性對照平均值(PCX)=C1孔 A(650)+D1孔 A(650)/2;(3)S/P 值=樣品(650)-NCX/PCX-NCX。
2.2 REOV抗體陰性SPF雞對應(yīng)種蛋卵黃直接稀釋與氯仿處理樣品不同稀釋倍數(shù)ELISA檢測對比
選取經(jīng)ELISA檢測血清REOV抗體陰性的SPF雞收集的種蛋,采用直接稀釋卵黃和氯仿處理卵黃兩種方法,對比分析二者與血清檢測結(jié)果的一致性。直接稀釋法采用將卵黃直接進行1∶100、1∶200、1∶400稀釋;氯仿抽提卵黃抗體方法[6]為:300μL卵黃+600μL生理鹽水+900μL氯仿,充分振蕩后,37℃水浴30min,期間攪拌2~3次,然后4 000r/min離心20min,取上層水相進行1∶100、1∶200、1∶400稀釋作為檢品,分別按照ELISA檢測試劑盒說明書進行檢測,對比分析卵黃樣品S/P值與血清S/P值的差異。
2.3 REOV抗體陽性雞對應(yīng)種蛋氯仿處理卵黃不同稀釋倍數(shù)ELISA檢測對比 選取經(jīng)ELISA檢測血清REOV抗體陽性種雞的種蛋,采用氯仿抽提卵黃抗體方法[6],300μL卵黃+600μL生理鹽水+900μL氯仿,充分振蕩后,37℃水浴30min,期間攪拌2~3次,然后4 000r/min離心20min,取上層水相進行1∶100、1∶200、1∶400稀釋作為檢品,分別按照ELISA檢測試劑盒進行檢測,對比分析不同稀釋倍數(shù)的卵黃樣品S/P值與血清S/P值的差異。
2.4 大樣本SPF雞和普通雞血清和種蛋處理卵黃ELISA檢測對比 根據(jù)2.2、2.3確定的稀釋倍數(shù)對SPF雞和普通雞采集的血清和種蛋卵黃進行大批量樣本檢測,對比分析血清與卵黃檢測S/P值及REOV抗體判定的符合率。
符合率計算公式:符合率=(與血清檢測結(jié)果一致的雞蛋份數(shù)/種蛋檢測總數(shù))×100%
3 結(jié)果及分析
3.1 REOV抗體陰性SPF雞種蛋卵黃直接稀釋與氯仿處理樣品不同稀釋倍數(shù)ELISA檢測結(jié)果 選取5份血清REOV抗體陰性的SPF種雞及對應(yīng)種蛋,分別采用水稀釋法和氯仿抽提法提取卵黃抗體,并做1∶100、1∶200、1∶400的倍比稀釋進行ELISA檢測,血清根據(jù)試劑盒要求做1∶500稀釋。檢測結(jié)果表明,卵黃直接稀釋法不同稀釋倍數(shù)和不同樣品之間檢測值差異較大。卵黃經(jīng)氯仿抽提后不同稀釋倍數(shù)和不同樣品的S/P值較穩(wěn)定,且氯仿抽提卵黃抗體檢測法1∶100的稀釋度檢測結(jié)果與血清值最為接近。
3.2 REOV抗體陽性種雞對應(yīng)種蛋氯仿處理卵黃不同稀釋倍數(shù)ELISA檢測結(jié)果 選取21個陽性血清樣本及對應(yīng)卵黃,卵黃經(jīng)氯仿處理后做1∶100、1∶200、1∶400稀釋,再次進行稀釋度試驗,檢測結(jié)果表明,選取的21個陽性種蛋卵黃經(jīng)氯仿處理后不同稀釋度及不同樣品的S/P值均較穩(wěn)定,其中1∶100的稀釋度最接近血清值。
綜合3.1和3.2結(jié)果,確定采用氯仿抽提卵黃抗體方法,抽提后進行1∶100稀釋。
3.3 大樣本SPF雞和普通雞血清和種蛋處理卵黃ELISA檢測結(jié)果 通過檢測定期收集的SPF雞血清、種蛋及普通雞血清、種蛋,用上述確定的方法進行大批量樣本檢測,統(tǒng)計二者差異性,得出二者符合率。
3.3.1 SPF雞樣本檢測結(jié)果及分析 將隨機抽取的103份SPF雞樣本的檢測數(shù)據(jù),用SPSS 13.0軟件進行分析,結(jié)果顯示,血清和卵黃抗體檢測結(jié)果差異不顯著(P≥0.05)。
3.3.2 普通雞樣本檢測結(jié)果及分析 將隨機抽取103個普通雞樣本的檢測數(shù)據(jù),用SPSS 13.0軟件進行分析,結(jié)果顯示,血清和卵黃抗體檢測結(jié)果差異不顯著(P≥0.05)。
3.3.3 SPF雞樣本及普通雞樣本檢測結(jié)果綜合分析 見表1。
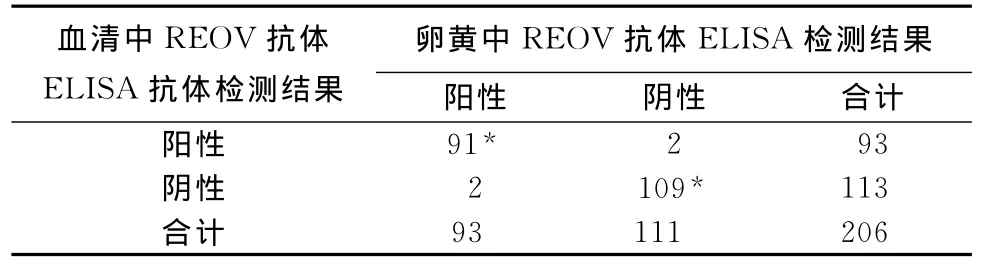
表1 符合率分析
如表1所示,綜合SPF雞樣本及普通雞樣本檢測結(jié)果,相對于血清ELISA檢測法,卵黃ELISA檢測法的符合率:陰性符合率為52.91%(109/206);陽性符合率52.91%(91/206);總符合率為97.08%[(91+109)/206]。
4 討論
REOV是主要經(jīng)蛋傳播疾病之一,世界各地均有發(fā)生。有資料證明,養(yǎng)殖場蛋雞發(fā)病率高達90%以上,可引發(fā)雞多種疾病,包括病毒性關(guān)節(jié)炎/腱鞘炎、矮小綜合征、呼吸道疾病、腸道疾病和所謂吸收不良綜合征。經(jīng)濟損失常由病毒性關(guān)節(jié)炎/腱鞘炎和受害雞增重減少、飼料轉(zhuǎn)換下降等生產(chǎn)性能差引起[7],給養(yǎng)禽業(yè)造成了極大的威脅。若生產(chǎn)疫苗所用種蛋中含有此病毒,很有可能會造成所產(chǎn)疫苗中含有REOV,免疫雞只后,極易導(dǎo)致雞只發(fā)病,給養(yǎng)禽業(yè)帶來極大的經(jīng)濟損失。
對于REO疾病的診斷及抗體水平的檢測,血清ELISA檢測法,由于采血取樣過程費時費力,并且,每次采血取樣,都會對雞只產(chǎn)生不同程度的應(yīng)激反應(yīng),導(dǎo)致生產(chǎn)性能下降,甚至誘發(fā)疾病。同時,根據(jù)REOV具有可垂直傳播的特性,若能夠掌握血清抗體和卵黃抗體之間的相關(guān)性,通過檢測卵黃抗體水平,能夠掌握血清抗體水平,將會具有重要的臨床實踐意義。
本試驗結(jié)果表明,采用REOV-ELISA檢測試劑盒檢測雞血清及對應(yīng)卵黃中的REOV抗體水平,二者具有良好的相關(guān)性;相對于血清ELISA檢測法,所選雞樣品卵黃ELISA檢測法的符合率97.08%,表明可以采用檢測血清的REOV-ELISA試劑盒檢測卵黃中的REOV抗體水平。采用卵黃做樣品,可以避免采血對雞產(chǎn)生的應(yīng)激及其連帶的經(jīng)濟損失,同時節(jié)省了采血所需時間。
[1] 楊百亮,郭羽.瓊擴試驗檢測雞傳染性法氏囊病卵黃抗體的研究[J].天津農(nóng)學(xué)院學(xué)報,2004,11(4):27-29.
[2] 農(nóng)業(yè)部關(guān)于SPF蛋檢測方法進行評價的復(fù)函[Z].部評審(生)[2011]70號.
[3] 陳斌,楊志華.雞卵黃免疫球蛋白(IgY)的作用機理及應(yīng)用前景[J].浙江畜牧獸醫(yī),2005(1):9-10.
[4] 蔡寶祥.家畜傳染病學(xué)[M].北京:中國農(nóng)業(yè)出版社,2001:324-325.
[5] 范祚舟,徐加發(fā),等.酶聯(lián)免疫分析技術(shù)研究發(fā)展[J].分析科學(xué)學(xué)報,2011,27(1):113-117.
[6] 鄭立勇,喬彥良,馬鳳龍,等.卵黃抗體不同提取方法的比較[J].黑龍江畜牧獸醫(yī),2009(1):106-107.
[7] 李巨銀,胡新崗,魏寧.禽呼腸孤病毒病的研究進展[J].甘肅畜牧獸醫(yī),2011(4):30-31.

