雙氧水氧化處理低濃度含錳廢水的研究
楊慶一,李道靜
(1.貴州大學, 貴陽 550025;2.貴州省環境監察局, 貴陽 550081)
錳是人體必需的微量元素,然而過量攝入則會對機體產生毒性,影響中樞神經系統,臨床表現癥狀類似于帕金森氏綜合癥[1]。在濕法冶煉電解錳生產過程中產生的大量廢水含有錳、鉻等污染物,對環境和人類健康危害極大[2];其中所占比例較少的工藝廢水因錳、鉻等污染物含量很大,都必須經過凈化處理后再排放。然而受污染的其他水體,如廠區附近的水井水、廠區地下水(地下水)、電解錳冷卻水等卻常常被人忽視,若此類水不經處理任其自由排放,由此引起的水體污染和人體危害也不容忽視。松桃縣巴坳村老卜刺水井每小時出水量360 m3(枯水期),是該地區非常重要的生活用水來源,由于松桃縣錳礦資源豐富,加之附近的電解金屬錳渣場滲透的影響,導致該水源中錳含量偏高,根據銅仁地區環境監測站對老卜刺水井的常規監測值為8~11 mg/L,另外 pH 為 5.0 ~7.0 左右,Cr6+未檢出,氨氮含量為124 mg/L。錳和氨氮含量不僅高于地下水V類水標準 (Mn>1 mg/L,氨氮>0.5 mg/L),且錳含量已超過了GB 8978—1996《污水綜合治理排放標準》規定的排放濃度(2 mg/L)。現以松桃縣巴坳村老卜刺井水為研究對象,研究雙氧水氧化對低濃度含錳廢水的去除效果及其影響因素。
2 實驗材料與方法
2.1 實驗試劑和儀器
試劑:NaOH(分析純),H2O2(30%,分析純)
儀器:DJ1C增力電動攪拌器(江蘇省金壇市大地自動化儀器廠),TD10002電子天平(余姚市金諾天平儀器廠),WFX-1E3型原子吸收分光光度計(北京瑞利分析儀器公司),便攜式酸度計pHB-5型(杭州雷磁分析儀器廠)。
2.2 樣本
取松桃巴坳村老卜刺含錳井水,實驗室測定錳含量5~12 mg/L,pH 8.4左右,溫度12~18 ℃。
2.3 實驗方法
對井水進行取樣分析,檢測其中Mn的含量。準確量取一定體積的井水樣于燒杯中,加0.3845 mol/L的NaOH調節pH值,再向其中加入質量比為30%的H2O2水溶液,攪拌一定時間后再靜置一段時間,雙層濾紙自然過濾后,取樣分析其中Mn含量。其中Mn含量用火焰原子吸收分光光度法測量,溶液pH值采用便攜式酸度計檢測測量。實驗均在室溫(12℃)條件下進行。
在實驗過程中,首先調節pH為7、7.5、8,在這三個 pH值條件下分別加入體積比為 5.0‰、2.5‰、1.0‰、0.5‰的 H2O2,攪拌 5 min,靜置 25 min,過濾后分析濾液中錳含量,考察不同 pH和H2O2加入量對錳去除率的影響,根據實驗結果進一步優化pH值和H2O2的加入量。在確定了最優的pH值和H2O2的加入量后,對影響雙氧水氧化除錳的其他因素即攪拌時間和靜置時間進行考察,最終得出最優的雙氧水氧化除錳工藝條件。
3 實驗結果與討論
3.1 pH和H2O2加入量對錳去除率的影響
pH和H2O2加入量對錳去除率的影響見表1:
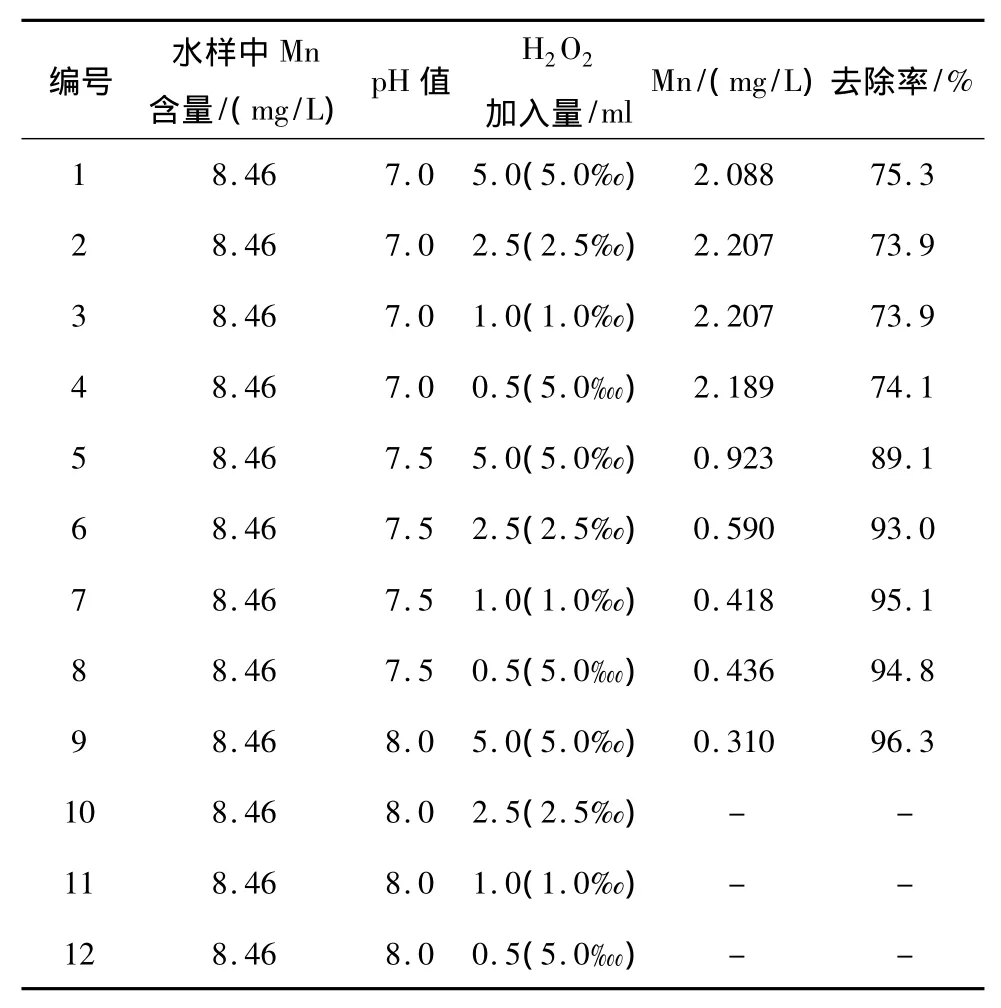
表1 pH和H2O2加入量與錳去除率相關性
由表1可知,隨著pH的增大,氧化除錳的效果越來越好,當 pH 達到 8.0,H2O2加入量為 2.5‰、1‰、5?時,溶液中Mn含量低于檢出限,幾乎能除盡。而在pH一定的情況下,H2O2加入量的增加并沒有明顯促進錳的去除。雙氧水氧化去除二價錳的機理是由于H2O2具有強氧化性,在堿性環境中,能將溶液中 Mn2+氧化為 MnO2,方程如下[3]:
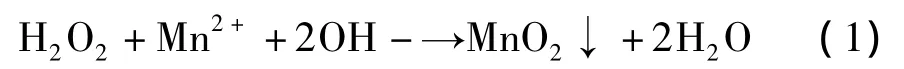
該反應分兩步進行:
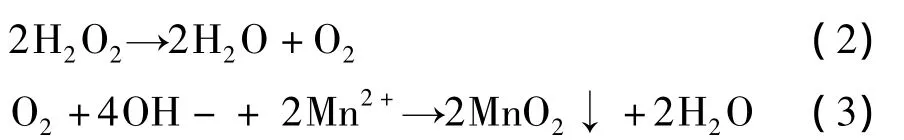
反應中生成的MnO2可作為催化劑,加速H2O2的分解,使反應快速進行,該反應是一個自催化反應。不過也有研究認為,在堿性環境下,Mn2+的去除主要是通過Mn2+的氧化產物水合二氧化錳膠體(MnO(OH)2)與Mn2+進行離子置換得以實現的[4]。由此可見,OH-濃度的增加有助于反應(1)向正方向進行,從而有利于Mn2+的去除,在反應過程中,當pH值為8時,OH-的濃度為10-8mol/L,遠小于Mn2+的濃度,因此pH值越大,除錳效果越好。
3.2 氧化除錳綜合實驗優化
根據方程(1),H2O2與Mn2+在計量關系上的質量比為34∶55,實驗中加入的H2O2最小量為0.5 ml,30%的H2O2水溶液密度為1.1 g/ml,由此得出在1 L水樣中加入0.5 ml的30%的H2O2溶液,H2O2的濃度為165 mg/L,遠大于Mn2+的濃度,因此H2O2加入量的增加對錳的去除效果影響不大,因此,我們降低 H2O2加入體積比至 5?、2.5?、1.0?、0.5?,并對影響雙氧水氧化除錳的各因素進行了優化。
調節pH值為8,攪拌時間和靜置時間分別為5 min和25 min,降低H2O2加入量并考察其對錳去除率的影響,實驗結果如表2:

表2 H2O2加入量的優化實驗結果
從實驗結果可以看出,設置pH為8.0,H2O2加入體積比為0.5?時,溶液中Mn仍可降到2 mg/L以下。
確定H2O2加入量為0.5?,然后調節NaOH加入量,并設置不同的靜置時間,確定最佳的pH值及實驗靜置時間。在不同pH值及靜置時間下錳的去除效果如表3。
從實驗結果中可以看出,當NaOH加入量為0.72?,控制 pH值在9.2在以上,H2O2加入量為0.5?時,只需要反應15 min溶液中錳即可降到2 mg/L以下,可滿足排放標準。
實驗最后考查了攪拌時間對H2O2氧化除錳效果的影響,結果如表4。
由實驗結果可知,攪拌時間對于雙氧水氧化除錳的效果不呈現規律性的關系,攪拌時間過長反而不利于錳的去除,這有可能是因為攪拌時間過長會破壞反應過程中形成的二氧化錳膠體(MnO(OH)2)形態,不利于其對Mn的吸附,因此在反應過程中要對攪拌時間嚴格控制。結果顯示攪拌時間為1 min時,濾液中的Mn2+最低。
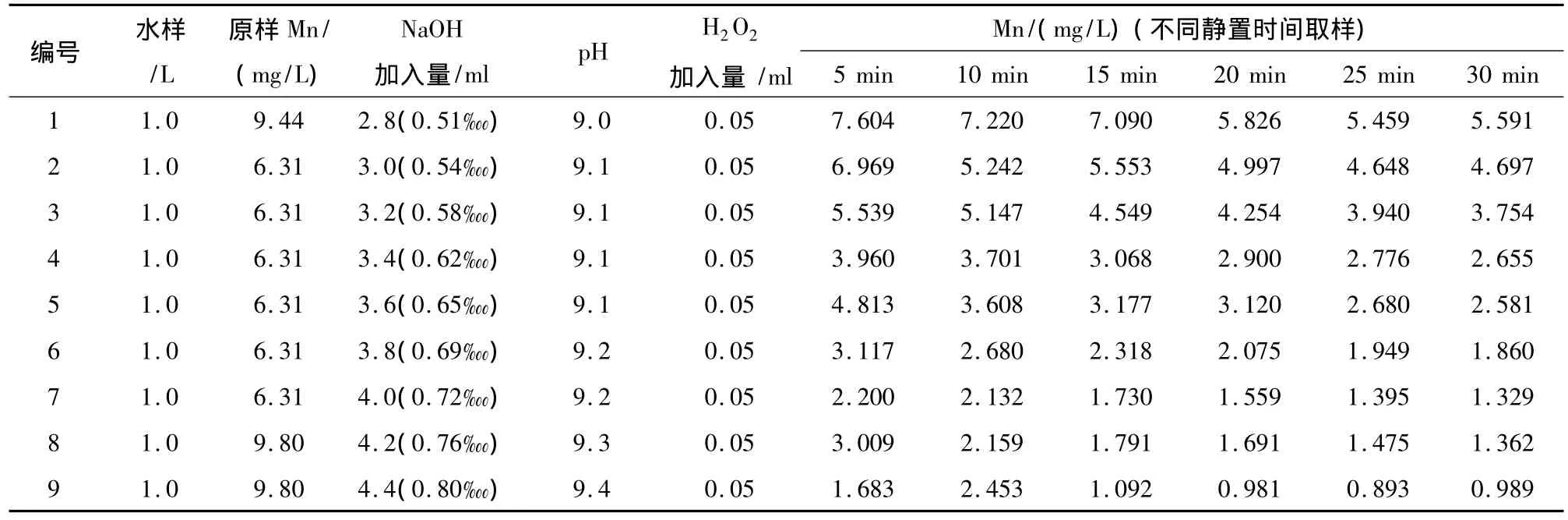
表3 不同NaOH加入量和靜置時間下的錳去除效果
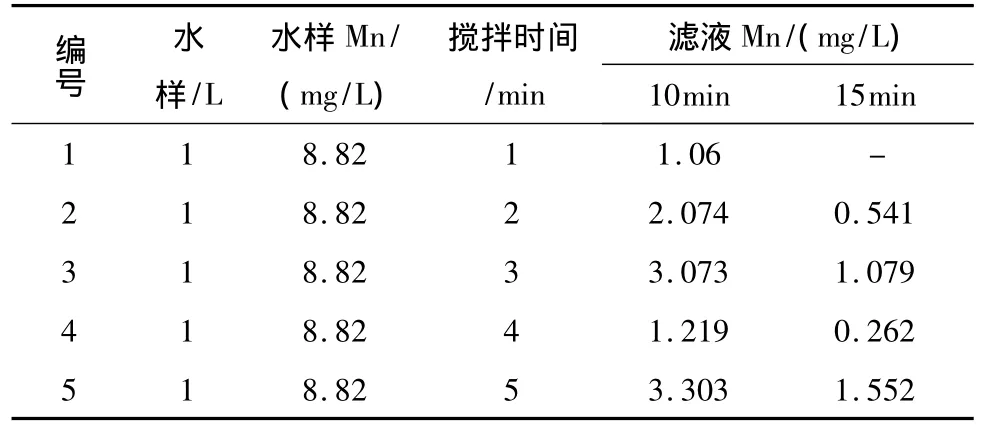
表4 攪拌時間對除錳效果的影響
4 結論
在雙氧水氧化除錳實驗中,pH的提高能明顯促進錳的去除。在pH值固定的情況下,H2O2加入量過高對錳的去除率沒有幫助,過低會降低錳的去除率。靜置時間在一定范圍內越長,錳的去除率越高,不過20 min以后趨于平緩。攪拌時間過長不利于錳的去除。對于低濃度的含錳廢水,雙氧水氧化除錳的最佳工藝條件pH為9.2~9.4,H2O2加入量為0.5?,靜置時間 15 min,攪拌時間為 1 min。
[1]師娟子,郭仁輿.錳的毒性[J].國外醫學醫學地里分冊,1992,13(2):51-52.
[2]姚俊,田宗平,姚祖風,等.電解金屬錳廢水處理的研究[J].中國錳業,2000,18(3):25 -27.
[3]胡文華,吳慧芳,孫士權.過氧化氫預氧化去除受污染地下水中鐵、錳的試驗研究[J].水處理技術,2011,1:73-75.
[4]王琳,王寶貞,張維佳,等.含鐵錳水源水深度處理工藝的運行試驗研究[J].環境科學學報,2001,21(2):134-139.

