原花青素通過Caspase途徑誘導乳腺癌MCF-7細胞凋亡
薛 瑞,王明仲,洪學軍,吳 倩,廉 果,何 標
原花青素(Proanthocyanidin/Procyanidin,PC)是天然植物中廣泛存在的一類多酚化合物的總稱,是由不同數量的兒茶素或表兒茶素結合而成,為多酚類黃酮。近年研究顯示,PC不僅可以抑制肺癌、慢性骨髓白血病、前列腺癌等腫瘤細胞的生長,還可誘導多種腫瘤細胞凋亡[1-2]。本研究旨在探討PC對人乳腺癌MCF-7細胞的生長抑制、誘導凋亡作用,為研究開發PC作為抗乳腺癌新藥提供部分實驗依據。
1 材料與方法
1.1 材料、試劑和儀器 人乳腺癌MCF-7細胞由華中科技大學同濟醫學院提供;胎牛血清(杭州四季青生物工程材料公司);RPMI 1640培養粉(Gibco公司);順鉑(江蘇豪森藥業股份有限公司);MTT和胰蛋白酶(Sigma公司);Caspase-9、Caspase-12酶聯免疫檢測試劑盒(GDB公司);ELx800型酶聯免疫檢測儀(BIO-TEK公司);CO2孵箱(JOUAN公司);流式細胞儀FACS Calibur(Becton Dickinson公司);計算機數據處理軟件CELLQUEST(B.D.公司);其他試劑均為國產分析純。
1.2 方法
1.2.1 MTT法測定PC對MCF-7細胞生長的抑制作用 常規培養人乳腺癌MCF-7細胞,處于對數生長期時,常規消化、洗滌后,以1×105/mL密度接種于96孔培養板中,于5%CO2、37℃孵箱中預培養24 h后,分別加入不同濃度的PC,使最終每組含 PC 濃度分別為 10、20、40、80、160、320 μg/mL,每個濃度6個復孔,并設陽性對照藥順鉑組和正常細胞組,繼續培養。分別于24、48、72 h 3個時相進行MTT比色實驗:每次于實驗結束前每孔加入MTT,繼續培養4 h后按常規采用酶標儀(波長570 nm)測定各孔吸光度值(A)。按公式“(1-藥物孔A值/對照孔A值)×100%”計算細胞抑制率,以劑量和生長抑制率做直線相關分析。
1.2.2 流式細胞術檢測MCF-7細胞周期和凋亡將MCF-7細胞以1×106/mL密度接種于培養瓶中,24 h后隨機分組,分別加入不同濃度的PC,使最終每組含PC 濃度分別為40、80、160 μg/mL,并設陽性對照藥順鉑組和正常對照組,繼續培養48 h后收集細胞培養上清液,置-20℃環境待測相關基因蛋白;常規消化洗滌細胞后,用70%預冷乙醇固定細胞,置4℃環境待測凋亡率和細胞周期。檢測前,先離心棄乙醇,再用PBS洗滌后置于檸檬酸緩沖液中1 h以上,調整細胞濃度至1×106/mL左右,按照試劑盒說明書操作,上流式細胞儀檢測細胞凋亡率并分析細胞周期。
1.2.3 ELISA法檢測凋亡相關基因蛋白Caspase-9、Caspase-12含量 采用ELISA法檢測凋亡相關基因蛋白 Caspase-9和 Caspase-12含量。取“1.2.2”項中凍存的細胞培養上清液,按Caspase-9酶聯免疫檢測試劑盒說明書進行操作,用酶標儀(波長450 nm)測吸光度值,繪制標準曲線,并計算Caspase-9含量。同法檢測Caspase-12的含量。
2 結果
2.1 PC對MCF-7細胞生長的抑制作用 置顯微鏡下觀察,PC作用后的細胞排列稀疏,隨作用時間延長和藥物濃度的增加細胞密度逐漸減少。各劑量組PC對MCF-7細胞的增殖均有一定的抑制作用,抑制率與藥物濃度和作用時間呈正相關。結果見圖1。
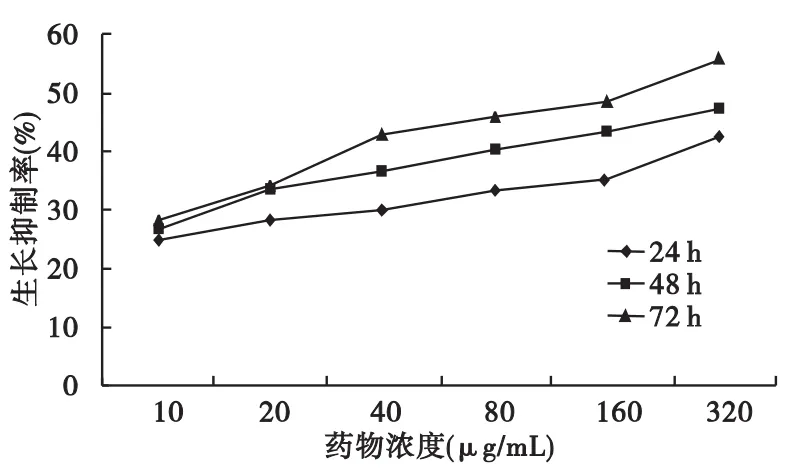
圖1 PC對MCF-7細胞增殖的抑制作用
2.2 PC對 MCF-7細胞凋亡的影響 40、80、160 μg/mL PC作用于MCF-7細胞后的細胞凋亡率明顯高于對照組,隨著劑量的增加,細胞凋亡率明顯增加,并出現凋亡典型性特征峰。見表1。
表1 PC對MCF-7細胞凋亡的影響(,n=3)

表1 PC對MCF-7細胞凋亡的影響(,n=3)
注:與細胞對照組比較,*P<0.001
組別 劑量(μg/mL) 凋亡率(%)細胞對照7.57±0.37順鉑 40 22.49±0.28*PC 40 22.37±0.31*PC 80 31.25±0.38*PC 160 53.42±0.42-*
2.3 PC對MCF-7細胞周期的影響 PC作用48 h后,細胞周期均受到不同程度的影響,與對照組相比,3個劑量組G2-M期細胞比例均顯著增加(P<0.01);且隨著藥物劑量的增加,G2-M期的比例也增加;G0-G1期和S期略有減少,但與對照組比較差異無統計學意義。提示PC可通過G2-M期阻滯抑制乳腺癌細胞的生長,見表2。
表2 PC對MCF-7細胞周期的作用(,n=3)
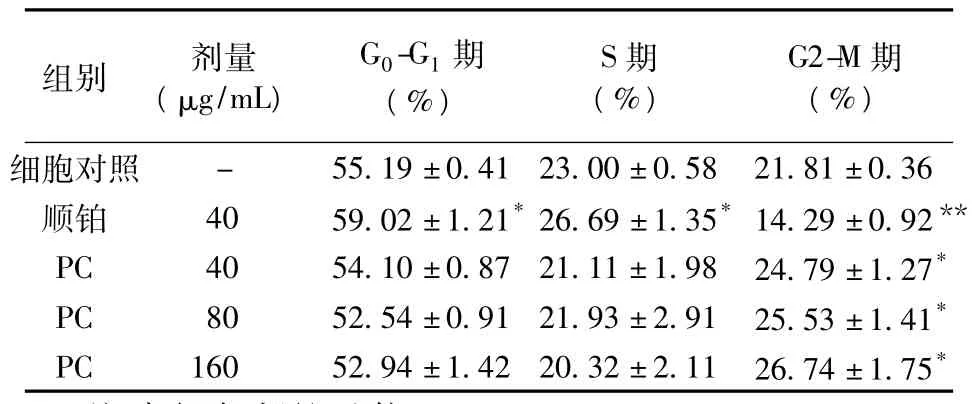
表2 PC對MCF-7細胞周期的作用(,n=3)
注:與細胞對照組比較,*P<0.01,**P<0.001
細胞對照- 55.19±0.41 23.00±0.58 21.81±0.36順鉑 40 59.02±1.21*26.69±1.35*14.29±0.92**PC 40 54.10±0.87 21.11±1.98 24.79±1.27*PC 80 52.54±0.91 21.93±2.91 25.53±1.41*PC 160 52.94±1.42 20.32±2.11 26.74±1.75*
2.4 對Caspase-9、Caspase-12蛋白表達的影響PC 3個劑量組Caspase-12蛋白表達均高于對照組(P <0.05 或 0.01);在 40、80 μg/mL 劑量下,PC亦促進Caspase-9蛋白表達(P<0.01),見表3。

表3 PC對MCF-7細胞Caspase-9、Caspase-12蛋白表達的影響
3 討論
乳腺癌是女性常見的惡性腫瘤之一,嚴重危害婦女健康。乳腺癌具有易復發轉移的特性,部分患者在確診時已有遠處轉移。原花青素作為一種天然藥物,水溶性好,極易被機體吸收,生物利用度高達90%以上,具有廣泛的藥理作用。現代研究發現,其抗腫瘤作用較強,可選擇性抑制各種腫瘤細胞的生長,但對正常組織和細胞無殺傷作用,在抗腫瘤治療方面有巨大潛力[4]。
細胞凋亡不僅直接影響機體組織的正常發育、分化與死亡,在腫瘤治療中的作用也已受到極大的重視[5-6]。目前認為,誘導細胞凋亡主要有Caspase依賴途徑和非Caspase依賴途徑,以前者為主[7-8]。而根據通路中的起始Caspase蛋白不同,Caspase依賴途徑又可分為3種:①死亡受體通路,激活的Caspase-8可激活下游效應Caspase裂解多種蛋白質而最終導致細胞凋亡;②內質網介導細胞凋亡通路,Caspase-12位于內質網膜,內質網鈣離子失衡或者蛋白過量表達都會誘導產生Caspase-12,同時也導致胞質的Caspase-7轉移到內質網表面,Caspase-7激活 Caspase-12,激活的Caspase-12可進一步剪切Caspase-3而引發細胞凋亡;③線粒體介導細胞凋亡,線粒體中的促凋亡蛋白受到凋亡信號刺激,釋放到細胞質,激活Caspase-9及下游的Caspase-3、7或6,其最終都能激活凋亡執行者Caspase-3,水解細胞成分而使細胞凋亡。
本實驗分別采用MTT法和流式細胞術探討PC對乳腺癌MCF-7細胞增殖、凋亡和細胞周期的影響。實驗結果表明,PC能夠有效殺傷乳腺癌MCF-7細胞,抑制其增殖,細胞抑制率呈濃度、時間依賴性,且細胞形態發生明顯改變。PC能夠明顯將細胞周期阻滯在G2-M期,并可促進細胞凋亡,其在誘導MCF-7細胞凋亡的同時,基因蛋白Caspase-12表達顯著增加,中、低濃度時也可誘導Caspase-9表達增加,提示PC抑制人乳腺癌MCF-7細胞的作用機制與阻滯細胞周期于G2-M期和誘導細胞凋亡有關,該細胞凋亡誘導途徑與Caspase有關,可能涉及Caspase家族的內質網和線粒體2條激活通路。細胞凋亡激活信號通路十分復雜,不同信號分子之間相互聯系[9],有待進一步研究。
[1]Mitsunaga T.Anti-caries activity of bark proanthocyanidins[J].Basic Life Sci,1999,66:555-573.
[2]Vayalil PK,Mittal A,Katiyar SK.Proanthocyanidins from grape seeds inhibit expression of matrix metalloproteinases in human prostate carcinoma cells,which is associated with the inhibition of activation of MAPK and NF kappa B[J].Carcinogenesis,2004,25(6):987-995.
[3]Smart DJ,Halicka HD,Traganos F,et al.Ciprofloxacin induced G2 arrest and apoptosis in TK6 lymphoblastoid cells is not dependent on DNA double-strand break formation[J].Cancer Biol Ther,2008,7(1):113-119.
[4]Wu L,Huang Z,Qin P,et al.Chemical characterization of a procyanidin-rich extract from sorghum bran and its effect on oxidative stress and tumor inhibition in vivo[J].Agric Food Chem,2011,59,8609-8615.
[5]王炎,李琦,范忠澤,等.丹參酮ⅡA介導p38 MAPK信號轉導誘導人肝癌細胞凋亡[J].世界華人消化雜志,2009,17:124-129.
[6]Lee SK,Kim HN,Kang YR,et al.Obovatol inhibits colorectal cancer growth by inhibiting tumor cell proliferation and inducing apoptosis[J].Bioorg Med Chem,2008,16:8397-8402.
[7]Vaidya S,Velázquez-Delgado EM,Abbruzzese G,et al.Substrate-induced conformational changes occur in all cleaved forms of caspase-6[J].J Mol Biol,2011,406(1):75-91.
[8]Reuter S,Eifes S,Dicato M,et al.Modulation of anti-apoptotic and survival pathways by curcumin as a strategy to induce apoptosis in cancer cells[J].Biochemical Pharmacology,2008,76:1340-1351.
[9]楊潔,鄧子鯤,朱彤陽,等.腫瘤壞死因子相關凋亡誘導配體臨床治療應用前景[J].世界臨床藥物,2012,33(2):105-115.

