高遷移率族蛋白B1單抗對急性壞死性胰腺炎小鼠的保護作用及其機制研究
夏敏 張婷 郭繼中 陳衛昌
·短篇論著·
高遷移率族蛋白B1單抗對急性壞死性胰腺炎小鼠的保護作用及其機制研究
夏敏 張婷 郭繼中 陳衛昌
高遷移率族蛋白B1(high mobility group box chromosomal protein 1, HMGB1)是一類廣泛存在于真核細胞內的非組核蛋白,它通過結合晚期糖基化終端產物受體(receptor for advanced glycated end-products,RAGE)及Toll樣受體(toll-like receptor,TLR)家族成員TLR2和TLR4進行信號轉導,誘導NF-κB核移位,觸發炎癥反應[1]。HMGB1作為晚期炎癥因子參與了急性胰腺炎的全身炎癥反應[2]。本研究應用HMGB1單抗干預急性壞死性胰腺炎(acute necrotizing pancreatitis, ANP)小鼠,探討其保護機制。
一、材料與方法
1.實驗動物及分組:雄性ICR(Institute for Cancer Research)小鼠108只,體重20~25 g,由江蘇省血吸蟲病防治研究所動物房提供。按隨機表法分為正常對照組、ANP組和HMGB1單抗處理組(HMGB1)。參照文獻[3],采用腹腔注射20%L-精氨酸(200 mg/100 g體重)2次、間隔1 h的方法制備ANP模型。HMGB1組于制模24 h后腹腔內注射HMGB1單抗200 μg[4],正常對照組及ANP組大鼠腹腔注射等容積無菌生理鹽水。注射后12、24、48 h分批處死大鼠,取血和新鮮胰腺組織。
2.血清HMGB1濃度測定:采用ELISA法。試劑盒購自日本SHINO-TEST公司,嚴格按說明書操作。
3.胰腺組織HMGB1 mRNA表達檢測:應用Trizol提取小鼠胰腺組織RNA,逆轉錄合成cDNA,實時熒光定量PCR法檢測HMGB1 mRNA的表達,以三磷酸甘油醛脫氫酶(GAPDH)作為內參。HMGB1引物序列上游5′-ACAGCCATTGCAGTACATTGAG-3′,下游5′-TTGCCCATGTTTAGTTGATTTTCC-3′,熒光探針序列:5′-(FAM)AGAGTCGCCCAGTGCCCGTCCG (Eclipse)-3′,擴增片段113 bp。PCR反應條件:95℃ 30 s,95℃ 5 s、58℃ 30 s,40個循環,最后72℃延伸1 min。采用LightCycler熒光定量PCR儀,通過儀器自帶軟件記錄循環周期數(crossing point,CP),計算△CP值,表示mRNA表達量。
4.細胞凋亡及壞死測定:將新鮮胰腺組織制成勻漿,應用Annexin V/PI雙染色法在流式細胞儀上檢測細胞凋亡及壞死。
5.胰腺組織NF-κB蛋白表達檢測:采用常規免疫組化法檢測NF-κB的表達。應用Tiger 920圖像分析軟件掃描計算陽性面積的積分光吸收值和平均光吸收值作為蛋白的表達量。
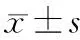
二、結果
1.小鼠血清HMGB1濃度的變化:ANP組小鼠血清HMGB1濃度顯著高于正常對照組,HMGB1組顯著低于ANP組(表1)。
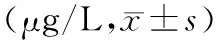
表1 3組小鼠血清 HMGB1濃度的變化
注:與正常對照組比較,aP<0.05;與ANP組比較,bP<0.05
2.小鼠胰腺組織HMGB1 mRNA表達的變化: ANP組小鼠胰腺組織HMGB1 mRNA表達顯著高于正常對照組,HMGB1組的表達顯著低于ANP組,但仍顯著高于正常對照組(表2)。
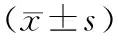
表2 3組小鼠胰腺組織 HMGB1 mRNA 表達
注:與正常對照組比較,aP<0.05;與ANP組比較,bP<0.05
3.小鼠胰腺細胞凋亡和壞死率的變化:ANP組小鼠胰腺細胞壞死率顯著高于正常對照組,而凋亡率顯著低于正常對照組;HMGB1組小鼠胰腺細胞壞死率較ANP組顯著減少,而凋亡率顯著增加(表3,圖1)。
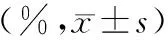
表3 3組小鼠胰腺細胞的凋亡率及壞死率比較
注:與正常對照組比較,aP<0.05;與ANP組比較,bP<0.05
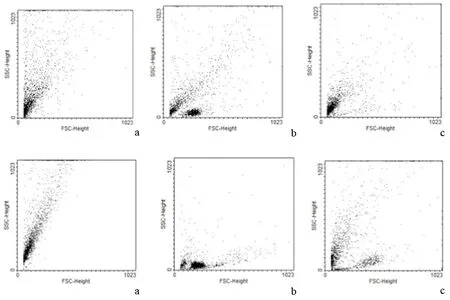
圖1對照組(a)、ANP組(b)、HMGB1組(c)胰腺細胞的凋亡(上,24 h)和壞死(下,48 h)
4.小鼠胰腺組織NF-κB表達的變化:對照組、ANP、HMGB1組小鼠胰腺組織在48 h時的NF-κB表達量分別為88.93±2.07、295.16±20.76、81.11±9.02(圖2)。ANP組顯著高于對照組(P<0.05);HMGB1組顯著低于ANP組(P<0.05),而與對照組的差異無統計學意義。運用線性回歸統計學分析,ANP組小鼠48 h時的血清HMGB1濃度與胰腺NF-κB表達水平呈線性正相關(r=0.883,P<0.05,圖3)。
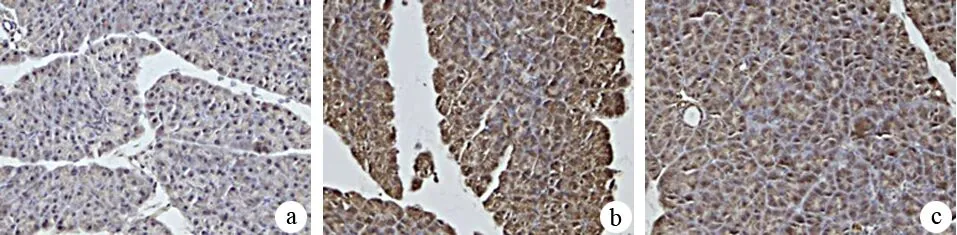
圖2對照組(a)、ANP組(b)、HMGB1組(c)胰腺組織NF-κB表達(免疫組化 ×400)
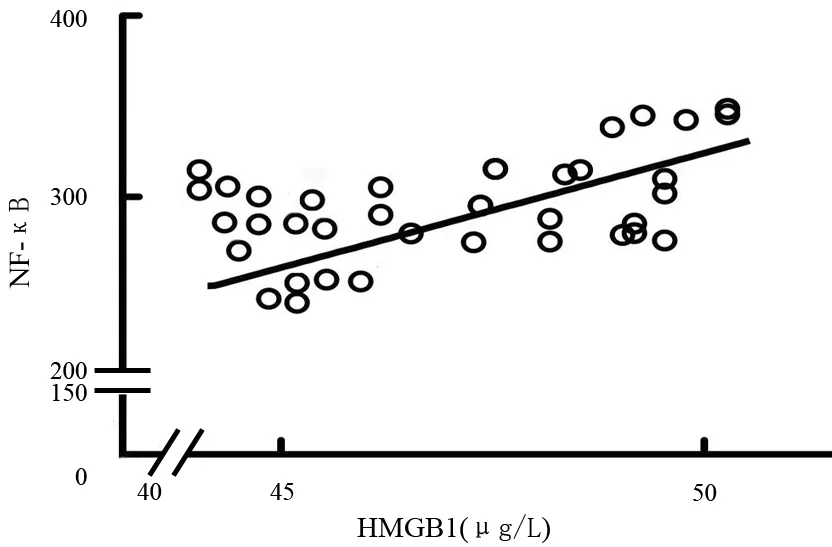
圖3 建模后48 h血清HMGB1濃度與NF-κB表達的相關性
討論重癥急性胰腺炎時炎性細胞因子的大量釋放可導致全身炎癥反應綜合征(SIRS),并進一步惡化發展為多器官功能障礙綜合征(MODS)、多器官功能衰竭(MOF)。早期釋放的炎癥因子如TNF-α和IL-1β等均在發病后迅速升高至峰值,隨即迅速下降,但炎癥反應和臟器損害仍在繼續,提示可能有某些晚期炎癥因子參與了病理過程。近年來大量研究結果表明,HMGB1可能作為重要的晚期炎癥遞質參與急性胰腺炎的全身炎癥反應。本研究采用腹腔內注射L-精氨酸制作小鼠ANP模型,結果顯示血清HMGB1水平在建模后12 h開始明顯升高,24 h至高峰,48 h仍維持在較高水平;胰腺組織HMGB1 mRNA表達水平在建模后12 h開始升高,24 h顯著升高。ANP時小鼠血清HMGB1濃度的升高可能有兩方面的機制,首先ANP時炎性因子過度激活,激活的巨嗜細胞/單核細胞主動分泌HMGB1,其次與ANP時受損的器官產生和釋放HMGB1有關。給予HMGB1單抗干預后胰腺組織HMGB1 mRNA表達水平明顯下降,血清HMGB1濃度也明顯下降。
細胞凋亡已被證實在許多生物過程中起著重要的調節作用,包括炎癥反應。內毒素、燒傷、缺血等均可導致相關臟器的細胞凋亡。1995年Kaise等[5]報道,ANP大鼠胰腺見大量壞死細胞,凋亡細胞少見;而急性水腫型胰腺炎(AEP)大鼠胰腺見大量凋亡細胞,壞死細胞少見。作者認為凋亡細胞對腺泡細胞的保護作用阻止了AEP向ANP的發展。Saluja等[6]的動物實驗也證實了相似的結論,預先誘發細胞凋亡能防止胰腺腺泡的損傷,減少ANP的發生。本實驗結果顯示,ANP小鼠胰腺腺泡細胞壞死率較對照組顯著增高,凋亡率明顯降低,HMGB1單抗抑制HMGB1表達后胰腺壞死率顯著降低,凋亡率增高,表明HMGB1的表達與凋亡逃逸有關。凋亡細胞不釋放HMGB1,不會觸發炎癥反應;相反,壞死細胞HMGB1松散地結合在分裂間期和分裂期的細胞核上,當細胞壞死、細胞膜通透性升高、細胞膜的完整性破壞后,HMGB1很快就泄漏至細胞外。HMGB1作為一種內源性危險信號提醒機體免疫系統警覺壞死細胞的存在,適度的細胞凋亡對ANP時胰腺腺胞細胞可能具有保護作用。
HMGB1通過與細胞表面不同受體例如晚期糖基化終端產物受體RAGE、Toll樣受體家族TLR2和TLR4相結合啟動炎癥反應[7],與這些受體結合后可導致NF-κB信號途徑激活,促進炎癥介質TNF-α、IL-6、INF-γ的產生[8]。有作者認為,NF-κB的激活對AP的發生、發展和持續惡化起了非常關鍵的作用[9]。本研究結果顯示,NF-κB的表達與ANP小鼠HMGB1血清濃度呈正相關;HMGB1單抗抑制血清HMGB1水平的同時可降低NF-κB的濃度,提示HMGB1可能通過激活NF-κB信號轉導途徑介導炎癥反應。因此通過各種途徑下調血清HMGB1水平或拮抗其作用,阻斷炎癥瀑布反應是臨床防治重癥急性胰腺炎的關鍵。
[1] Park JS, Svetkauskaite D, He Q, et al. Involvement of toll-like receptors 2 and 4 in cellular activation by high mobility group box 1 protein. J Biol Chem, 2004, 279: 7370-7377.
[2] Yasuda T, Ueda T, Shinzeki M, et al. Increase of high-mobolity group box chromosomal protein 1 in blood and injured organs in experimental severe acutepancreatitis. Pancreas, 2007, 34:487-488.
[3] 趙秋玲,黃承鈺,徐家玉,等.L-精氨酸誘導小鼠急性壞死性胰腺炎模型的建立.疾病控制雜志,2004, 8:141-143.
[4] Sawa H, Ueda T, Takeyama Y, et al. Blockade of high mobility group box-1 protein attenuates experimental severe acute pancreatits. World J Gastroenterol, 2006, 12: 7666-7670.
[5] Kaiser AM, Saluja AK, Sengupta A, et al. Relationship between severity, necrosis and apoptosis in five models of experimental acute pancreatitis. Am J Physiol, 1995, 269:c1295-c1304.
[6] Saluja A, Hofbauer B, Yamaguchi Y, et al. Induction of apoptosis reduces the severity of caerulein-induced pancreatitis in mice. Biochem Biophys Res Commun, 1996, 220:875-878.
[7] Lotze MT,Tracey KJ. High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal. Nat Rev Immunol, 2005, 5:331-342.
[8] Yang H, Tracey KJ. Targeting HMGB1 in inflammation. Biochim Biophys Acta, 2010, 1799:149-156.
[9] Rakonczay Z Jr, Hegyi P, Takacs T, et al. The role of NF-kB activation in the pathogenesis of acute pancreatitis. Gut, 2008, 57:259-267.
2012-08-09)
(本文編輯:屠振興)
10.3760/cma.j.issn.1674-1935.2013.04.019
214023 無錫,南京醫科大學附屬無錫人民醫院消化科(夏敏、郭繼中);江蘇省中醫院消化科(張婷);蘇州大學附屬第一醫院消化科(陳衛昌)
夏敏,Email:xmzb11013@163.com

