卵巢成熟性囊性畸胎瘤伴中-低分化鱗癌1例并文獻復(fù)習(xí)
鎮(zhèn)鴻燕 ,陳瓊霞 ,劉麗江
(1.江漢大學(xué) 第二附屬醫(yī)院病理科,湖北 武漢 430050;2.江漢大學(xué) 醫(yī)學(xué)院病理學(xué)與病理生理學(xué)教研室,湖北 武漢 430056; 3.江大病理診斷所,湖北 武漢 430056)
成熟性囊性畸胎瘤(teratoma)是來源于原始生殖細胞的常見腫瘤,最常發(fā)生于卵巢,約占卵巢腫瘤的10%~20%。該腫瘤大多數(shù)為良性,預(yù)后好,其中1%~2%的病例可以發(fā)生惡性變,以鱗狀細胞癌最為常見(75%~90%)[1-2]。盡管成熟性囊性畸胎瘤伴鱗癌是臨床上最常見的類型,但是在術(shù)前以及術(shù)中明確該型腫瘤的診斷仍有困難,這是導(dǎo)致病人預(yù)后不良的重要原因之一。此外,術(shù)后病理學(xué)檢查是否仔細規(guī)范,也是造成漏診的原因之一[3]。筆者報道1例近期診斷的卵巢成熟性囊性畸胎瘤伴鱗狀細胞癌的體會,并結(jié)合文獻復(fù)習(xí)提高對該病的認識,以解決臨床病理的診斷與鑒別診斷問題。
1 資料與方法
1.1 臨床資料
女性,55歲,23歲結(jié)婚,妊娠1次產(chǎn)1次,絕經(jīng)5年。下腹部包塊20余年,因無明顯誘因出現(xiàn)的下腹部脹痛不適及腹部可捫及包塊而就診。B超檢查發(fā)現(xiàn)卵巢區(qū)10 cm×10 cm囊性病變。CT檢查發(fā)現(xiàn):約相當于盆腔層面可見脂肪、液體及實性密度構(gòu)成的包塊,形如“水上浮蓮”,前腹壁顯突起,稍顯受壓。提示盆腔多種成分包塊,考慮為畸胎瘤(圖1)。術(shù)中見腹腔一巨大囊性包塊,約15 cm×15 cm×15 cm大小,起源于右側(cè)附件,并與左側(cè)附件粘連,切開內(nèi)見黃色液體約1000 mL,并含毛發(fā)。臨床診斷:右卵巢成熟性囊性畸胎瘤。
1.2 方法
手術(shù)切除標本經(jīng)10%中性福爾馬林固定,常規(guī)石蠟包埋,HE染色。免疫組化染色采用SP法,抗體PCK、CK5/6、p63、α-inhibin、Vimentin等特異性抗體及免疫組化染色試劑盒均購自北京中杉生物制品有限公司,以已知陽性片或內(nèi)對照、出現(xiàn)棕色顆粒為陽性結(jié)果判斷。
2 結(jié)果
2.1 巨檢
送檢手術(shù)切除的灰白灰褐色囊狀腫物,18 cm×11 cm×7 cm,囊內(nèi)含脂質(zhì)與毛發(fā),可剝離,囊壁較光滑,未見液體及黏液成分。囊內(nèi)一側(cè)見4 cm×3 cm灰白色實性區(qū)域,切面灰白色、質(zhì)脆(圖2)。
2.2 鏡檢
腫瘤囊壁組織見內(nèi)襯鱗狀上皮,其下方可見皮脂腺、毛囊及毛發(fā);實性區(qū)域主要為增生的纖維組織,夾雜有較多的炎性細胞,以慢性炎性細胞為主。在增生的纖維組織及浸潤的炎性細胞中,可見散在的核大深染的呈彌漫和小片狀排列的細胞,核仁不明顯,部分細胞呈梭型。再次在灰白色實性區(qū)取材,鏡下見不同分化階段的鱗狀細胞癌成分。小片狀高分化鱗癌區(qū)可見細胞內(nèi)角化、細胞間橋及角化珠。
2.3 免疫組化染色結(jié)果
PCK及CK5/6:惡性細胞細胞呈陽性表達(圖3~圖5),p63:惡性腫瘤細胞呈陽性表達,α-inhibin陰性,Vimentin陰性。
2.4 病理診斷
(右卵巢)成熟性囊性畸胎瘤伴中-低分化鱗狀細胞癌。
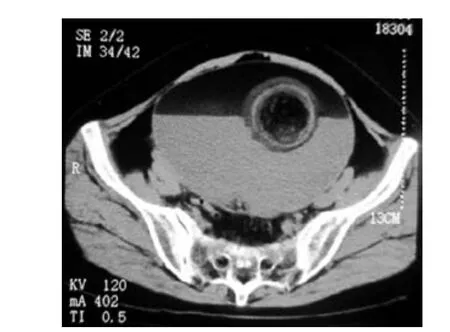
圖1 盆腔層面可見脂肪、液體及實性密度構(gòu)成的包塊,形如“水上浮蓮”
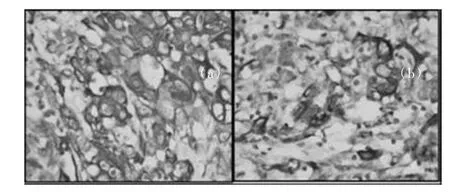
圖5 (a) 惡性腫瘤細呈CK5/6陽性,SP法;圖5(b)惡性腫瘤細胞呈PCK灶狀陽性,SP法
3 討論
畸胎瘤(teratoma)是源于減數(shù)分裂后的生殖細胞的腫瘤[4],具有向體細胞多項分化的潛能,大多數(shù)腫瘤含有至少2~3個胚層。畸胎瘤多發(fā)于卵巢,約占所有卵巢腫瘤的10%~20%。
成熟性囊性畸胎瘤伴鱗狀細胞癌是卵巢畸胎瘤中發(fā)生惡性轉(zhuǎn)化的最常見的組織學(xué)類型,約占成熟性囊性畸胎瘤惡性轉(zhuǎn)化的75%~90%[1-2]。其發(fā)病年齡最小19歲,最大87歲,一般在45~60歲之間,平均年齡為 55歲[3]。Kikkawa等[4]研究一組病例后發(fā)現(xiàn),成熟性囊性畸胎瘤的平均發(fā)病年齡為37.5歲,腫塊大小平均為8.8 cm,而成熟性囊性畸胎瘤伴鱗狀細胞癌則平均為55.2歲,腫塊大小平均為15.2 cm,并據(jù)此認為年齡及腫塊大小是鑒別診斷的重要依據(jù)之一,提出45歲以上的病例要考慮成熟性囊性畸胎瘤伴鱗狀細胞癌的可能。因此,尤其是絕經(jīng)期婦女出現(xiàn)的下腹疼痛及可觸及的較大腫塊要考慮成熟性囊性畸胎瘤伴鱗狀細胞癌。本例由于臨床醫(yī)生對病人的年齡以及腹部出現(xiàn)的較大腫塊重視不夠,加之B超檢查提示卵巢區(qū)的囊性病變,從而忽視了伴有惡性轉(zhuǎn)化的可能。CT檢查發(fā)現(xiàn)囊性包塊中含實性病變區(qū),也沒有引起臨床醫(yī)師的足夠注意,從而在術(shù)前沒有考慮成熟性囊性畸胎瘤伴鱗狀細胞癌的診斷。
成熟性囊性畸胎瘤伴鱗狀細胞癌預(yù)后較差,5年生存率為52%,腫瘤的分期、組織學(xué)的分化程度及血管有無浸潤將會影響病人的預(yù)后,特別是出現(xiàn)血管浸潤的病例病死率較高[5]。
術(shù)后病理學(xué)檢查發(fā)現(xiàn)成熟性囊性畸胎瘤伴鱗狀細胞癌是該病確診的重要途徑,典型病變病理診斷沒有困難。本例在形態(tài)學(xué)上表現(xiàn)為增生的纖維組織,夾雜有較多的炎性細胞,其間散在的核大深染的腫瘤細胞呈彌漫排列。如果觀察不仔細以及未進行進一步的檢查,極易漏診。總結(jié)本例病理診斷的體會是,對于成熟性囊性畸胎瘤的實性病變區(qū)域,應(yīng)該進行詳細的巨檢和鏡檢,尤其是對于年齡在45歲以上的絕經(jīng)婦女并伴有下腹部疼痛病史的病例。本研究在對囊性病變中出現(xiàn)4 cm×3 cm灰白色實性區(qū)域進行的多點取材,為該病例的正確診斷打下了基礎(chǔ)。
組織學(xué)上,成熟性囊性畸胎瘤伴鱗狀細胞癌以高-中等分化的鱗癌多見,HE染色下的診斷不困難。但是,由于本例在形態(tài)學(xué)上表現(xiàn)出了腫瘤細胞異質(zhì)性特點,初檢時筆者考慮惡性轉(zhuǎn)化部分為間葉來源,后經(jīng)多點取材以及免疫組化染色(PCK及CK5/6陽性,Vimentin陰性)證實為中-低分化鱗狀細胞癌。該例病理診斷的經(jīng)過再次提示,仔細的病理學(xué)檢查和免疫組化染色的應(yīng)用在確診上具有非常重要的價值。
成熟性囊性畸胎瘤伴鱗狀細胞癌的發(fā)病機制并不清楚,Devouassoux-Shisheboran等[6]報道,對于成熟性畸胎瘤伴發(fā)的惡性成分,進行選擇性組織顯微切割和基因分析顯示,惡性成分與成熟畸胎瘤組織一致,為純合子基因型,說明兩者之間存在關(guān)聯(lián)。Hirakawa等[3]研究發(fā)現(xiàn):28例成熟性囊性畸胎瘤伴發(fā)鱗狀細胞癌病例中11例鱗癌源于纖毛或非纖毛柱狀上皮或源于化生的鱗狀上皮,但結(jié)果還有待于進一步證實。
[1]Tangjitgamol S,Manusirivithaya S,Sheanakul C,et al.Squamous cell carcinoma arising from dermoid cyst:case reports and review of literature[J].Int J Gynecol Cancer,2003,13(4):558-563.
[2]Park J Y,Kim D Y,Kim J H,et al.Malignant transfor?mation of mature cystic teratoma of the ovary:experi?ence at a single institution[J].Eur J Obstet Gynecol Re?prod Biol,2008,14(2):173-178.
[3]Hirakawa T,Tsuneyoshi M,Enjoji M.Squamous cell carcinoma arising in mature cystic teratoma of the ova?ry:clinicopathologic and topographic analysis[J].Am J Surg Pathol,1989,13(5):397-405.
[4]Kikkawa F,Nawa A,Tamakoshi K,et al.Diagnosis of squamous cell carcinoma arising from mature cystic ter?atoma of the ovary[J].Cancer, 1998,82(11):2249-2255.
[5]Hackethal A,Brueggmann D,Bohlmann M K,et al.Squamous-cell carcinoma in mature cystic teratoma of the ovary:systematic review and analysis of published data[J].Lancet Oncol,2008,9(12):1173-1180.
[6]Devouassoux-Shisheboran M,Vortmeyer A O,Silver S A,et al.Teratomatous genotype detected in malignan?cies of a non-germ cell phenotype[J].Lab Invest,2000,80(1):81-86.

