化學交聯與酶法交聯對魚糜-明膠復合膜性質的影響*
陶忠,鄭惠彬,翁武銀
(集美大學生物工程學院,福建 廈門,361021)
近年來,利用多糖、蛋白質和脂類等天然高分子制備可降解/可食性包裝材料已成為國內外研究的熱點,其中蛋白質因具有良好的成膜性能和較高的營養價值而備受關注。另一方面,我國水產品年加工量已經超過1 600 萬t[1],在魚糜生產和凍魚片加工中必然會產生大量魚皮、碎肉等下腳料。目前,這些下腳料主要是用于生產魚粉等低值產品,有些甚至直接被丟棄,不僅造成資源浪費,而且污染環境。
研究表明,魚肉蛋白和魚皮明膠都可以制備蛋白可食膜[2-3],但蛋白質中大量的親水性氨基酸會導致形成的可食膜的耐水性能較差。利用化學交聯劑和酶交聯劑不僅可以改善蛋白膜的機械性能,還可以提高膜的耐水性能[4-5]。其中,戊二醛由于價格低廉、交聯效率高,作為化學交聯劑已被應用于明膠蛋白膜[3,6]、乳清分離蛋白膜[7]和大豆蛋白膜[8]的性質改良。另一方面,相對于戊二醛的安全問題,酶交聯劑在食品中的應用沒有受到嚴格控制。谷氨酰胺轉胺酶(TGase)作為常用的酶交聯劑可以提高大豆蛋白膜[5,9]、明膠蛋白膜[10]的機械性能和耐水性能。而且,隨著微生物發酵法生產TGase 的技術不斷成熟,利用TGase 改良可食膜的生產成本也逐漸下降[7]。然而有關利用戊二醛或TGase 改良魚糜-明膠復合膜的性質目前鮮見報道。
因此,本研究利用戊二醛和TGase 對魚糜-明膠復合膜進行性質改良,比較化學交聯與酶法交聯對復合膜性質的影響,旨在為利用交聯劑改良蛋白膜的性能提供基礎數據。
1 材料與方法
1.1 材料與試劑
冷凍鰱魚魚糜(A 級,蛋白含量為16.8%,水分含量為78.1%),福建安井食品有限公司;新鮮的白鰱魚魚皮,廈門同安源水水產食品有限公司;戊二醛溶液(AR),國藥集團化學試劑有限公司;TGase(酶活力100 ~120 U/g,食品級),南寧龐博生物工程有限公司;DC 蛋白測定試劑盒,美國Bio-Rad 公司;2,4,6-三硝基苯磺酸(TNBS),Sigma 公司。
1.2 儀器與設備
Avanti J-25 高速冷凍離心機,美國Beckman 公司;FA25 高剪切分散乳化機,上海弗魯克流體機械制造有限公司;SPX 智能型恒溫恒濕箱,寧波萊福科技有限公司;厚度儀,日本Ozaki MFG 公司;TMS-PRO質構儀,美國Food Technology 公司;UV-2600A 型紫外分光光度計,上海元析儀器有限公司;WSC-S 測色色差計,上海精密科學儀器有限公司;UM113 型攪拌脫泡機,日本Unix 有限公司;FT/IR-480 型傅里葉變換紅外光譜儀,日本JASCO 公司。
1.3 實驗方法
1.3.1 蛋白膜的制備
白鰱魚魚皮利用0.05 mol/L NaOH 在10 ℃下浸泡16 h,清水漂洗,利用0.05 mol/L HCl 在室溫下浸泡2 h 后,用蒸餾水漂洗至中性。經過酸堿處理的魚皮利用80 ℃熱水浸提1 h 后,迅速冷卻至室溫,通過離心(15 000 ×g,25 ℃,20 min)分離獲得上清液,調制成蛋白濃度為2%的明膠蛋白溶液。將4 ℃下解凍的魚糜在冰浴條件下攪拌30 min,利用高剪切分散乳化機(16 000 r/min)均質90 s,調制成蛋白濃度為2%的魚糜蛋白溶液。將明膠蛋白溶液和魚糜蛋白溶液按照1∶1 混合均勻后,調pH 至8.0,添加蛋白質量20%的甘油制備成膜液。為了研究交聯劑對復合膜性質的影響,膜液中分別添加了蛋白質量0.025% ~0.2%的戊二醛或0.5% ~2.5%的TGase,然后利用攪拌脫泡機進行脫泡。將脫泡后的成膜液(4 g)倒在5 cm× 5 cm 的有機硅樹脂框內,先在溫度25 ℃下干燥15 h,接著在45 ℃下干燥1 h,最后冷卻至室溫進行揭膜。將獲得的蛋白膜放在25 ℃,相對濕度50%的恒溫恒濕箱中平衡24 h 后,作為以下實驗的測試樣品。
1.3.2 機械性能的測定
蛋白膜的機械性能按照參考文獻[11]進行測定。
1.3.3 顏色和透明度值的測定
蛋白膜的顏色利用WSC-S 測色色差計進行測定。膜的顏色參數為L*(黑-白),a*(綠-紅),b*(藍- 黃),其中白板的參數為L*=91.86,a*= -0.88,b*=1.42。透明度值按照參考文獻[11]進行測定。
1.3.4 蛋白溶解率和固形物溶解率的測定
將蛋白膜放在含有0.1% 疊氮鈉水溶液中,在30 ℃下保溫24 h 后,未溶解的蛋白膜利用105 ℃常壓干燥測定其重量,溶解在水中的蛋白根據Lowry法[12]進行測定。蛋白膜在水中的蛋白溶解率為溶解的蛋白質量占膜中總蛋白質量的百分數,固形物溶解率為溶解的蛋白膜質量占蛋白膜總質量的百分數。
1.3.5 交聯度的測定
蛋白膜用液氮研磨成粉末,在硅膠中干燥一周以上,其交聯度利用蛋白膜粉末根據Bubnis 等[13]的方法添加TNBS 進行反應,反應結束后利用乙醚萃取去除未反應的TNBS 和TNP-α-氨基酸,并利用沸水浴去除殘留的乙醚后,在346 nm 下測定吸光度值。未添加交聯劑的蛋白膜的有效賴氨酸含量為100,交聯度計算:
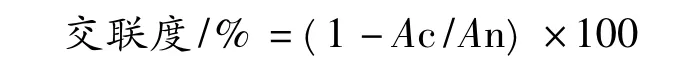
式中,Ac和An分別為添加交聯劑和未添加交聯劑的樣品的吸光度值。
1.3.6 SDS-聚丙烯酰胺凝膠電泳( SDS-PAGE)
蛋白膜利用2%SDS、8 mol/L 尿素、2%β-巰基乙醇、20 mmol/L Tris-HCl(pH 8.8)蛋白變性劑進行溶解后,溶解的蛋白利用8%的分離膠在8 mA 電流下進行電泳,然后用考馬斯亮藍R-250 染色液染色,最后用脫色液(V甲醇∶V乙酸∶V水=30∶10∶60)脫色到背景完全透明為止。
1.3.7 傅立葉變換紅外光譜( FTIR)
蛋白膜的FTIR 參照Tang 等[14]的方法進行分析。將干燥的蛋白膜粉末與KBr 按1∶100 質量比混合,研磨均勻后壓成薄片,利用傅里葉變換紅外光譜儀對其進行紅外表征,掃描波長范圍為4 000 ~400 cm-1。
1.3.8 數據統計與分析
所有數據采用SPSS 16.0 軟件(SPSS Inc,Chicogo,IL,USA)分析,用ANOVA 進行方差分析,顯著性檢驗方法為鄧肯多重檢驗,檢測限為0.05[15]。
2 結果與分析
2.1 機械性能
表1 顯示了添加戊二醛、TGase 對魚糜-明膠復合膜機械性能的影響。
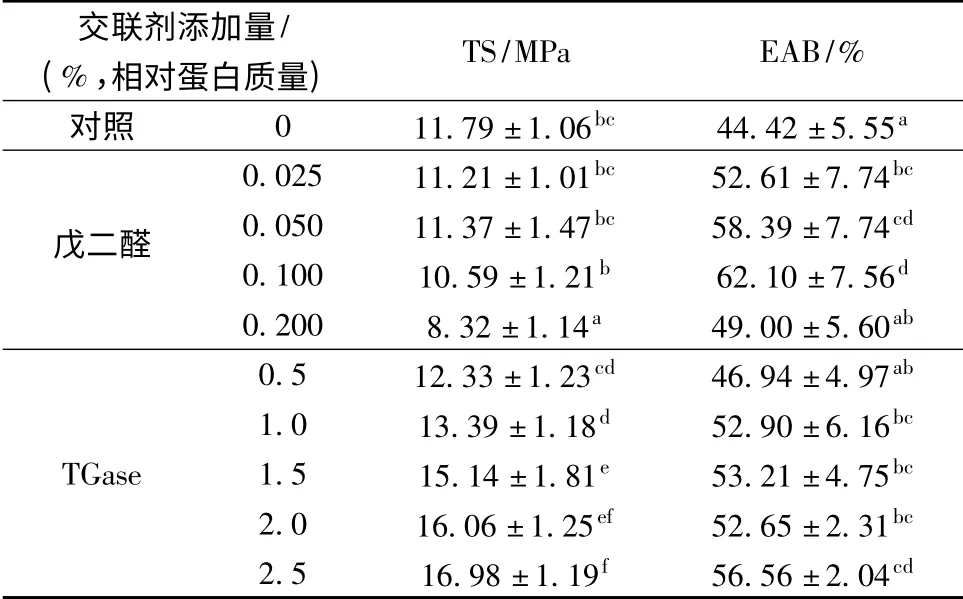
表1 添加戊二醛/TGase 對魚糜-明膠復合膜抗拉伸強度(TS)和斷裂延伸率(EAB)的影響Table 1 Effect of glutaraldehyde/TGase content on tensile strength(TS)and elongation at break(EAB)of surimi-gelatin composite films
從表1 可以發現,當戊二醛添加量達到蛋白質量0.1%時,魚糜-明膠復合膜的抗拉伸強度(TS)沒有發生顯著的變化(P>0.05),但進一步提高戊二醛的添加量膜的TS 卻出現明顯的下降。利用TGase 對蛋白膜進行性質改良時,發現膜的TS 隨著TGase 的添加逐漸上升。當TGase 添加量達到蛋白質量的2.5%時,膜的TS 達到對照組的1.4 倍。結果表明TGase 更適合于改良魚糜-明膠復合膜的機械強度。這與報道的戊二醛與蛋白之間發生過度交聯會導致蛋白膜的強度下降[8],而TGase 與蛋白之間主要是通過酶促反應形成致密的網絡結構,可以增強蛋白膜的強度[5,10,16]的結果類似。另一方面,添加一定量的戊二醛或者TGase,膜的EAB 都可以得到提高。通常,EAB 和TS 呈負相關關系[5],但在本研究中沒有發生類似的傾向,這可能是由于戊二醛、TGase 的添加導致膜中蛋白發生共價交聯,結果使膜的韌性、延展性都得到增強[17]。
2.2 顏色和透明度值
色澤是評價食品質量的重要指標,而膜的顏色與光的吸收、透過、反射等相關,通過測定膜的顏色可以反映出成膜過程中可能存在的反應,復合膜顏色的測定結果如表2 所示。伴隨著戊二醛添加量的增加,膜的L*值、a*值略微下降,而b*值卻出現了明顯的上升(P<0.05)。另一方面,添加TGase 對魚糜-明膠復合膜的L*值、a*值沒有顯著的影響,但b*值卻出現一定程度的下降趨勢(P<0.05)。戊二醛容易與蛋白中賴氨酸的氨基發生反應生成席夫堿[18],導致膜的顏色發黃,而TGase 只是促進蛋白發生交聯反應生成ε-(γ-谷氨酰基)-賴氨酸的異肽鍵[16],不會對膜的顏色產生影響,因此添加戊二醛比添加TGase 更容易導致魚糜-明膠復合膜色澤變黃(表2)。
另一方面,由表2 還可以獲知,添加戊二醛對魚糜-明膠復合膜的透明度值沒有顯著影響(P>0.05),但TGase 的添加卻導致膜的透明度值下降。在本文中透明度值越高表示蛋白膜越不透明,因此在魚糜-明膠復合膜中添加TGase 會使膜變得更透明。這可能是TGase 促進魚糜、明膠之間發生分子間和分子內的交聯形成致密均勻的網絡結構,減少光的散射作用,導致膜的透光率增加[19]。
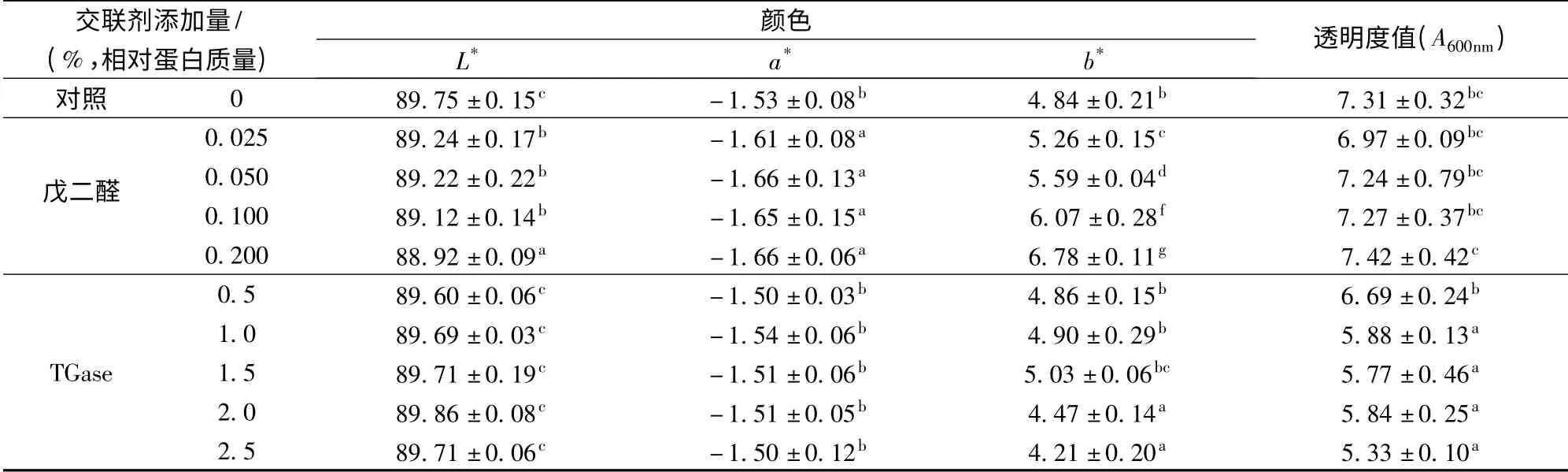
表2 添加戊二醛/TGase 對魚糜-明膠復合膜顏色和透明度值的影響Table 2 Effect of glutaraldehyde/TGase content on color and transparency value of surimi-gelatin composite films
2.3 溶解性
耐水性能是可食膜應用于包裝食品時的重要特性,固形物溶解率可以作為蛋白膜的耐水性能指標[20]。膜的固形物溶解率(FS)和蛋白溶解率(PS)的測定結果如表3 所示。
由表3 可以看出,魚糜-明膠復合膜的FS 為71.80%,說明魚糜和明膠混合制備的蛋白膜其耐水性能較差。不管是添加戊二醛還是添加TGase,伴隨著交聯劑的添加,膜的FS、PS 都出現下降的趨勢。然而,表3 的結果表明戊二醛對于提高蛋白膜的耐水性能明顯優于TGase。與本文結果類似,添加戊二醛可以使棉籽蛋白膜的溶解性降低65%以上[4],但添加TGase 只能使大豆分離蛋白膜的 FS 下降21.6%[5],這可能是戊二醛分子量小,容易與蛋白發生交聯反應的緣故[18,21]。
2.4 交聯度
為了明確戊二醛、TGase 的添加對蛋白交聯的影響,利用TNBS 的方法進行了測定,結果如圖1 所示。由圖1 可知,不管是戊二醛還是TGase 改良的蛋白膜,蛋白交聯度隨著交聯劑的添加都呈逐漸上升的趨勢,但添加效果明顯不同。添加蛋白質量0.2%的戊二醛時蛋白交聯度就達到21%,而TGase 添加量增加到蛋白質量的2.0%時其蛋白交聯度也只有17%左右,表明了戊二醛比TGase 更容易促進蛋白之間發生交聯反應,結果導致戊二醛添加的魚糜-明膠復合膜的耐水性能明顯優越(表3)。

表3 添加戊二醛/TGase 對魚糜-明膠復合膜的固形物溶解率(FS)和蛋白溶解率(PS)的影響Table 3 Effect of glutaraldehyde/TGase content on film solubility(FS)and protein solubility(PS)of surimi-gelatin composite films
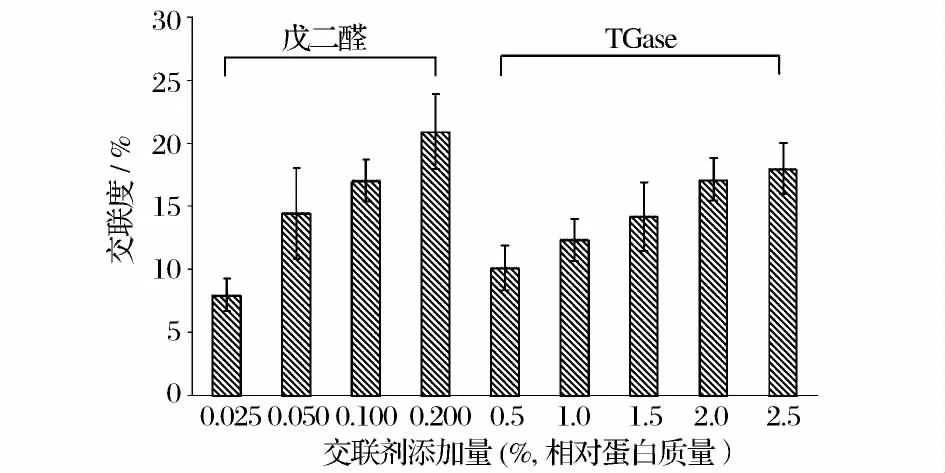
圖1 添加戊二醛/TGase 對魚糜-明膠復合膜中蛋白交聯度的影響Fig.1 Effect of glutaraldehyde/TGase content on crosslinking degree of surimi-gelatin composite films
2.5 SDS-PAGE
SDS-PAGE 分析結果表明,魚糜-明膠復合膜中的主要蛋白成分為肌球蛋白重鏈(MHC)、肌動蛋白(Actin)、β 肽鏈和α 肽鏈(圖2)。伴隨著戊二醛的添加,MHC、β 肽鏈的條帶濃度減少,同時濃縮膠頂部的高分子組分(HMWF)的條帶濃度逐漸增加,其他蛋白條帶沒有發現明顯的變化,表明戊二醛的添加主要促進魚糜蛋白中的MHC、明膠蛋白β 肽鏈之間發生交聯形成HMWF。據報道,MHC 和明膠蛋白在TGase 的作用下也會發生類似的交聯反應[10,22]。然而,在本研究中TGase 誘導產生的HMWF 含量明顯低于戊二醛,進一步驗證了戊二醛更容易促進魚糜-明膠復合膜中蛋白交聯反應的發生。
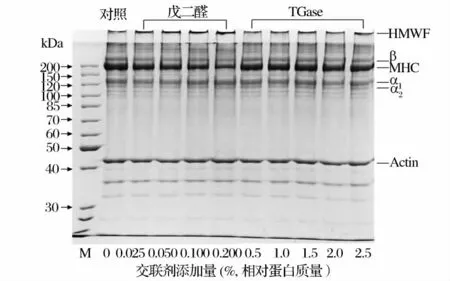
圖2 魚糜-明膠復合膜的SDS-PAGEFig.2 SDS-PAGE of surimi-gelatin composite films
2.6 FTIR
為進一步了解戊二醛、TGase 的添加對魚糜-明膠膜中蛋白之間相互作用的影響,利用FTIR 進行了分析(圖3)。伴隨著蛋白膜中戊二醛含量的增加,代表NH 和OH 伸縮振動的酰胺A 先向高波數方向移動,當戊二醛與蛋白的比例超過0.05%時,該特征峰開始向低波數移動。而隨著TGase 含量的增加,酰胺A 逐漸向高波數方向移動,當含量增加至蛋白質量的2.5%時,與對照組相比移動了48.4 cm-1。據報道,蛋白膜的酰胺A 特征吸收峰向高波數方向移動表示膜中的氫鍵作用相對減弱[23]。因此,圖3 的結果表明了少量的戊二醛可以使膜中蛋白分子間/分子內的氫鍵作用相對減弱,但過量的戊二醛可能在促進蛋白交聯的同時也破壞了蛋白的三維結構,導致親水性自由基增多[24],氫鍵作用相對增強(圖3)。從圖3 還可以看出,戊二醛的添加使酰胺Ⅰ(C = O 伸縮振動)、酰胺Ⅱ(NH 變形振動或CN 伸縮振動)向高波數方向發生輕微移動,而TGase 對這2 個特征吸收峰沒有產生明顯的影響,表明戊二醛的添加使膜中蛋白的二級結構發生變化[25],而且戊二醛還可能與蛋白中的氨基發生交聯形成新的C-N 鍵。
3 結論
戊二醛和TGase 的添加對魚糜-明膠復合膜性能的影響效果明顯不同。戊二醛的添加不能提高膜的機械強度,也不會改變膜的透明性,但可以大幅度增加膜的耐水性能,使膜的顏色變黃。然而,添加TGase 不僅可以改良膜的機械性能、耐水性能和透明性,而且不會影響膜的色澤。根據SDS-PAGE 和FTIR 的結果,發現戊二醛和TGase 都可以使成膜的蛋白分子之間發生交聯形成高分子聚合物,但戊二醛還可能使蛋白的二級結構發生變化,導致蛋白成膜性能下降。因此,本研究的結果表明TGase 更適合用于改良魚糜-明膠復合膜的理化性能。

圖3 添加戊二醛/TGase 的魚糜-明膠復合膜的紅外光譜圖Fig.3 FTIR spectra of surimi-gelatin composite films
[1] 中華人民共和國農業部漁業局. 中國漁業年鑒[M].北京:中國農業出版社,2011.
[2] Artharn A,Benjakul S,Prodpran T,et al. Properties of a protein-based film from round scad (Decapterus maruadsi)as affected by muscle types and washing[J]. Food Chemistry,2007,103(3):867 -874.
[3] Chiou B S,Avena-Bustillos R J,Bechtel P J,et al. Cold water fish gelatin films:effects of cross-linking on thermal,mechanical,barrier,and biodegradation properties [J].European Polymer Journal,2008,44 (11):3 748 -3 753.
[4] Marquié C,Aymard C,Cuq J L,et al. Biodegradable packaging made from cottonseed flour:formation and improvement by chemical treatments with gossypol,formaldehyde,and glutaraldehyde[J]. Journal of Agricultural and Food Chemistry,1995,43(10):2 762 -2 767.
[5] Tang C H,Jiang Y,Wen Q B,et al. Effect of transglutaminase treatment on the properties of cast films of soy protein isolates[J]. Journal of Biotechnology,2005,120(3):296 -307.
[6] Bigi A,Cojazzi G,Panzavolta S,et al. Mechanical and thermal properties of gelatin films at different degrees of glutaraldehyde crosslinking [J]. Biomaterials,2001,22(8):763 -768.
[7] Ustunol Z,Mert B. Water solubility,mechanical,barrier,and thermal properties of cross-linked whey protein isolatebased films[J]. Journal of Food Science,2004,69(3):129 -133.
[8] Wang Y,Mo X,Sun X S,et al. Soy protein adhesion enhanced by glutaraldehyde crosslink[J]. Journal of Applied Polymer Science,2007,104(1):130 -136.
[9] Jiang Y,Tang C H,Wen Q B,et al. Effect of processing parameters on the properties of transglutaminase-treated soy protein isolate films[J]. Innovative Food Science and Emerging Technologies,2007,8(2):218 -225.
[10] Yi J B,Kim Y T,Bae H J,et al. Influence of transglutaminase-induced cross-linking on properties of fish gelatin films[J]. Journal of Food Science,2006,71(9):376-383.
[11] 翁武銀,劉光明,蘇文金,等. 魚皮明膠蛋白膜的制備及其熱穩定性[J]. 水產學報,2011,35(12):1 890 -1 896.
[12] Lowry O H,Rosebrough N J,Farr A L,et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1):265 -275.
[13] Bubnis W A,Ofner Iii C M. The determination of ε-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometrie method using trinitrobenzenesulfonic acid[J]. Analytical Biochemistry,1992,207(1):129 -133.
[14] Tang D W,Yu S H,Ho Y C,et al. Characterization of tea catechins-loaded nanoparticles prepared from chitosan and an edible polypeptide [J]. Food Hydrocolloids,2013,30(1):33 -41.
[15] Steel R G D,Torrie J H. Principles and procedures of statistics:a biometrical approach [M]. New York:McGraw-Hill,1980.
[16] Kuraishi C,Yamazaki K,Susa Y. Transglutaminase:its utilization in the food industry[J]. Food Reviews International,2001,17(2):221 -246.
[17] Larré C,Desserme C,Barbot J,et al. Properties of deamidated gluten films enzymatically cross-linked[J].Journal of Agricultural and Food Chemistry,2000,48(11):5 444 -5 449.
[18] Migneault I,Dartiguenave C,Bertrand M J,et al. Glutaraldehyde:behavior in aqueous solution,reaction with proteins,and application to enzyme crosslinking [J].Biotechniques,2004,37(5):790 -802.
[19] 王翀,張春紅,趙前程,等. 谷氨酰胺轉氨酶改性可食性復合膜的研究[J]. 糧食與飼料工業,2009(5):23 -25.
[20] Rhim J W,Gennadios A,Handa A,et al. Solubility,tensile,and color properties of modified soy protein isolate films[J]. Journal of Agricultural and Food Chemistry,2000,48(10):4 937 -4 941.
[21] Jayakrishnan A,Jameela S R. Glutaraldehyde as a fixative in bioprostheses and drug delivery matrices[J]. Biomaterials,1996,17(5):471 -484.
[22] Chanarat S,Benjakul S,H-Kittikun A.Comparative study on protein cross-linking and gel enhancing effect of microbial transglutaminase on surimi from different fish [J].Journal of the Science of Food and Agriculture,2012,92(4):844 -852.
[23] Hoque M S,Benjakul S,Prodpran T. Effect of heat treatment of film-forming solution on the properties of film from cuttlefish (Sepia pharaonis)skin gelatin[J]. Journal of Food Engineering,2010,96(1):66 -73.
[24] Chen Xin,Li Wen-jun,Shao Zheng-zhong,et al. Separation of alcohol-water mixture by pervaporation through a novel natural polymer blend membrane-chitosan/silk fibroin blend membrane[J]. Journal of Applied Polymer Science,1999,73:975 -980.
[25] Farris S,Song J H,Huang Q R. Alternative reaction mechanism for the cross-linking of gelatin with glutaraldehyde[J]. Journal of Agricultural and Food Chemistry,2010,58(2):998 -1003.

