游動放線菌原生質體誘變選育阿卡波糖高產菌株*
王遠山,牛鑫淼,鄭裕國
1(浙江工業大學生物與環境工程學院,浙江 杭州,310014)
2(浙江工業大學生物工程研究所,浙江 杭州,310014)
阿卡波糖(acarbose)是一種低聚糖,由環己烯醇氨(valienamine),4-氨基-4,6-雙脫氧葡萄糖和麥芽糖組成[1]。它還是一種α-葡萄糖苷酶抑制劑,能夠有效抑制腸道內的某些消化酶,降低餐后的血糖水平,主要用于治療Ⅱ型糖尿病,具有毒副作用小、作用溫和持久等優點[2]。阿卡波糖最早由游動放線菌Actinoplanes sp. SE50、SE82 和SE18 的代謝產物中分離出來,并于1990 年由德國Bayer 公司生產上市,目前已經得到了廣泛的應用。
目前,阿卡波糖的工業規模生產均通過游動放線菌發酵獲得[3],菌株的生產能力很關鍵,因此很多研究工作都集中于菌株的選育和發酵優化。程新等[4-5]從土壤中篩選到1 株游動放線菌Actinoplanes sp. A56,經過培養基優化后阿卡波糖產量達到了1 043 mg/L。朱皖宜等[6]利用紫外和培養基中添加麥芽糖的誘變模式,獲得了較出發菌株提高74%的突變株。張琴等[7]采用紫外、亞硝基胍、硫酸二乙酯和亞硝酸多次誘變,篩選到的突變株發酵水平提高了35%。Wang 等[8-9]通過對發酵培養條件的優化使得阿卡波糖的產量達到4 210 mg/L,而且在發酵不同時間補加葡萄糖、麥芽糖和黃豆餅粉混合物,阿卡波糖的產量提高到了4 878 mg/L。隨著原生質體技術的發展,原生質體誘變技術被廣泛應用于菌株的育種。由于原生質體沒有細胞壁,對各種物理化學誘變較敏感,而又具有細胞的全能性及再生能力,所以是理想的誘變材料[10]。除了原生質體誘變外,以原生質體融合為基礎的基因組重排技術也得到了廣泛的應用,但是利用原生質體技術選育阿卡波糖高產菌株的報道相對較少。馬妮[11]通過原生質體紫外、NTG誘變結合甲胺、麥芽糖耐受模型篩選得到1 株產量達3 700 mg/L 的突變株。鄭斐[12]利用基因組重排技術得到的阿卡波糖高產融合子產量達到3 714 mg/L。
本實驗對Actinoplanes utahensisZJB-08196 原生質體制備再生條件進行了研究,再對其原生質體進行了紫外誘變,取得了良好的效果。此外,原生質體制備再生也是基因組重排技術中非常關鍵的環節,本實驗的研究內容也為進一步通過基因組重排技術選育阿卡波糖高產菌株奠定了基礎。
1 材料與方法
1.1 材料
1.1.1 菌種
猶他游動放線菌(Actinoplanes utahensis)ZJB-08196,浙江工業大學生物工程研究所保藏。
1.1.2 培養基
固體培養基CPC(g/L):蔗糖30,蛋白胨2,酪氨酸1,K2HPO41,KCl 0.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.1,瓊脂20,pH 自然。
菌絲培養基(g/L):葡萄糖10,酵母粉3,蛋白胨30,黃豆餅粉5,淀粉0.5,MgSO42,K2HPO40.5,pH 7.0。
再生培養基:R2YE 培養基[13]。
種子培養基(g/L):玉米淀粉16,黃豆餅粉40,甘油20,CaCO32,K2HPO40.5,pH 自然。
發酵培養基(g/L):麥芽糖漿271.4 mL,葡萄糖40,黃豆餅粉17,谷氨酸鈉5,FeCI30.5,CaCO32.5,CaCl21.88,K2HPO41,甘油5,pH 6.5 ~7.0。
1.2.3 試劑
P 緩沖液:見參考文獻[13];溶菌酶,購自Sigma 公司;牛血清白蛋白(BSA),購自上海聚源生物科技有限公司;L-脯氨酸,購自上海青析化工科技有限公司;聚乙烯吡咯烷酮K-30(PVP),購自汕頭市隴西化工廠;麥芽糖漿,由杭州中美華東制藥有限公司提供;乙腈,為色譜純;其他試劑均為國產分析純試劑。
1.1.4 儀器
SBA 40 E 生物傳感器(山東微生物研究所);Osmometer Modal 3205 全自動冰點滲透壓儀(Advanced);LC-10AT 型高效液相色譜儀及SPD-10A 檢測器(Shimadzu)。
1.2 方法
1.2.1 菌絲培養及收集
從茄形瓶固體培養基上挑取1 cm2大小的菌落接種到菌絲培養基中,28 ℃培養56 h 后,取6 mL 轉接到含甘氨酸的菌絲培養基(30 mL/250 mL 三角瓶)中進行二級培養。將二級培養液3 500 r/min 離心10 min 收集菌體,菌體首先用無菌水洗滌1 次,再用P緩沖液洗滌2 次,待用。
1.2.2 原生質體制備及再生
先將收集到的菌絲稱重,根據菌絲體濕重加入適量的溶菌酶溶液,混合均勻。35 ℃恒溫水浴,搖床轉速120 r/min,每隔30 min 吸取酶解液并用相差顯微鏡觀察原生質體釋放情況。酶解結束后,用脫脂棉純化原生質體,3 500 r/min 離心10 min 收集原生質體,最后用P 緩沖液洗滌2 次。
將制備好的原生質體懸液,用P 緩沖液稀釋適當倍數,輕輕涂布于固體再生培養基上,28 ℃恒溫培養5d,菌落計數,計算原生質體形成率和再生率。
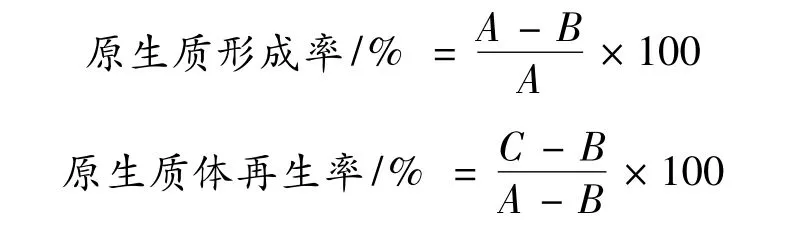
式中,A:總菌落數,酶處理之前的菌懸液涂布于CPC 平板生長的菌落。
B:未原生質體化菌落,酶解結束后,酶解混合液用蒸餾水稀釋,涂布CPC 平板生長的菌落。
C:再生菌落,純化后的原生質體經P 緩沖液稀釋,涂布于再生培養基平板生長的菌落。
1.2.3 原生質體顯微鏡計數方法
用規格為25 cm×16 cm 的血細胞計數板在相差顯微鏡下直接計數。
1.2.4 干重和濕重測量方法
準確取10 mL 培養液于離心管,3 500 r/min 離心10 min,棄掉上清液,于90 ℃烘箱中烘干至恒重,稱量干重,每樣做3 個平行,取均值。
準確取10 mL 培養液于離心管,3 500 r/min 離心10 min,棄掉上清液,稱量濕重,每樣做3 個平行,取均值。
1.2.5 原生質體紫外誘變
將原生質體懸液的濃度調整為106個/mL,取5 mL 懸液于直徑6 cm 的平板中,放置于2 根8 W 的紫外燈管下30 cm 處進行誘變。分別照射40、60、80、100、120 s,黑暗放置2 h 后,涂布再生培養基于28 ℃恒溫再生。
致死率計算。根據各誘變組再生菌落數(M)和對照組再生菌落數(N),計算不同誘變時間處理后的致死率:
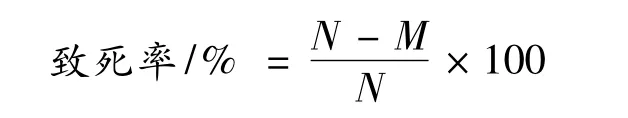
1.2.6 高產突變株篩選
再生菌落先轉接于茄形瓶,再從茄形瓶中挑取1 cm2大小的菌落接種于100 mL 種子培養基中28 ℃,200 r/min 振蕩培養72 h,以10%轉接量轉接于50 mL 發酵培養基中,于28 ℃,200 r/min 振蕩培養7 d,取樣測定阿卡波糖含量。
1.2.7 檢測方法
發酵液滲透壓測定:發酵液12 000 r/min 離心10 min,取上清液250 μL 測定滲透壓。
葡萄糖測定:生物傳感器檢測[8]。
阿卡波糖檢測:HPLC 檢測[14]。色譜柱Luna NH2(4.6 mm×250 mm,5 μm);流動相:乙腈-磷酸鹽緩沖液(75 ∶25);檢測波長210 nm,流速1.0 mL/min,柱溫40 ℃。
2 結果與分析
2.1 甘氨酸對菌絲生長和原生質體形成的影響
在放線菌的菌絲培養過程中添加甘氨酸,可以增加溶菌酶對菌絲細胞壁的敏感性。因為甘氨酸在放線菌細胞壁合成過程中,甘氨酸可以代替結構相似的丙氨酸從而干擾細胞壁的正常合成,有助于溶菌酶瓦解細胞壁。而甘氨酸的加入時間各異,有的放線菌需要剛開始培養時就加入[15],有的放線菌則在對數期再加入,然后繼續培養一定時間,才能達到理想的酶解效果。圖1 是菌絲培養初始就加入不同濃度的甘氨酸對菌株生長曲線的影響,并以不加甘氨酸為對照。從圖中可以看出,甘氨酸對ZJB-08196 的抑制非常明顯,當甘氨酸的濃度為3 g/L 時,菌株生長已經受到強烈的抑制,而濃度增加到5 g/L 時,幾乎已經無法生長。從對照組的生長趨勢可以看出,菌體生長過程中適應期較長,如果初始就加入甘氨酸,則菌體在適應期就會受到抑制,從而顯著地影響后續生長,不能獲得原生質體制備所需足量的菌體。所以,本實驗選擇二級培養的方式進行菌體培養,即菌體一級培養56 h 左右到達對數生長后期,再以20%(v/v)的接種量轉接到含甘氨酸的新鮮菌絲培養基中進行二級培養。
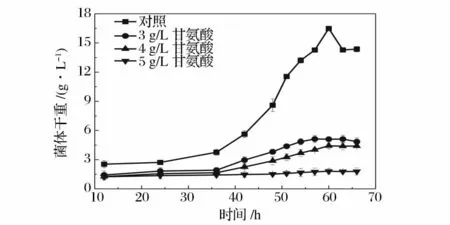
圖1 不同濃度甘氨酸濃度下ZJB-08196的一級生長曲線Fig.1 Growth curves of ZJB-08196 in first stage of different glycine concentration
放線菌通常以甘氨酸和溶菌酶配合使用來制備原生質體,但是不同的品系所需的甘氨酸濃度差別較大,濃度從1 g/L 到15 g/L 都有報道[16]。表1 顯示的是二級培養時不同濃度的甘氨酸對菌體生長和原生質體釋放的影響。為了便于直接比較,酶解時菌體(濕菌體)質量濃度都調整為0.1 g/mL。從表中可知,當甘氨酸濃度為4 g/L 時,酶解得到的原生質體數最大達到2.88 ×107個/mL。
2.2 菌齡對原生質體形成和再生的影響
不同生長階段的菌體對溶菌酶的敏感性是不同的,而且由于生理活性的差異也會導致再生效果的不同。一般原生質體的制備選擇處于對數生長中后期的菌體,這是由于此階段的菌體細胞壁中的肽聚糖含量較低,對溶菌酶的作用最敏感,而且原生質體修復能力也較強,再生效果好。而對數生長早期的菌體相對脆弱,酶的過度作用會影響原生質體的再生[17]。圖2 是菌體在含4 g/L 甘氨酸菌絲培養基中的二級生長曲線,從圖中可以看出,菌體在24 h 時進入穩定期。圖3 是菌絲二級培養時間對原生質體形成和再生的影響,可以看出,原生質體的形成率隨菌齡的增加緩慢增加,在20 h 處達到最大,隨后下降。再生率趨勢與形成率基本一致,但是在22 h 達到最大值。綜合考慮形成率與再生率,菌體的最佳菌齡為22 h。而22 h 是菌體生長的對數后期,這表明處于對數生長后期的菌體最適合制備原生質體。已有過文獻報道,處于對數后期或穩定期的放線菌菌體制備的原生質體有較高的再生能力[18]。
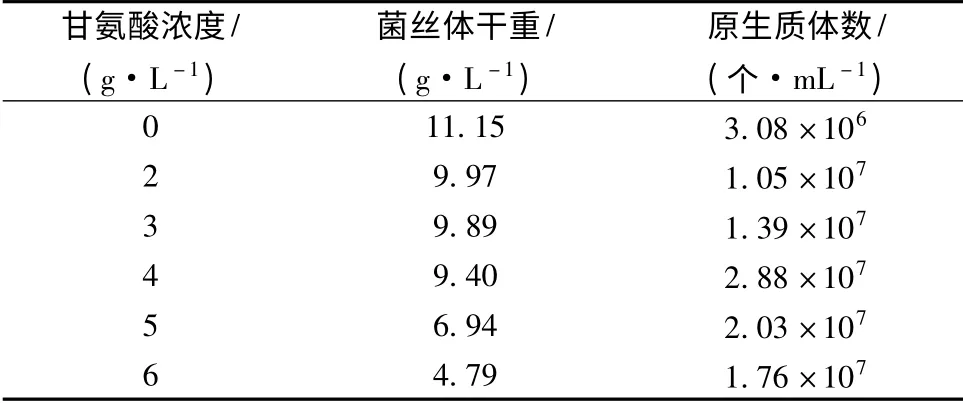
表1 不同濃度甘氨酸對菌絲生長和原生質體形成的影響Table 1 The effect of glycine concentration on mycelial growth and protoplast formation
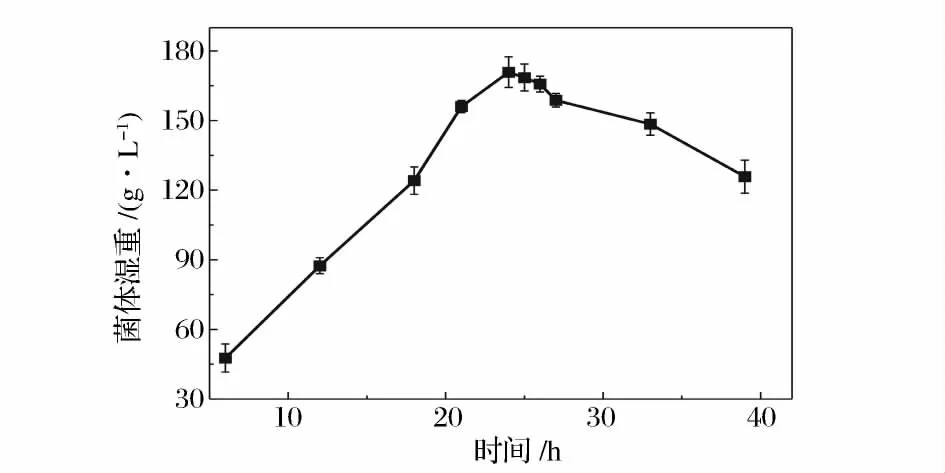
圖2 ZJB-08196 的二級生長曲線Fig.2 Growth curves of ZJB-08196 in second stage
2.3 酶濃度、酶解時間、酶解溫度和菌體(濕菌體)質量濃度對原生質體的形成和再生的影響
細菌和放線菌細胞壁的主要成分是肽聚糖,可以用溶菌酶來水解細胞壁。由于不同菌種品系的細胞壁各組分比例以及生理狀態的差異,還有酶自身的純度及性質的不同,所以要求的酶濃度以及酶解時間不盡相同。用于水解細胞壁的酶濃度過低,水解緩慢,不利于原生質體的形成,而濃度過高,處理時間過長,菌體表面的細胞壁水解太徹底,又會影響原生質體的活性,致使再生率下降。從圖4 -A 酶濃度對原生質體形成和再生影響可以看出,隨著酶濃度的增加,原生質體的形成率逐漸增加,再生率則在10 mg/mL 達到最大值,綜合考慮形成率和再生率,最佳的酶濃度為10 mg/mL。酶解溫度要兼顧酶的活力和對原生質體活性的影響。文獻報道放線菌的最適酶解溫度一般在30 ℃到37 ℃之間[19]。從圖4 -B 可以看出,原生質體的形成率和制備率同時在35 ℃時達到最大,所以酶解的最適溫度為35 ℃。從圖4 -C 的酶解時長對原生質體形成和再生影響可以看出,雖然酶解時間越長形成率越高,但是超過4 h 后,原生質體的再生率顯著下降,所以最終選擇4 h 為酶解時長。
在確定的酶濃度、酶解時間及酶解溫度條件下,酶解液中菌體的質量濃度也會影響原生質體的形成和再生,所以酶解時混合液中的菌絲體量要加以控制。如圖4 -D 所示,菌體濃度小于0.2 g/mL 時,原生質體的形成率下降幅度并不顯著,而再生率則逐漸增大,在0.2 g/mL 左右時達到最大,所以最佳的菌體質量濃度為0.2 g/mL 左右。
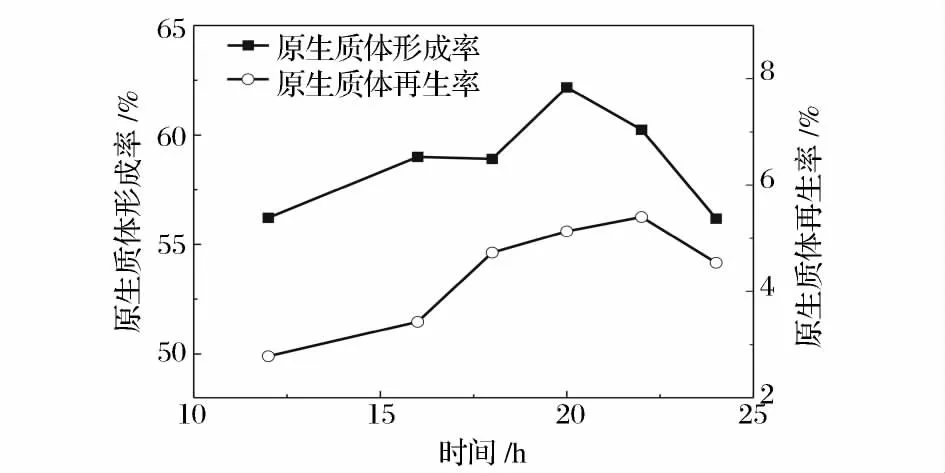
圖3 菌齡對原生質體形成和再生的影響Fig.3 The effect of mycelium age on protoplast formation and regeneration
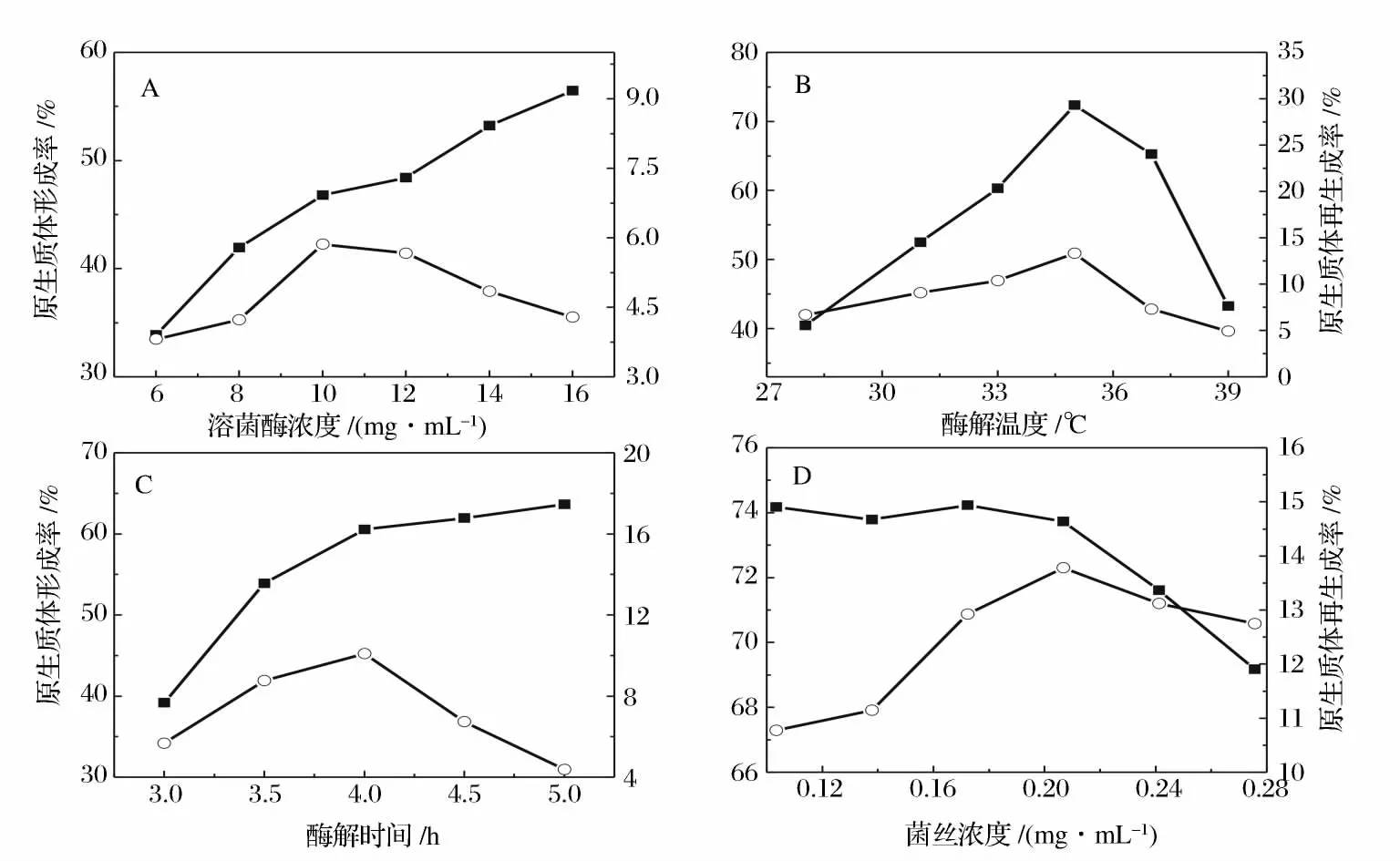
圖4 溶菌酶濃度、酶解溫度、酶解時間和菌體濃度對原生質體形成和再生的影響。Fig. 4 The effect of lysozyme concentration,enzymolysis time,enzymolysis temperature and mycelial concentration on protoplast formation and regeneration
2.4 原生質體再生培養基的優化
2.4.1L-脯氨酸對再生的影響
L-脯氨酸是再生培養基中非常重要的組成成分,可以用來合成細胞壁中肽聚糖,促進原生質體的再生。從表2 中可知,當L-脯氨酸的濃度達到4 g/L時,再生率最高達到10.6%,繼續增加L-脯氨酸的濃度,再生率反而下降,因此最佳的L-脯氨酸濃度為4 g/L。

表2 再生培養基中L 脯氨酸濃度對原生質體再生的影響Table 2 The effect of L-proline concentration of regeneration medium on protoplast regeneration
2.4.2 BSA 和PVP 對再生的影響
BSA 一方面對原生質體起保護作用,可以保持原生質體結構和功能的完整性[20]。另一方面,BSA 也是一種營養物質,可以通過代謝轉化為細胞壁合成的前體物質,加速細胞壁的再生。如表3 所示,在再生培養基中添加BSA 可有效提高再生率,當BSA 濃度達到0.3 g/L 時,再生率最高達到15.41%。
PVP 也是一種原生質體的保護劑,可以給原生質體提供穩定的代謝環境,促進原生質體的再生。如表3 所示,再生培養基中加入PVP 也可以提高原生質體的再生率,當濃度達到0.2 g/L 時,再生率最高為15.14%。從結果來看,添加BSA 后的最大再生率要稍高于PVP,但是BSA 價格較PVP 要高,結合經濟性來考慮,PVP 是BSA 的良好替代品。
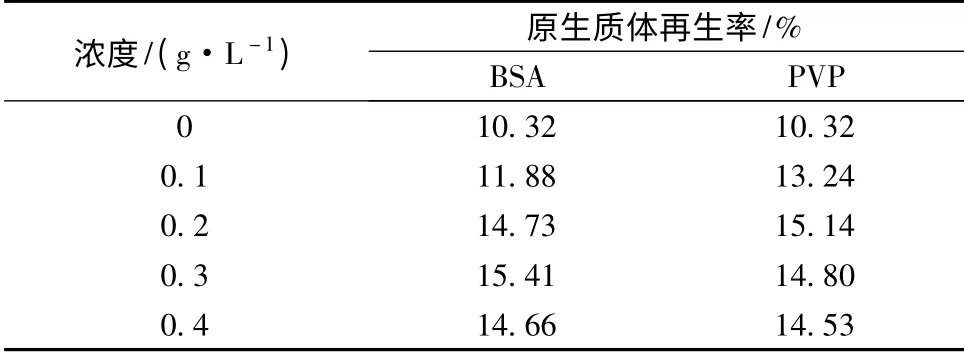
表3 再生培養基中BSA 和PVP 對原生質體再生影響Table 3 The effect of BSA and PVP of regeneration medium on protoplast regeneration
2.5 原生質體紫外誘變突變株篩選
原生質體紫外誘變致死曲線如圖5 所示,原生質體的致死率隨時間的延長迅速增加,當紫外照射時間為60 s 時,致死率為74.9%,當時間達到100 s 時,致死率已經達到95.5%,照射120 s 后原生質體的致死率達到100%。原生質體的致死率在40 s 到60 s 時段內變化幅度較大,這表明在此階段紫外照射的影響最大。
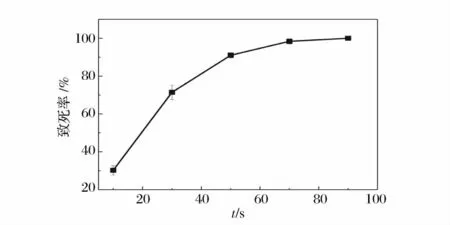
圖5 不同紫外誘變時間原生質體致死率Fig.5 The lethality rate of protoplasts treated for different mutation time
從再生平板中挑取55 株誘變株,進行發酵培養。挑選出了7 株阿卡波糖產量提高10%的突變株,選擇其中2 株產量超過5 000 mg/L 的菌株進行傳代培養驗證其遺傳穩定性。經過5 代連續培養后,得到了1 株阿卡波糖產量穩定的菌株UN-52,其阿卡波糖產量達到5 165.2 mg/L。出發菌株ZJB-08196 產量為4 518.7 mg/L,UN-52 與出發菌株相比產量提高了約12%。UN-52 傳代穩定性結果如表4 所示。
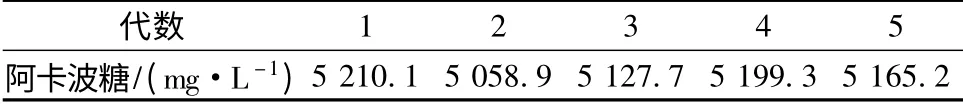
表4 傳代穩定性驗證結果Table 4 Verification of the mutation strain UN-52
2.6 誘變菌株和出發菌株的發酵特性比較
為了比較突變株UN-52 與出發菌株發酵特性,監測了2 株菌發酵過程中阿卡波糖、滲透壓、生物量和葡萄糖隨時間的變化,結果如圖6 所示。從圖中可以看出,隨著發酵時間的延長滲透壓和葡萄糖在逐漸降低,而阿卡波糖和生物量相應地逐漸增加。而2 株菌的發酵曲線對比可以看出,突變株UN-52 發酵過程中滲透壓和葡萄糖下降得更快,而其生物量與阿卡波糖產量的增長則快于出發菌株。這說明突變株UN-52 相較于出發菌株來說,其對發酵培養基中的葡萄糖等營養物質利用得更快,所以其長勢更加旺盛,阿卡波糖產量也更高。
3 討論
原生質體的制備和再生涉及到多種影響因素,要對各影響因素綜合考慮,才能獲得良好的制備與再生效果。甘氨酸對菌體的生長有明顯的抑制作用,先將菌體培養至生長旺盛的對數期,再轉接入含甘氨酸的培養基繼續培養則可以減輕抑制作用得到足夠的菌體。菌體的生理狀態對原生質體制備和再生有一定影響,二級培養22 h 時菌體處于生長旺盛的對數期,菌體中大部分為新生菌絲,這樣更加有利于溶菌酶的酶解。在酶解過程中控制菌體的濃度也是十分必要的,菌體濃度過大,酶解體系粘度較大會影響原生質體的釋放,菌體濃度過小,則細胞壁酶解過度難于再生。
已有大量文獻報道過,再生培養基中添加膠體物質,如明膠、聚乙烯吡咯烷酮、瓊脂糖、藻酸鈣等,可以有效提高原生質體的再生率[21]。一方面,這些膠體物質可以穩定原生質體的生長環境以促進再生。另一方面,膠體產生的膠體滲透壓可以防止環境中的水分滲透進入原生質體擾亂其生長[22]。本實驗結合操作方便性和經濟因素,最后選擇添加0.2 g/L PVP,原生質體的再生率達到15.14%。
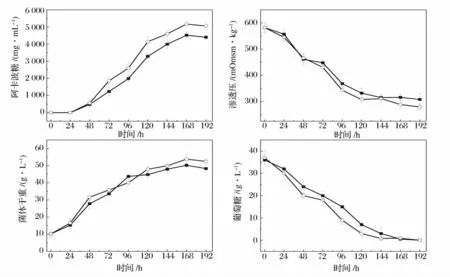
圖6 ZJB-08196 和NU-52 發酵過程中阿卡波糖、滲透壓、生物量和葡萄糖的變化Fig.6 The course of acarbose,osmolality,biomass and glucose by ZJB-08196 and UN-52
本實驗進一步將Actinoplanes utahensisZJB-08196原生質體通過紫外誘變的方法進行誘變育種,獲得了1 株比出發菌株提高了12%的突變株UN-52,產量達到了5 165.2 mg/L。突變株UN-52 產阿卡波糖的能力高于已報道的馬妮[11]等人通過育種得到的菌株。通過發酵過程的比較表明,突變株UN-52 對營養物質利用得更快,如果在發酵過程中補加營養物質應該能夠進一步提高產量,下一步工作主要是突變株發酵條件優化、補料策略的研究。
[1] Campbell L K,White J R,Campbell R K. Acarbose:Its role in the treatment of diabetes mellitus[J]. Annals of Pharmacotherapy,1996,30(11):1 255 -1 262.
[2] 何素婷,許激揚,陳代杰. 具有α-葡糖苷酶抑制作用的抗糖尿病藥物[J]. 工業微生物,2003,33(1):43 -49.
[3] Liu R L,Ding M P,Xu W,et al. Progress on glucosidase inhibitors[J]. Pharmaceutical Biotechnology,2009,16(4):388 -392.
[4] 程新,徐波,魏塞金,等. 一株產α-糖苷酶抑制劑的稀有放線菌分離與鑒定[J]. 食品與發酵工業,2008,34(9):58 -60.
[5] Wei S J,Cheng X,Huang L,et al. Medium optimization for acarbose production byActinoplanessp.A56 using the response surface methodology [J]. Africa Journal of Biotechnology,2010,9(13):1 949 -1 954.
[6] 朱皖宜,陶美珍,邢紅燕,等. 阿卡波糖產生菌的誘變育種[J]. 中國醫藥工業雜志,2005,36(1):17 -21.
[7] 張琴,胡海峰,朱寶泉. 阿卡波糖產生菌的選育和發酵工藝優化[J]. 中國醫藥工業雜志,2008,39(11):820-822.
[8] Wang Y J,Liu L L,Feng Z H,et al. Optimization of media composition and culture conditions for acarbose production byActinoplanes utahensiaZJB-08196[J]. World Journal of Microbiology and Biotechnology,2011,27(12):2 759 -2 766.
[9] Wang Y J,Liu L L,Wang Y S,et al. Actinoplanes utahensis ZJB-08196 fed-batch fermentation at elevated osmolality for enhancing acarbose production[J]. Bioresource Technology,2012,103(1):337 -342.
[10] 施巧琴,吳松剛. 工業微生物育種學(第三版)[M].北京:科學出版社,2009:222 -223.
[11] 馬妮. 阿卡波糖產生菌育種新方法的研究與應用[D]. 沈陽:沈陽藥科大學,2006.
[12] 鄭斐. 原生質體技術在阿卡波糖產生菌育種中的應用[D]. 沈陽:沈陽藥科大學,2008.
[13] Hopwood D A,Bibb M J,Chater K F,et al. Genetic Manipulation of Streptomyces,a laboratory manual[M].England:John Innes Foundation press,1985:365.
[14] Wang Y J,Xue Y P,Zheng Y G,et al. Analysis and determination of anti-diabetes drug acarbose and its structural analogs[J]. Current Pharmaceutical Analysis,2011,7(1):12 -20.
[15] Carneiro-da-Cunha M G,Filho J L L,Campos-Takaki G M. Protoplast formation and regeneration fromStreptomyces clavuligenrusNRRL 3585 and clavulanic acid production[J]. Brazilian Journal of Microbiology,2002,33(4):347 -351.
[16] Allison D G,Roberts P M. Protoplast formation and reversion inActinomadura[J]. Applied Microbiology and Biotechnology,1998,28(6):580 -582.
[17] 劉志恒,姜成林. 放線菌現代生物學與生物技術[M].北京:科學出版社,2004:128 -129.
[18] Lyutzkanova D,Nikolova B,Stoilova-Discheva M,et al.Protoplast formation and regeneration inStreptomyces flavopersicus[J]. Letters in Applied Microbiology,1993,16(4):217 -219.
[19] 陳飛,關艷麗,吳紅艷,等. 鏈霉菌11371 原生質體制備與再生[J]. 微生物學雜志,2011,31(5):54 -58.
[20] Illing G T,Normansell D,Peberdy J F. Protoplast isolation and regeneration inStreptomyces clavuligerus[J]. Journal of General Microbiology,1989,135(8):2 289.
[21] Miyamoto T,Nishioka K,Kataoka K,et al. Protoplast formation and regeneration in some lactic acid bacteria[J].Japanese Journal of Zootechnical Science,1990,61(6):481 -486.
[22] Osamu T,Sadahiro O. Efficient protoplast regeneration for some homofermentative lactobacilli and pediococci[J].Archives Microbiology,2001,177(1):36 -40.

