重組大腸桿菌產腈水解酶的培養條件優化*
金利群,吳叢偉,柳志強,鄭裕國,沈寅初
(浙江工業大學生物工程研究所,浙江 杭州,310014)
腈水解酶(Nitrilase,EC 3.5.5.1)是一種重要的腈轉化酶,能一步催化腈化合物合成相應的羧酸,因其反應條件溫和,污染少,且產物易于處理,被廣泛應用于精細化學品和原料藥的生產[1-3]。蛋氨酸又名甲硫氨酸,是必需氨基酸中唯一含硫的氨基酸,可被廣泛應用于醫藥、食品、化妝品和飼料等領域,尤其以飼料添加劑的用量最大[4]。蛋氨酸作為飼料中必不可少的一種添加劑,在短期內可以迅速提高瘦肉量縮短培養周期,使其節省40%左右的飼料;在化妝品領域,蛋氨酸用于體內甲基的轉移,可以有效延緩衰老。隨著全球人口的不斷增長和生活水平的提高,蛋氨酸的需求一直處于快速增長的態勢[5]。目前世界上主要的蛋氨酸生產公司多采用濃H2SO4且在高溫和高壓下水解2-氨基-4-甲硫基丁腈最終獲得蛋氨酸,反應條件劇烈、對設備腐蝕性大,同時產生大量的副產物、環境污染嚴重。
近年來,蛋氨酸的腈酶催化生產吸引了世界主要蛋氨酸生產公司的關注,相繼開發腈轉化酶催化工藝。如曹達公司和羅納-普朗克公司先后研究了腈水解酶催化制備蛋氨酸及其衍生物的工藝,但其腈水解酶活力低,僅為100 U/gDCW,蛋氨酸產量不高,難以實現大規模生產[6-8]。本課題組在腈轉化酶生物催化領域已作了多年的研究和探索,通過基因工程方法構建了重組大腸桿菌E. coli BL21 (DE3)/pET-28b-NIT,能有效的催化水解2-氨基-4-甲硫基丁腈合成蛋氨酸(圖1),但該重組菌培養過程菌體量較低,影響催化劑的有效制備。對于以生產外源蛋白為目的的重組菌發酵,希望在發酵過程中獲得盡可能多的目的蛋白,實現重組菌的高密度培養。分批補料培養是實現重組大腸桿菌高密度高表達培養的最常用和最有效的方法[9]。選擇合適的補料培養基和流加策略,可創造出既適合菌體生長又適合酶表達的培養環境條件,常常成為實現高密度培養和高表達的關鍵因素[10-12]。
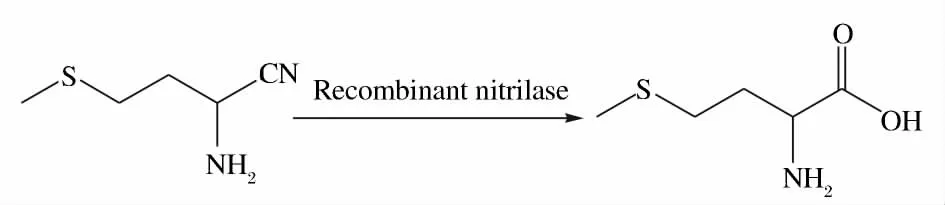
圖1 腈水解酶制備蛋氨酸工藝Fig.1 Synthesis of methionine by nitrilase
為此,本論文在前期培養基優化的基礎上,對重組菌E. coli BL21 (DE3)/pET-28b-NIT 在5 L 發酵罐上的補料分批培養工藝進行了研究,使該菌在保持酶活的同時能夠大量且快速生長,為蛋氨酸的生物催化法工業化生產奠定基礎。
1 材料和方法
1.1 實驗菌種
重組大腸桿菌E. coli BL21 (DE3)/pET-28b-NIT,目的基因源于 Acidovorax facilis (GenBank:444267),由本實驗室構建。
1.2 實驗裝置
采用RALF plus 5 L 發酵罐,瑞士Bioengineering公司。
1.3 培養基
1.3.1 種子培養基( g/L)
蛋白胨10,酵母粉5,NaCl 5,pH 7.0。
1.3.2 初始發酵培養基( g/L)
蛋白胨12,酵母粉8,NaCl 8,pH 7.0。
1.3.3 碳源補料培養基
葡萄糖60 g/L,配置成一定體積的溶液,每次補加50 mL。
1.3.4 氮源補料培養基
補料I 含蛋白胨12 g,酵母粉8 g,定容至200 mL(分4 次補加,每次50 mL);補料II 含蛋白胨24 g,酵母粉16 g,定容至200 mL(分4 次補加,每次50 mL)。
1.4 實驗方法
1.4.1 種子制備
從活化斜面接種1 環菌體至種子培養基中,每100 mL 培養基加入100 μL 的Kanamycin(0.05 g/mL)。在37 ℃,150 r/min 的搖床上培養12 h。
1.4.2 5 L 發酵罐初始培養條件
按3%的接種量將種子液接入裝有2.5 L 基礎發酵培養基的5 L 發酵罐中,培養溫度37 ℃,攪拌速率400 r/min,通氣量1.5 L/min,測定發酵液中的溶氧(%);培養過程中取樣檢測發酵液OD 值,當OD600=0.6 ~0.8 之間時加入誘導劑IPTG(終濃度0.2 mmol/L),此時調節培養溫度至28 ℃。
1.5 分析方法
菌體濃度測定:取適量發酵液,經稀釋后,使用紫外可見分光光度計在波長600 nm 下測定光密度。
菌體干重測定:量取25 mL 發酵液,12 000 r/min離心10 min,菌體用生理鹽水清洗后再次離心,離心后菌體置于90 ~100 ℃烘箱中烘干至恒重,使用分析天平稱重計算菌體干重,菌體干重與吸光值之間的關系為:干重(gDCW/L)=0.327 ×吸光值(Abs)。
殘糖測定:采用SBA40E 型生物傳感器分析儀進行測定。
轉化實驗:取1 mL 發酵液,12 000 r/min 離心10 min,去上清液,加入1 mL 150 mmol/L 2-氨基-4-甲硫基丁腈(緩沖體系Tris-HCl,pH 8.0)溶液。使用渦旋振蕩器使菌體重懸,將其置于恒溫混勻器中進行轉化反應,溫度40 ℃,轉速600 r/min。反應10 min 后加入10 μL 質量濃度36%的濃HCl 終止反應,離心取上清液進行HPLC 檢測分析[6-8]。
HPLC 檢測方法:日本島津液相色譜儀;大連伊力特色譜柱:不銹鋼填充柱,填料為C18(250 mm ×4.6 mm);流動相:V(甲醇)∶V(水)=25∶75;流速1 mL/min,柱溫40 ℃,進樣量20 μL,紫外檢測波長210 nm。
酶活定義:每分鐘催化生成1 μmol 蛋氨酸所需要的菌體量記為1 個活力單位U;每克干菌體所含有的酶活數定義為U/gDCW;每升發酵液所含有的酶活數定義為U/L。
2 結果與討論
2.1 發酵過程pH 控制對菌體生長和產酶的影響
發酵液的pH 值是發酵過程中的重要參數,pH值的變化影響菌體的生長和目標產物的合成。一般而言,重組大腸桿菌生長的最適pH 為7.0 ~7.2,實驗中研究了未控制pH 和控制pH 恒定對菌體生長和產酶的影響。
從圖2 可以看出,當未控制pH 進行分批發酵時,最大菌體量為2.57 gDCW/L,比酶活為2 141 U/gDCW;當pH 恒定在7.0 左右進行分批發酵時,重組菌對數生長期有所延長,最大菌體量為3.09 gDCW/L,比酶活為2 241 U/gDCW,分別比未控制pH 進行分批發酵提高了20.23%和4.67%。由此可見,發酵時維持pH 恒定在7.0 左右,對菌體的生長和酶活都有很好的促進作用,所以在后續實驗中我們均控制pH 恒定在7.0。
2.2 初始葡萄糖濃度及葡萄糖補加策略對菌體生長和產酶的影響
碳源及其濃度是影響大腸桿菌發酵的關鍵因素。本實驗中選用葡萄糖作為初始碳源,但葡萄糖的添加量過大,菌體生長過于迅速,會產生“葡萄糖效應”,產生乙酸等代謝副產物,既抑制了菌體生長又不利于蛋白的表達[13],因此使用葡萄糖作為碳源時需要嚴格控制葡萄糖的濃度。選取葡萄糖的初始濃度為2 g/L、5 g/L、10 g/L 和15 g/L,發酵培養14 h,檢測發酵過程中葡萄糖的消耗(圖3)及其對菌體生長和酶活的影響(圖4)。
結合圖3 和4 可以看出,當初始葡萄糖濃度為2 g/L 時,發酵6 h 后,葡萄糖已經耗盡,不能滿足生長和產酶的需要;濃度過高(15 g/L),葡萄糖消耗過快,產生了“葡萄糖效應”,對菌體的生長和酶活都有抑制作用。綜合考慮葡萄糖的消耗、菌體的生長以及酶活的高低情況,選擇葡萄糖初始濃度5 g/L 較適宜,此時菌體濃度為5.32 gDCW/L,比酶活達2 200 U/gDCW。
當初始葡萄糖濃度為5 g/L 時,分別選取糖濃度下降為2 g/L(圖5(a))和3 g/L(圖5(b))時進行反饋補料,每次補加50 mL 碳源補料培養基,比較兩種不同補料策略對菌體生長和產酶的影響。
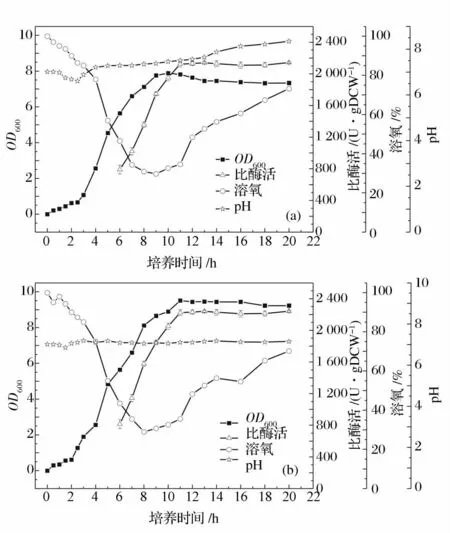
圖2 pH 控制對菌體生長和酶活的影響(a)未控制pH;(b)控制pH 恒定Fig.2 Effects of pH on strain growth and enzyme activity(a)natural pH;(b)constant pH
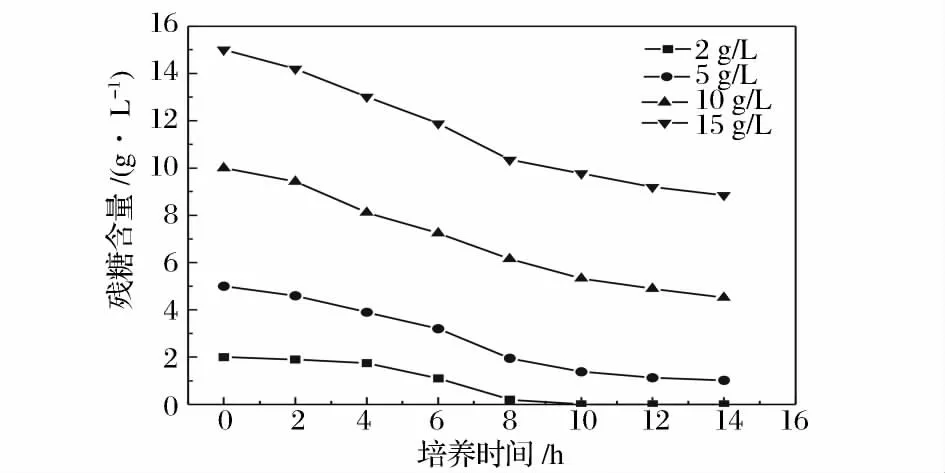
圖3 不同初始葡萄糖濃度下葡萄糖的消耗情況Fig.3 The glucose consumption under the different initial concentration of glucose
由圖5 可知,發酵14 h 后,葡萄糖濃度基本維持在2 ~3 g/L,不再消耗,此時停止補料。結果表明,葡萄糖濃度降為2 g/L 時進行反饋補料,最大菌體量為7.83 gDCW/L,比酶活達2 215 U/gDCW(圖5(a));而葡萄糖濃度降為3 g/L 時進行反饋補料,最大菌體量為7.07 gDCW/L,比酶活達2 199 U/gDCW(圖5(b)),且補料過于頻繁,會增加發酵過程染菌率,影響葡萄糖利用率,碳氮比例增大,菌體生長緩慢,代謝不平衡,因此選擇葡萄糖下降為2 g/L 時開始補料。
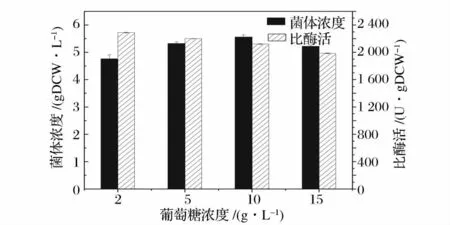
圖4 初始葡萄糖濃度對菌體生長和酶活的影響Fig.4 Effects of initial concentration of glucose on strain growth and enzyme activity
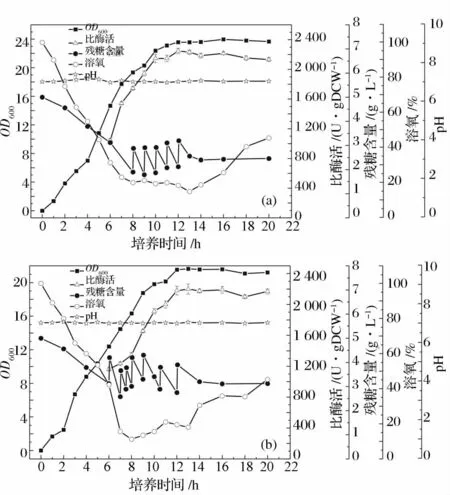
圖5 葡萄糖補加策略對菌體生長和酶活的影響(a)2 g/L;(b)3 g/LFig.5 Effects of the fed strategy of glucose on strain growth and enzyme activity(a)2 g/L;(b)3 g/L
2.3 氮源補加策略對菌體生長和產酶的影響
分批補料過程中碳氮比例很重要。若碳氮比過低,菌體大量利用氮源,導致pH 偏高;若碳氮比過高,菌體會在酶的合成期因為缺乏前體物質而產酶減少。Donowan 等[14]發現,氮源補料培養基中同時含有酵母粉和蛋白胨時,重組蛋白穩定且細胞還能利用代謝合成的乙酸。實驗中分別選取3 種不同的氮源補加策略,考察其對菌體生長和產酶的影響:(a)初始氮源為蛋白胨12 g/L+酵母粉8 g/L,補加氮源補料培養基I;(b)初始氮源為蛋白胨8 g/L +酵母粉5.4 g/L,補加氮源補料培養基I;(c)初始氮源為蛋白胨4 g/L+酵母粉2.7 g/L,補加氮源補料培養基II,氮源初次補加時間與碳源初次補加時間相同,之后每隔2 h 補加50 mL 氮源補料培養基,共補加4 次,結果如圖6 所示。
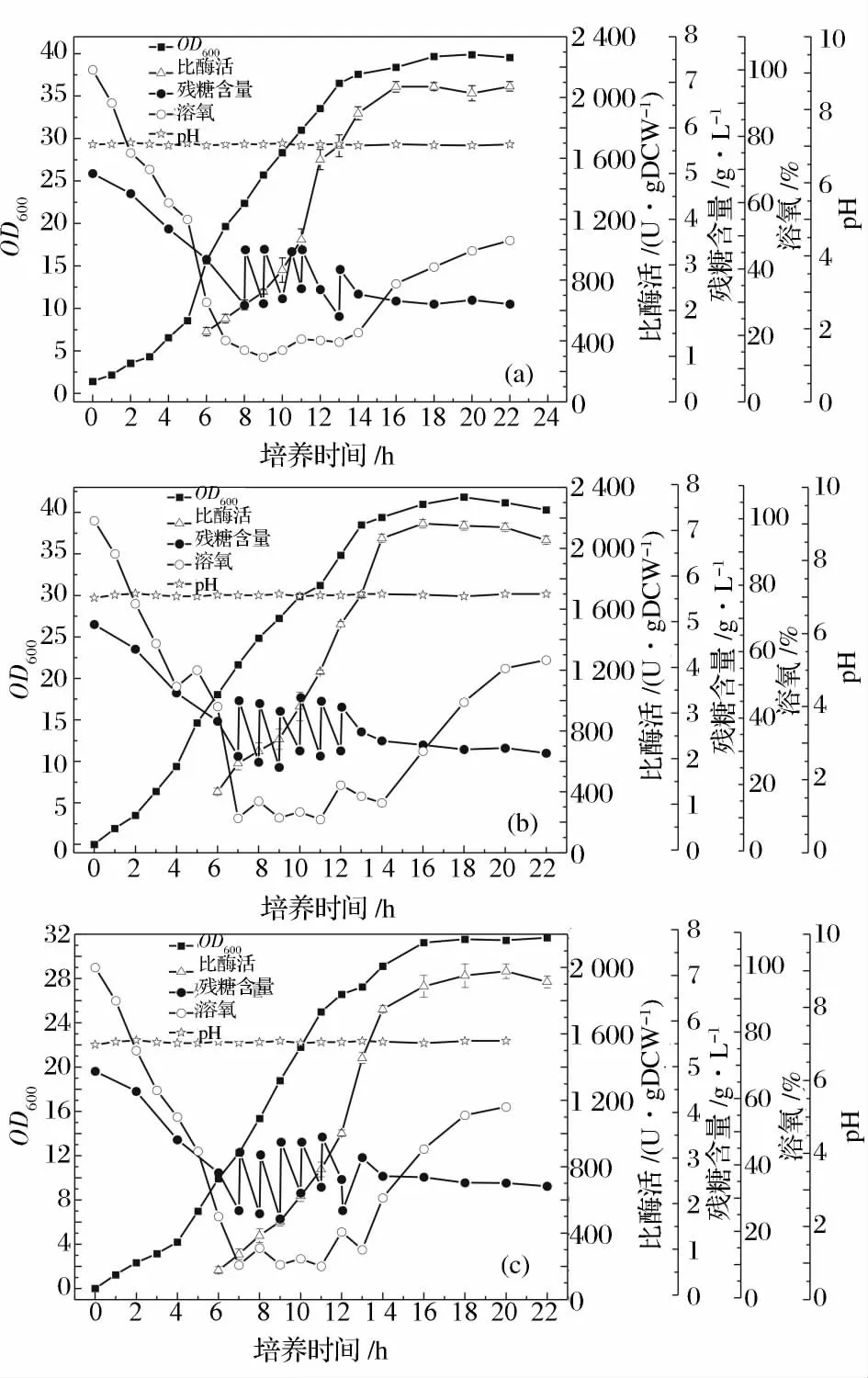
圖6 氮源補加策略對菌體生長和酶活的影響(a)初始氮源為蛋白胨12 g/L+酵母粉8 g/L,補加氮源補料培養基I;(b)初始氮源為蛋白胨8 g/L +酵母粉5.4 g/L,補加氮源補料培養基I;(c)初始氮源為蛋白胨4 g/L +酵母粉2.7 g/L,補加氮源補料培養基IIFig.6 Effects of the fed strategy of nitrogen source on strain growth and enzyme activity
圖6 (a)是在初始發酵培養基中繼續補加氮源補料培養基I,菌體濃度有了很大的提高,但比酶活卻有小幅度的下降。圖6(b)與(a)相比,降低了初始發酵培養基中氮源濃度,從而導致碳源的消耗速度增加,菌體的生長速度較原來變慢;補加氮源之后,菌體生長速度明顯加快,后期繼續補加氮源,整個菌體生長過程和產酶過程延長。圖6(c)中由于初始發酵培養基中氮源濃度過低,前期菌體生長速率受到較大抑制,雖后期補加氮源,但整體菌體濃度和最大酶活都較(b)低。綜合以上因素,選擇(b)作為氮源補加策略。該策略下菌體濃度和酶活都大幅提高,最大菌體量13.68 gDCW/L,比酶活為2 148 U/gDCW,相較于單一補加葡萄糖,菌體量提高了74%。
2.4 誘導時機和誘導劑濃度對菌體生長和產酶的影響
通過碳氮源的分批補料發酵,菌體濃度有了大幅度的提高,但是比酶活有所下降。而誘導時機和誘導劑濃度是影響基因工程菌酶活的重要因素,誘導劑使攜帶質粒的細胞生長速率顯著降低;誘導較早會使菌體和目的蛋白產量降低,而誘導較晚雖然菌體量有所提高,但細胞表達外源蛋白的時間減少。選取發酵時間為2、4、6、8 h 時添加誘導劑,考察其對菌體生長和產酶的影響,結果如圖7 所示。
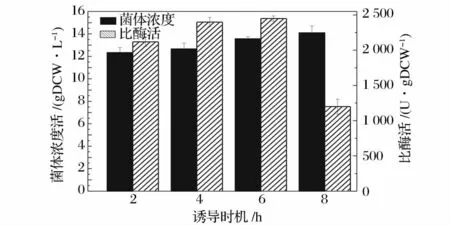
圖7 誘導時機對菌體生長和比酶活的影響Fig.7 Effects of induction time on strain growth and enzyme activity
圖7 可以看出,在2 ~6 h 范圍內,隨著起始誘導時間的延后,菌體量和比酶活逐漸增加,發酵6 h 時添加誘導劑,菌體量13.56 gDCW/L、比酶活2 450 U/gDCW,比發酵2 h 時添加誘導劑菌體量、比酶活分別增加了9.97%、15.57%;而8 h 時添加誘導劑雖然菌體量比2 h 時添加誘導劑的菌體量增加了14.35%,比酶活卻下降了76.67%。綜上所述,選擇發酵6 h左右添加誘導劑。
選取誘導劑濃度為0.1、0.2、0.4、0.6 mmol/L,考察誘導劑濃度對菌體生長和酶活的影響,實驗結果如圖8 所示。
從圖8 可以看出,IPTG 濃度在0.1 ~0.6 mmol/L范圍內對菌體生長和酶活影響不大;其中IPTG 濃度為0.4 mmol/L 時菌體量與0.2 mmol/L 時相同,但其比酶活提高了8.75%,最大酶活為2 610 U/gDCW,因此選擇誘導劑IPTG 濃度為0.4 mmol/L。
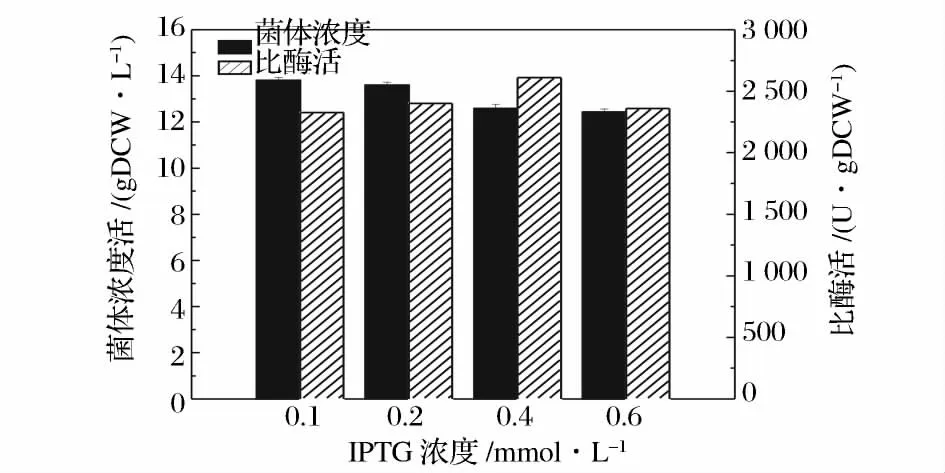
圖8 誘導劑濃度對菌體生長和酶活的影響Fig.8 Effects of induction concentration on strain growth and enzyme activity
2.5 分批補料發酵穩定性實驗
根據以上結果,建立以下發酵工藝:整個發酵過程始終控制發酵液pH 恒定在7.0 左右;初始碳源為葡萄糖5 g/L;初始氮源為蛋白胨8 g/L、酵母粉5.4 g/L;發酵過程中檢測葡萄糖的變化,當葡萄糖濃度下降為2 g/L 左右開始每次補加50 mL 碳源補料培養基,發酵過程中維持葡萄糖濃度在2 ~3 g/L 之間;在補加葡萄糖的同時補加氮源補料培養基I,每隔2 h補加50 mL,共補加4 次;發酵6 h 后添加誘導劑IPTG,終濃度為0.4 mmol/L。結果如圖9 所示。
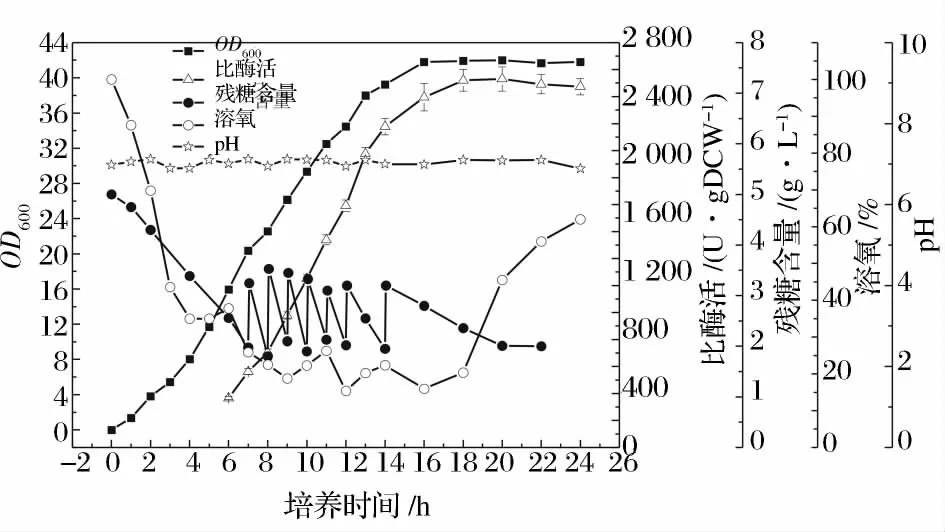
圖9 分批補料發酵穩定性實驗Fig.9 The stability test of fed-batch fermentation
進行3 次驗證試驗,驗證實驗的分批補料發酵過程曲線均和圖9 保持一致,平均菌體量為13.7 gDCW/L,比酶活2 700 U/gDCW,體積酶活為36 990 U/L,表明前期優化結果具有較好的穩定性和可重復性。
3 結論
本文在5 L 發酵罐內建立了工程菌E. coli BL21(DE3)/pET-28b-NIT 表達腈水解酶的分批補料培養工藝,考察了碳、氮源補加及誘導劑添加等因素對重組大腸桿菌生長和腈水解酶酶活的影響,通過優化獲得菌體量可達13.7 gDCW/L,較優化前提高了4.3倍;比酶活為2 700 U/gDCW,體積酶活高達36 990 U/L,比未優化前提高了5.1 倍,實現了工程菌E. coli BL21 (DE3)/pET-28b-NIT 的高密度培養及腈水解酶的高效表達,對于后續蛋氨酸的生物催化法制備具有重要的意義。
[1] Singh R,Sharma R,Tewari N,et al. Nitrilase and its application as a 'green'catalyst[J]. Chem Biodivers,2006,3(12):1 279 -1 287.
[2] Harper D B. Purification and properties of an unusual nitrilase from nocardia N.C.I.B. 11216[J]. Biochem Soc-Trans,1976,4(3):502 -504.
[3] 何玉財,許建和. 腈水解酶在羧酸合成中的研究進展[J]. 生物加工過程,2009,7 (1):7 -12.
[4] 黨萬利,金利群,鄭裕國,等. 蛋氨酸生產工藝研究進展[J]. 食品與發酵工業,2012,38 (4):152 -158.
[5] Mondal S,Das Y B,Chatterjee S P. Methionine production by microorganisms [J]. Folia Microbiol,1996,41(6):465 -472.
[6] Olivier F B,Bontoux M C,Largeau D,et al. Enzymatic hydrolysis of racemic a-substituted 4-methylthiobutyronitriles using a nitrilase from Alcaligenes faecalis,Gordona terrae or Rhodococcus sp. [P]. US,5814497.
[7] Olivier F B,Pierrard J,David C,et al. Industrial scale process for the preparation of 2-hydroxy-4-methylbutyric acid using a nitrilase[P]. US,6180359.
[8] Kobayashi Y,Ono I,Hayakawa K,et al. Process for the production of methionine[P]. US,2005176115.
[9] Zheng Zhi-Yong,Yao Shan-Jing. Preventing acetate production in high cell density cultivation of recombinant Escherichia coli by using feedback control of dissolved oxygen[J]. J Chem Eng Chin Univ,2006,20 (2):233 -238.
[10] Pataik P R. Comparative evaluation of atch and fed-batch bioreactors for GAPDH production by recombinant Escherichta coli with distributed plasmid copy number[J].Chem Eng,2002,87 (3):357 -366.
[11] Seeger A,Schneppe B,Deckwer W D,et a1. Comparison of temperature and isoprople-β-D-thiogalaeto-pyranoside-induced synthesis of basic fibroblast growth factor in high cell density cultures of recombinant Escherichia coli[J]. Enzyme Microb Technol,1995,17 (10):947 -973.
[12] Fuchs C,Koster D,Wiebusch S,et a1. Scale-up of dialysis fermentation for high cell density cultivation of Escherichia coli[J]. Biotechnol,2002,93 (3):243 -251.
[13] Veit A,Polen T,Wendisch V. Global gene expression analysis of glucose overflow metabolism in Escherichia coli and reduction of aerobic acetate formation[J]. Appl Microbiol Biotechnol,2007,74 (2):406 -421.
[14] Donovan R S,Robinson C W,Glick B R. Review:optimizing inducer and culture condition for expression of foreign proteins under the control of the lac promoter[J]. J Ind Microbiol Biot,1996,16 (3):145 -154.

