高血壓病患者基質金屬蛋白酶3基因多態性與左室重構的關系*
邵也常, 鄧木蘭, 符永恒, 許 燕, 石美玲
左心室肥厚(left ventricular hypertrophy,LVH)是左心室對各種機械和激素刺激產生的適應性反應,其中以高血壓誘導的LVH為主,是心血管疾病發病和死亡增加的主要獨立危險因子,也是左心室重構發生的基礎,最終將導致充血性心力衰竭[1]。高血壓誘導LVH的具體機制目前尚未被完全闡明,細胞外基質定性和定量的改變對心肌細胞排列、心肌幾何學構型的影響可能是關鍵因素。而基質金屬蛋白酶(matrix metalloproteinases,MMPs)是一組能特異降解細胞外基質成分的Zn2+依賴的酶,在組織重構中起重要作用,作為MMPs家族激活共同途徑的MMP-3通過膠原降解及激活其它MMPs直接參與了心肌的重構,目前發現MMP-3存在基因多態性,其不同基因型對心血管疾病的發生、發展有著不同的影響,其對左室重構的作用如何,未見相關報道。本研究就高血壓病患者MMP-3基因多態性對血清MMP-3的表達與左室重構的關系進行了分析和探討。
材料和方法
1 臨床資料
入選標準:按照《中國高血壓防治指南》標準確診的高血壓病患者,簽署知情同意書。排除標準:惡性腫瘤、骨關節疾病、肝腎功能障礙、懷孕、嚴重精神疾病患者。共入選190名高血壓病患者,男性107人,女性83人,平均年齡(57.25±7.03)歲。所有患者均自愿入組,對研究內容知情同意,本研究內容經廣東省人民醫院醫學倫理委員會的批準,符合倫理學要求。
2 主要方法
2.1 血清MMP-3檢測 血液標本采集:早晨空腹抽靜脈血各2試管,一管EDTA-Na2抗凝,用于DNA抽提;另一管不加抗凝劑,高速離心機3 000 r/min離心10 min,分離血清,用于MMP-3含量檢測。血清MMP-3水平應用ELISA試劑盒,美國BIO-REK多通道酶標儀(型號:SYNERGY TM HT)進行檢測。2.2 MMP-3基因多態性檢測
2.2.1 DNA提取 應用天根公司的血液基因組提取試劑盒,參照說明書操作步驟進行。
2.2.2 PCR擴增 用Primer Premier 5軟件進行引物設計,目標基因是MMP-3基因啟動子序列。上游引物 5’-CCACCACTCTGTTCTC-3’,下游引物 5’-CCCTATGACTGAAGATGC-3’,由英韋創津公司合成引物。PCR 反應體系(25 μL):10 × 緩沖液 2.5 μL,4 × dNTP(2.5 mmol/L)1.5 μL ,上、下游引物各 1 μL,rTaq DNA 酶0.15 μL,DNA 模板2 μL,然后加雙蒸水至總體積25 μL。PCR反應條件:95℃預變性4 min,95 ℃ 30 s,50 ℃ 30 s,72 ℃ 30 s,擴增 30 個循環,最后72℃ 5 min。取PCR產物3 μL進行1.0%瓊脂糖凝膠電泳,120 V電泳30 min。然后用0.005%溴化乙啶染色。紫外燈下觀察結果。PCR產物送華大基因公司進行測序。
2.3 心臟多普勒超聲檢測 患者取左側臥位,于胸骨左緣長軸面按美國超聲心動協會標準,測定舒張末期左室后壁厚度(left ventricular posterior wall thickness,LPWT)、室間隔厚度(interventricular septal thickness,IVST)、左室舒張末期內徑(left ventricular end-diastolic diameter,LVEDd)和左心室收縮末期內徑(left ventricular end-sysytolic diameter,LVEDs),連續測定3個心動周期取平均值。有關計算公式:體重指數(body mass index,BMI)=weight/height2;體表面積(body surface area,BSA)=0.0061 ×height(cm)+0.0128×weight(kg)-0.1529;左室重量(left ventricular mass,LVM)=0.8 ×[1.04 × (IVST+LVEDd+LPWT)3-LVEDd3]+0.6;左室重量指數(left ventricular mass index,LVMI,g/m2)=LVM/BSA(其中IVST、LVEDd和LPWT單位是cm)。左室肥厚診斷標準:LPWT≥12 mm 和(或)LVMI男≥130 g/m2,女≥120 g/m2。
3 統計學處理
采用SPSS 15.0統計軟件處理數據,計量資料用均數±標準差(mean±SD)表示,正態分布且方差齊的計量資料采用兩獨立樣本t檢驗,不符合正態分布或方差不齊者采用Wilcoxon秩和檢驗,Spearman相關分析;多組資料比較采用方差分析。基因型及等位基因頻率采用以下公式計算:等位基因頻率=1/2(純合子×2+雜合子)/被檢人數。組間基因型及等位基因頻率比較采用卡方檢驗。
結 果
1 基本情況
本組高血壓患者伴有左室肥厚者108人,無左室肥厚者82人。MMP-3基因型測序結果6A純合子128例,5A純合子9例,5A/6A雜合子53例。
2 心臟B超結果
5A基因型左室重量和左室重量指數都要大于6A基因型,差異顯著,室間隔厚度和左室后壁厚度5A基因型也比6A基因型稍大,但差異未達到統計學意義,見表1。攜帶5A基因的高血壓患者比攜帶6A基因的高血壓患者似乎更容易發生左室肥厚,差異顯著,OR=2.05,見表 2。
3 基因型與血清MMP-3水平
5A基因型MMP-3水平要比6A基因型高,分別為5A 基因型(145.35 ±83.29)μg/L、5A/6A 基因型(132.26 ±81.29)μg/L 和 6A 基因型(108.23 ±45.61)μg/L,但各組之間差異無顯著。
4 MMP-3血清水平與心臟B超
MMP-3血清水平與心臟B超測量指標進行相關分析顯示,MMP-3血清水平與室間隔厚度、左室后壁厚度、左室重量和左室重量指數均呈正相關(P<0.01)。
討 論
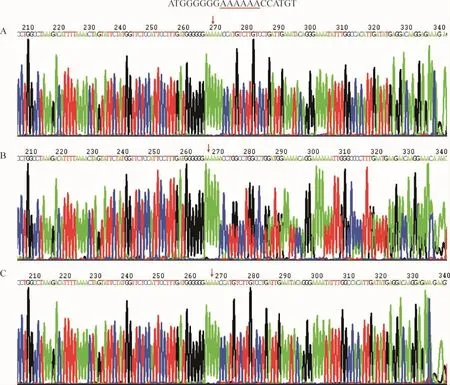
Figure 1.The results of MMP-3 DNA sequencing.Arrows indicate the location of 5A/6A polymorphism in the promoter of MMP-3 gene.A:6A/6A genotype;B:5A/6A genotype;C:5A/5A genotype.圖1 MMP-3基因啟動子測序結果

表1 不同基因型高血壓患者心臟B超測量指標Table 1.The echocardiography indicators of the heart in hypertensive patients with different genotypes(Mean±SD)
左心室重構是心臟對高血壓介導的壓力超負荷的早期代償性反應,主要表現為心肌細胞肥大和細胞外基質異常。環境刺激和組織損傷后,細胞外基質(extracellular matrix,ECM)在數量、組成及空間結構上發生改變,以維持組織的正常結構和功能,因此ECM在維持心臟結構和功能的完整性中發揮著重要作用[2]。ECM主要由3種成分組成:(1)纖維狀蛋白,主要為Ⅰ、III型膠原和彈力蛋白;(2)蛋白聚糖;(3)基底膜蛋白,主要為Ⅳ型膠原、層黏連蛋白和纖維連接蛋白。ECM中來自于成纖維細胞的Ⅰ、III型膠原與心臟結構和功能密切相關。心肌ECM中Ⅰ型膠原、III型膠原占優勢。前者具有高度牽引力和硬度,而后者具有彈性。在高血壓心臟病患者的心肌組織中Ⅰ型膠原明顯增加,Ⅰ型膠原/III型膠原明顯上升,組織僵硬且順應性減低[3]。ECM形成的細胞間網絡為心肌細胞提供機械支持,保持其排列次序,對于心肌組織的完整性和連貫性至關重要,特別是當其肥大和增生的時候。動物和人體模型的研究都報道心肌層膠原結構和組分的變更能夠對左心室形態和功能產生漸進性影響。心肌膠原基質可維持心肌細胞及心肌纖維的排列、限制心肌細胞過度拉長。心肌基質的改變還可造成心肌收縮和有效射血之間失去協調性,并且對維持左室的幾何形狀有明顯的支持作用,減輕泵功能受損。左室泵功能下降早期伴隨左室擴大、室壁變薄及心肌細胞拉長,其中一個重要的因素就是心肌膠原纖維的喪失。而膠原的降解主要受鋅、鈣離子依賴的蛋白水解酶——MMPs的調控。
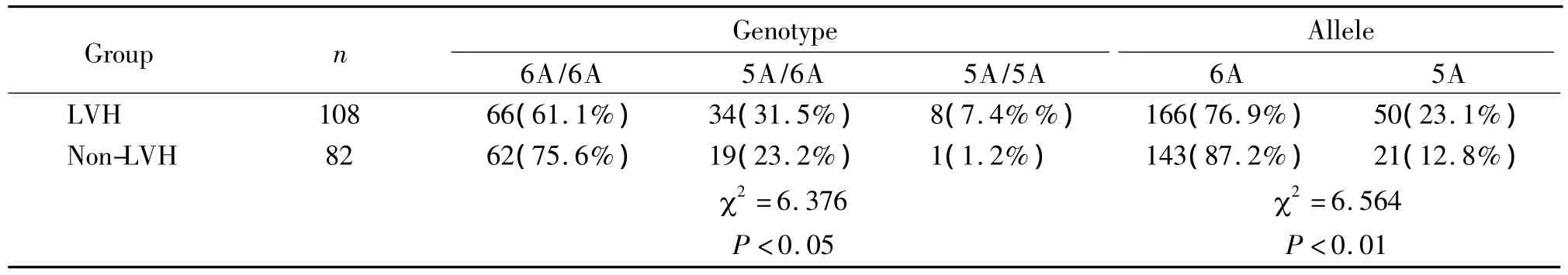
表2 各基因型高血壓患者左室肥厚情況Table 2.Left ventricular hypertrophy in hypertensive patients with different genotypes and alleles
MMPs是一組能特異降解細胞外基質成分的Zn2+依賴的酶,在組織重構中起重要作用。至今發現人體內有5大類24種MMPs。MMPs主要分為膠原酶、明膠酶、基質溶解素及膜型 MMPs(MTMMPs)。各種MMPs以酶原的形式分泌到細胞外后,在其它酶的作用下前肽裂解而激活[4],已經證明MMPs活性在基因轉錄、酶原合成、酶活化水平上受多種因素調節。在心血管系統的重構過程中MMPs通過影響ECM的降解在高血壓病及其并發癥的發生、發展中起重要作用。MMP-3又稱為基質溶解素1(stromelysin 1),分子量為57 kD,在 MMPs家族中具有獨特的功能,它不僅可以降解纖維連接蛋白、層黏連蛋白、蛋白聚糖及Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅸ、Ⅹ型膠原等多種底物,還有激活其它種類MMPs的作用,它是MMPs家族激活的共同途徑,MMP-3通過膠原降解及激活其它MMPs直接參與了心肌的重構。Saglam等[5]研究發現血漿MMP-3和MMP-9在高血壓左室肥厚的患者明顯升高,并與左室后壁厚度呈正比,因此提出在降低血壓的同時降低MMPs濃度對于左室舒張功能有改善作用。在綿羊左室肥厚模型中觀察到代償性左室肥厚伴隨包括MMP-3在內的多種MMPs升高[6]。對擴張性心肌病的研究發現,左心室心肌細胞MMP-3活性比正常對照高4倍。MMPs表達和活性升高,參與了早期左室心肌的重構,應用MMPs抑制劑,可減少左室擴張程度并改善泵功能,因此作者提出調整心肌MMPs的表達和活性,可作為控制心肌基質重構的重要治療目標[7]。Hayashidani等[8]研究發現心力衰竭大鼠心室肌中MMPs活性增高,TIMPs-3的含量減少,同時心室肌膠原纖維束變細、斷裂,膠原含量減少,表明MMPs活性增高,TIMPs-3的減少增加了基質的重構,使心功能從代償期轉變為失代償期。心功能越差,MMP-3在心肌組織的表達越高,其與左室射血分數、心指數呈負相關。單純的II型糖尿病人血漿MMP-3水平與正常人沒有差別,而當糖尿病合并有大血管病變時,其MMP-3水平顯著升高,說明MMP-3參與了糖尿病大血管病變的發生[9]。我們的研究觀察到MMP-3血清水平與左室肥厚指標正相關,可能是MMP-3過度表達引起ECM降解增加,膠原網結構的破壞,使心肌細胞之間的連接趨于松散,心肌細胞排列紊亂,室壁厚度增加。體外細胞培養顯示,正常情況下,α-I型、α-II型膠原纖維表達與MMP-3的表達一致,當α-I型、α-II型膠原纖維表達增加而MMP-3表達降低時,組織增厚,形成瘢痕組織[10]。
MMP-3的表達在轉錄水平受到啟動子基因調節,近年研究發現人類MMP-3基因啟動子區域1171位點存在5A和6A兩個等位基因,有研究證實5A/6A多態性造成MMP-3基因轉錄活性不同,5A純合子的蛋白表達是5A/6A雜合子的4倍,而6A純合子則比5A/6A雜合子低2倍[11]。不同基因型對心血管疾病的作用亦不同,我們的資料顯示5A基因型比6A基因型有較大的左室重量和左室重量指數,室間隔和左室后壁在5A基因型似乎比6A基因型更厚。攜帶5A基因型高血壓患者發生左室肥厚的可能性是攜帶6 A基因型高血壓患者的2倍。我們分析原因可能因為5A基因型MMP-3活性表達較高,引起基質膠原成份降解,破壞正常的間質支持結構,破壞了心肌間質纖維膠原合成和降解之間的動態平衡,使心臟重量增加,心肌纖維化和肥大。但是不同人種、不同研究人群MMP-3基因多態性對心血管的影響不盡相同,一項Meta分析顯示歐洲人群攜帶5A等位基因者心血管病的危險下降,而東亞人群正好相反,攜帶5A等位基因者心血管病的危險性升高[12]。這可能與歐洲人群和亞洲人群5A/6A等位基因頻率相差較大有關,另一種可能是存在其它位點的基因和一些未知因素的交互作用,因此,對于MMP-3基因多態性與心血管病發生、發展的關系,還需從不同角度進行深入的研究。
[1] Zile MR,Desantis SM,Baicu CF,et al.Plasma biomarkers that reflect determinants of matrix composition identify the presence of left ventricular hypertrophy and diastolic heart failure[J].Circ Heart Fail,2011,4(3):246-256.
[2] Ahmed SH,Clark LL,Pennington WR,et al.Matrix metalloproteinases/tissue inhibitors of metalloproteinases:relationship between changes in proteolytic determinants of matrix composition and structural,functional,and clinical manifestations of hypertensive heart disease[J].Circulation,2006,113(17):2089-2096.
[3] Brionesa AM,Arribasb SM,Salaices M.Role of extracellular matrix in vascular remodeling of hypertension[J].Curr Opin Nephrol Hypertens,2010,19(2):187-194.
[4] Lemarie CA,Tharaux PL,Lehoux S.Extracellular matrix alterations in hypertensive vascular remodeling[J].J Mol Cell Cardiol,2010,48(3):433-439.
[5] Saglam M,Karakaya O,Esen AM,et al.Contribution of plasma matrix metalloproteinases to development of left ventricular hypertrophy and diastolic dysfunction in hypertensive subjects[J].Tohoku J Exp Med,2006,208(2):117-122
[6] Schubert A,Walther T,Falk V,et al.Extracellular matrix gene expression correlates to left ventricular mass index after surgical induction of left ventricular hypertrophy[J].Basic Res Cardiol,2001,96(4):381-387.
[7] Spinale FG,Coker ML,Bond BR,et al.Myocardial matrix degradation and metalloproteinase activation in the failing heart:a potential therapeutic target[J].Cardiovasc Res,2000,46(2):225-238.
[8] Hayashidani S,Tsutsui H,Ikeuchi M,et al.Targeted deletion of MMP-2 at tenuates early LV rupture and late remodeling after experimental myocardial infarction[J].Am J Physiol Heart Circ Physiol,2003,285(3):H1229-H1235.
[9] 徐 磊,盧興國,陳懷紅,等.基質金屬蛋白酶3和尿激酶型纖溶酶原激活物受體在2型糖尿病大血管病變中的變化[J].中國病理生理雜志,2007,23(5):897-899.
[10] McFarland KL,Glaser K,Hahn JM,et al.Culture medium and cell density impact gene expression in normal skin and abnormal scar-derived fibroblasts[J].J Burn Care Res,2011,32(4):498-508.
[11] Medley TL,Kingwell BA,Gatzka CD,et al.Matrix metalloproteinase-3 genotype contributes to age-related aortic stiffening through modulation of gene and protein expression[J].Circ Res,2003,92(11):1254-1261.
[12] Koch W,de Waha A,Hoppmann P,et al.Haplotypes and 5A/6A polymorphism of the matrix metalloproteinase-3 gene in coronary disease:case-control study and a meta-analysis[J].Atherosclerosis,2010,208(1):171-176.

