PCR法檢測結核分枝桿菌DNA在鑒別克羅恩病與腸結核中的價值*
陳瑜君, 何 瑤, 陳白莉, 毛 仁, 晁 康, 徐萍萍, 曾志榮, 陳旻湖, 胡品津
腸結核(intestinal tuberculosis,ITB)和克羅恩病 (Crohn disease,CD)臨床表現有很多相似之處,且病理特征上都具有肉芽腫形成的特點,較難區別2種疾病。克羅恩病是一組發病機制不明的腸道炎癥性疾病,其發病機制認為與腸道細菌和環境因素作用于遺傳易感的人群,引起異常免疫反應有關。結核分枝桿菌感染作為ITB的病因已明確,因此從病原學檢測的角度出發,探索在腸結核患者中直接檢測結核分枝桿菌 DNA(Mycobacterium tuberculosis,MTB)快捷有效的方法對鑒別兩病重要意義。
ITB是由人型MTB感染所致的特異性腸道炎癥。結核菌在感染人體后,多處于潛伏狀態,它能在宿主細胞內逃逸宿主的防御作用而大量繁殖,一般情況下,約10%的感染者可發展為致病性結核,在病灶檢測到結核桿菌可診斷結核。IS6110[1-2]是 MTB基因組中一個多拷貝的保守片段,有1 361 bp的核苷酸和28 bp的反向末端重復序列,MTB中含有該序列10~20拷貝,具有較高的敏感性。該序列僅存在于人型結核分枝桿菌、牛型結核分枝桿菌(包括BCG)和非洲結核分枝桿菌中,亦具有較高的特異性。根據IS6110設計引物的聚合酶鏈反應(polymerase chain reaction,PCR)具有高敏感性和高特異性的優點,特別是菌量少時更能顯示出該技術的優越性。本研究旨在通過PCR技術檢測ITB與CD患者腸道組織的MTB,探索進行快速MTB病原學診斷試驗方法在確診ITB中的可行性及價值,同時為ITB和CD鑒別診斷提供方便快捷的方法。
材料和方法
1 組織標本
石蠟標本來自中山大學附屬第一醫院病理科2002年~2011年檔案保存病例,其中ITB 25例,CD 25例。所有標本通過HE染色切片,由病理學家重新讀片確定病理診斷。病人有完整臨床病理資料及內鏡資料,由消化內科專家重新分析臨床資料,確定臨床診斷。所有患者取材前未接受抗結核治療。
2 陽性對照菌株
陽性對照菌株H37Rv標準菌株DNA由廣州市胸科醫院研究所惠贈。
3 主要儀器
ABI 9700 PCR儀。
4 石蠟組織DNA的提取
腸結核和克羅恩病患者腸道組織DNA提取自石蠟包埋組織,采用QIAamp DNA Mini Kit(Qiagen)試劑盒提取。具體操作如下:(1)從腸結核患者和克羅恩病患者石蠟組織標本中切取8 μm×8張的切片;(2)分次加入適量二甲苯、無水乙醇溶解蠟塊,并加入50 μL溶菌酶;(3)加入180 μL的ATL緩沖液;(4)加入20 μL蛋白酶K(protease K),將離心管放入56℃水浴箱直至組織完全溶解,加長溶解時間,可過夜,此過程需不時振蕩離心管以分散組織;(5)依據說明書分次加入Buffer AL、無水乙醇溶解;(6)取上述混合液入QIAamp柱中,據說明書分次加入Buffer AW1、Buffer AW2和Buffer AE提取DNA。
5 DNA完整性的判斷
1.5 %瓊脂糖,電壓100 V,20 ~30 min。
6 PCR引物的設計與合成
引物采用Primer 5.0軟件設計,均由廣州英韋創津生物科技有限公司合成。具體序列及片段長度:目的基因IS6110引物正義鏈5'-CCTGCGAGCGTAGGCGTCGG-3',反義鏈 5'-CTCGTCCAGCGCCGCTTCGG-3',目的產物長度123 bp。內參照β-actin引物正義鏈5'-GCATGGGTCAGAAGGATTCCT-3',反義鏈5'-TCGTCCCAGTTGGTGACGAT-3',產物長度 106 bp。
7 PCR擴增反應
50 μL 反應體系:PCR Mix 20 μL,ddH2O 6 μL,Primer F 2 μL,Primer R 2 μL,DNA 20 μL。反應條件:預變性 95℃ 5 min,93℃ 30 s,60℃ 45 s,72℃35 s,35 個循環。
8 電泳
于含有溴化乙啶染色的2%瓊脂糖凝膠電泳,紫外線下觀察結果。
9 測序
抽樣測序擴增出目的條帶的PCR擴增產物,由華大基因測序,采用雙向測序。PCR產物測序所得基因序列在 GenBank(http://www.ncbi.nlm.nih.gov)數據庫中比對。
10 質量控制
本實驗采用多項措施控制質量,避免污染及減少假陰性:(1)操作過程Eppendorf管開蓋操作均在生物安全柜中進行;(2)每輪反應均設置陽性對照和陰性對照;(3)擴增陰性者均重復2次,3次擴增均陰性者方可判斷為陰性。
11 統計學處理
選用SPSS 18.0統計軟件分析,兩組陽性率比較采用卡方檢驗或Fisher精確概率檢驗。以P<0.05為差異有統計學意義。
結 果
1 MTB DNA PCR有助于確診ITB
如表1中所示,ITB標本中MTB PCR陽性率為32%(8/25),CD標本中 MTB PCR陽性率為0%(0/25)。MTB DNA PCR法在ITB和CD鑒別診斷中的靈敏度為32%,特異度為100%,陽性預測值為100%,陰性預測值59.5%。而在本組病例中抗酸染色法和病理確診(干酪樣壞死)靈敏度僅分別為8%和12%,PCR敏感性明顯高于抗酸染色(P<0.05)和干酪樣壞死(P<0.05)。
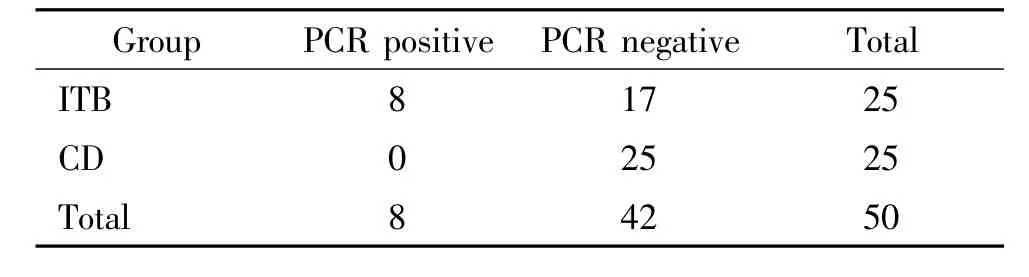
表1 腸結核組與克羅恩病組MTB PCR檢測結果Table 1.Positive results of MTB DNA PCR in ITB and CD groups
圖1所示為MTB PCR結果,目的電泳條帶長度為123 bp。所有陽性對照和陰性對照均出現預期相應的陽性及陰性結果。PCR測序由華大基因完成,采用雙向測序,PCR產物測序所得基因序列在Gen-Bank(http://www.ncbi.nlm.nih.gov)數據庫中比對,結果顯示與電泳結果相符,圖2示部分測序結果。
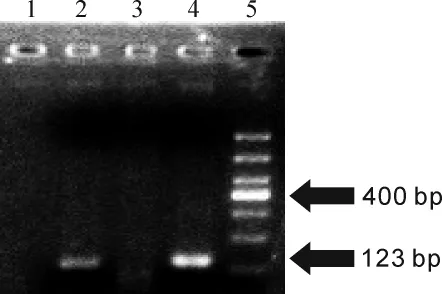
Figure 1.PCR results for MTB DNA detection.1:negative control;2:intestinal tuberculosis sample;3:Crohn disease sample;4:positive control;5:DNA marker.圖1 IS6110 PCR擴增結果
Figure 2.Target DNA PCR product sequencing figure(part).圖2 PCR擴增出目的條帶標本的PCR產物測序圖(部分)
2 PCR法陽性率與病理特征的關系
如圖3所示,25例ITB患者石蠟切片標本發現肉芽腫的共12例,有肉芽腫標本PCR陽性率為41.7%,無肉芽腫組陽性率為23.1%,但差異無統計學意義(P>0.05)。進一步分析肉芽腫數目與PCR陽性率間的關系,肉芽腫數目≥2個/切片的標本7例,PCR的陽性率為42.9%,肉芽腫數目=1個/切片的標本5例,2例PCR陽性,差異無統計學意義(P>0.05)。9例標本可見多核巨細胞,PCR陽性率為44.4%,不含巨核細胞標本的陽性率為25.0%,差異無統計學意義(P>0.05)。其中1例為僅含離散的多核巨細胞,PCR結果陰性。2例同時含離散多核巨細胞和肉芽腫內多核巨細胞,1例PCR結果陽性。6例多核巨細胞僅位于肉芽腫內,有3例PCR結果陽性。圖4示部分典型病理表現。
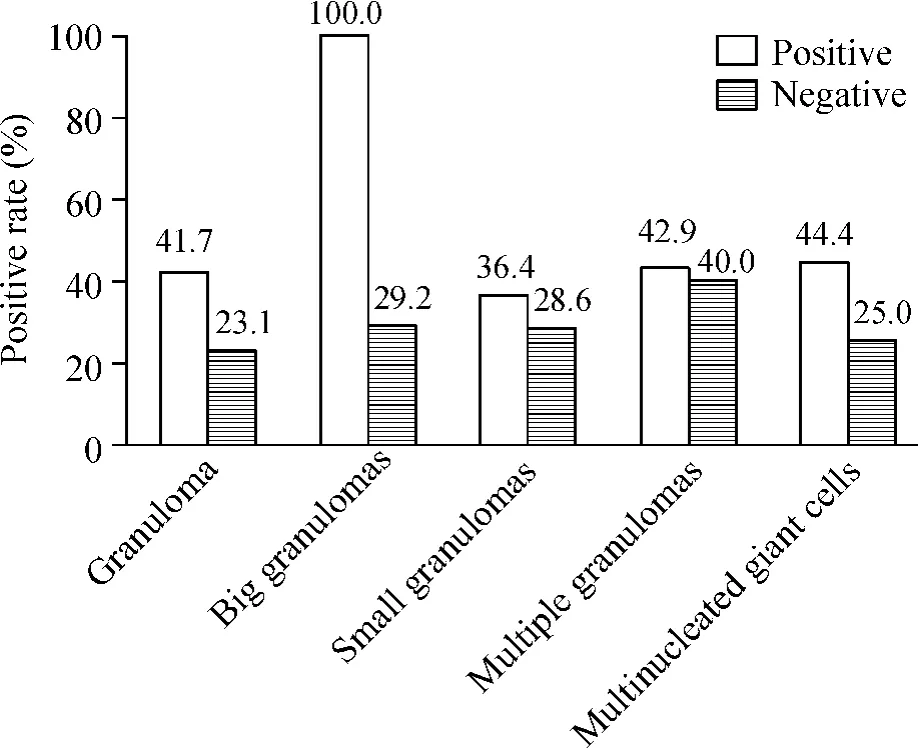
Figure 3.The relationship between MTB DNA positive rate and pathological features.Big granulomas:diameter ≥200 μm;small granulomas:diameter < 200 μm;multiple granulomas:granuloma number≥2 each specimen.圖3 PCR法檢測MTB DNA陽性率與病理特征的關系
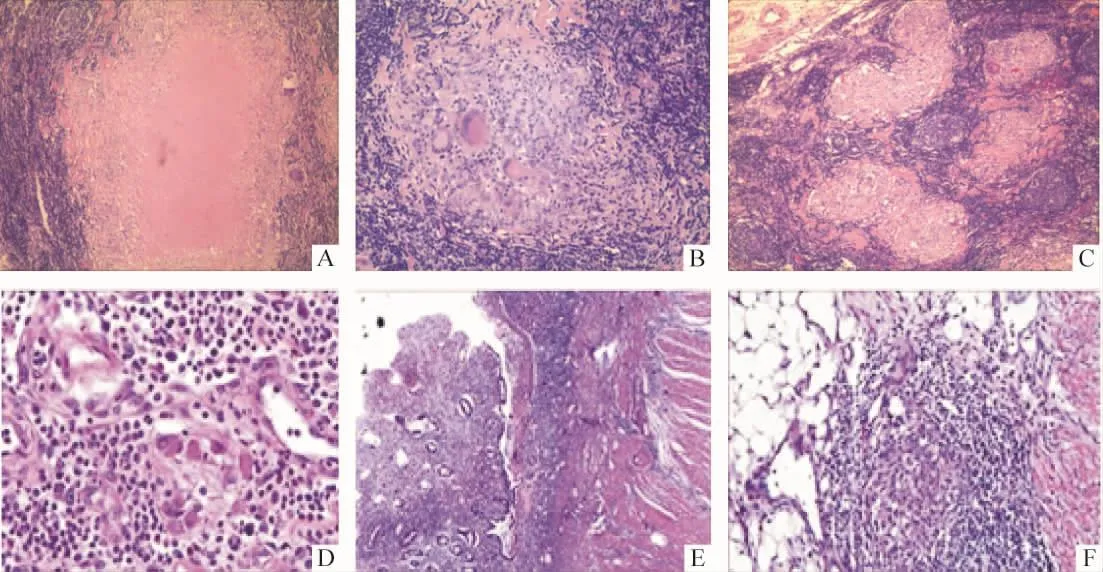
Figure 4.Typical pathological manifestations of ITB and CD.A(×100),B(×200)and C(×100)showed caseation necrosis,horseshoe-shaped or wreath-like multinucleated giant cells and dense fused granulomas,respectively,supporting ITB;D(×400),E(×100)and F(×200)revealed ganglion cells,fissure-like ulcer and loose small granulomas,respectively,supporting CD.圖4 腸結核和克羅恩病的部分典型病理表現
討 論
ITB和CD的鑒別診斷一直是臨床難題。如果將CD誤診為ITB,將導致不必要的抗結核治療和藥物毒性,及導致CD的治療延遲。反之,如果將ITB誤診為CD,采用激素、免疫抑制劑甚至生物制劑治療可使病情惡化甚至死亡。目前對2種疾病的鑒別診斷主要依據內鏡檢查和手術標本組織病理,以及診斷性抗結核治療[3]。而典型臨床特征、結核桿菌抗酸染色、結核桿菌培養陽性等僅見于極少數患者,因此作為鑒別診斷依據的價值有限。結核桿菌PCR、小腸CT成像(CTE)和結核感染酶聯免疫斑點實驗(T.SPOT.TB)成為目前較新的研究熱點[4]。
MTB DNA PCR技術在PCR技術將病原體的檢測帶入了分子生物學時代時已嘗試應用于此領域。其優越性體現在:(1)敏感性高,尤其適用于ITB抗酸染色陰性或未見干酪樣壞死典型病例表現的標本;(2)特異性高;(3)快速。1989年法國學者Brisson-Noёl等[5]首先報道將 PCR 技術用于診斷結核病。近年國內外多家研究機構已經對PCR技術應用于ITB的診斷做了一些初步的探討。PCR在ITB的診斷中敏感性一般,但特異性很高。國內以華西為代表的研究機構做出的結果其敏感性可達60%以上[6-9],國外主要是印度和韓國結核較高發的國家在研究,其做出的敏感性在21.6% ~45.0%。而特異性都高達80%以上[10-12]。我們的研究MTB DNA檢查的陽性率為32%,與報道相符。
MTB DNA PCR假陰性的原因主要有:(1)活組織標本:組織中結核分枝桿菌DNA的提取量小于PCR法檢出下限。MTB DNA在ITB病人的組織中濃度很低,分布不均勻,且內鏡活檢組織,鉗取組織量少且淺。這些特征導致提取的DNA主要是組織DNA,不能有效地從分枝桿菌中提取結核DNA。(2)石蠟標本:某些石蠟包埋組織陳舊,DNA已降解或破壞;組織的反復凍融也有可能破壞DNA。(3)實驗技術:DNA提取時結核分枝桿菌未破解成功,結核分枝桿菌包壁堅韌,裂解困難,不除外提取的主要是組織DNA,部分分枝桿菌未充分裂解釋放出DNA。此外不排除商品化的DNA分離試劑則可能移除我們所要檢測的部分結核桿菌DNA,這將導致錯誤的陰性結果。
針對上述可能出現的問題,我們的研究圍繞著DNA提取和PCR擴增,建立穩定的實驗學方法提高實驗可靠性和檢出率。(1)DNA提取是結核DNA PCR的關鍵,增加活檢數量和部位[13],在DNA提取前加入溶解酶,加大蛋白酶K的量、加長溶解時間,盡量增強溶解效果。選用可達到較高濃度和純度產物的試劑盒。(2)PCR擴增選擇MTB基因組中一個多拷貝的保守片段 IS6110 設計引物[1,14],具有較高的敏感性及高度特異性。(3)其次擴增123 bp片段,避免了大片段因石蠟包埋處理過程的DNA降解、斷裂而導致的假陰性。(4)進行質量監控。設立陽性對照和陰性對照,并對結果陰性的標本重復2次PCR擴增。
許多研究探討分枝桿菌PCR陽性率與病理特征的關系,ITB特異性指標干酪樣壞死和抗酸染色陽性率低。大(直徑>200 μm)、致密、融合、邊界清的黏膜下肉芽腫傾向ITB。直徑小(<200 μm)、非融合、邊界不清、結構排列疏松肉芽腫傾向于CD。多核巨細胞在腸結核和克羅恩病患者均可見。報道提示,PCR的陽性率同病理特征有關[12],有特征性病理表現的組織PCR陽性率更高。可能與結核分枝桿菌多存在于上皮樣肉芽腫形成部位有關。在我們的研究中,PCR的陽性率在有肉芽腫、巨核細胞的標本中較高,但未達顯著差異,考慮與樣本量小有關。大樣本研究、定量PCR和血清學檢測[15]等更敏感的方法是今后研究的方向。
PCR法可用于結核分枝桿菌DNA檢測,隨著分子技術的不斷進步,大大縮短了診斷所需時間,敏感性和特異性也不斷提高,是確診ITB以及研究ITB和CD鑒別診斷的一種方便快捷的輔助診斷方法。
[1] Cole ST,Brosch R,Parkhill J,et al.Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence[J].Nature,1998,393(6685):537-544.
[2] Thierry D,Cave MD,Eisenach KD,et al.IS6110,an-IS-like element of Mycobacterium tuberculosis complex[J].Nucl Acids Res,1990,18(1):188.
[3] 高 翔,何 瑤,陳瑜君,等.試驗性抗結核治療鑒別腸結核與克羅恩病的臨床與內鏡分析[J].中華消化內鏡雜志,2011,28(8):446-451.
[4] 李 陰,張麗帆,丁 輝,等.評價T-SPOT.TB應用于克羅恩病與腸結核鑒別診斷的意義[C]∥中華醫學會.第十次全國消化系統疾病學術會議匯編.2010:92.
[5] Brisson-Noёl A,Gicquel B,Lecossier D,et al.Rapid diagnosis of tuberculosis by amplification of mycobacterial DNA in clinical samples[J].Lancet,1989,2(8671):1069-1071.
[6] 顧 清,歐陽欽,張文燕,等.克羅恩病與腸結核臨床及病理特征的對比研究[J].中華內科雜志,2009,48(4):291-294.
[7] Ouyang Q,Tandon R,Goh KL,et al.Management consensus of inflammatory bowel disease for the Asia-Pacific region[J].J Gastroenterol Hepatol,2006,21(12):1772-1782.
[8] 甘華田,歐陽欽,步 宏,等.聚合酶鏈反應對腸結核和克隆病的診斷價值[J].中華內科雜志,1995,34(1):30-33.
[9] 甘華田,歐陽欽,步 宏,等.結核桿菌DNA檢測在腸結核與克羅恩病鑒別診斷中的價值[J].中華消化雜志,2001,21(4):215-218.
[10] Pulimood AB,Peter S,Rook GW,et al.In situ PCR for Mycobacterium tuberculosis in endoscopic mucosal biopsy specimens of intestinal tuberculosis and Crohn disease[J].Am J Clin Pathol,2008,129(6):846-851.
[11] Amarapurkar DN,Patel ND,Amarapurkar AD,et al.Tissue polymerase chain reaction in diagnosis of intestinal tuberculosis and Crohn's disease[J].J Assoc Physicians India,2004,52:863-867.
[12] Jin XJ,Kim JM,Kim HK,et al.Histopathology and TBPCR kit analysis in differentiating the diagnosis of intestinal tuberculosis and Crohn’s disease[J].World J Gastroenterol,2010,16(20):2496-2503.
[13] Pulimood AB,Peter S,Ramakrishna B,et al.Segmental colonoscopic biopsies in the differentiation of ileocolic tuberculosis from Crohn’s disease[J].J Gastroenterol Hepatol,2005,20(5):688-696.
[14] Negi SS,Anand R,Pasha ST,et al.Diagnostic potential of IS6110,38kDa,65kDa and 85B sequence-based polymcrase chain reaction in the diagnosis of Mycobacterium tuberculosis in clinical samples[J].Indian J Med Microbiol,2007,25(1):43-49.
[15] 張萬將,王 萍,李 蕾,等.結核分枝桿菌國際標準無毒株H37Ra菌株基因組DNA抗結核免疫效應的初步研究[J].中國病理生理雜志,2008,24(8):1534-1537.

