氫氯噻嗪片抽驗(yàn)結(jié)果及溶出度實(shí)時(shí)測(cè)定法的考察
趙慶華,鞏 偉,趙 豫
按照全軍藥品抽驗(yàn)工作計(jì)劃要求,筆者所在單位在全軍醫(yī)療機(jī)構(gòu)范圍內(nèi)對(duì)氫氯噻嗪片進(jìn)行了評(píng)價(jià)性抽驗(yàn),抽驗(yàn)結(jié)果表明,此次抽驗(yàn)覆蓋面廣,代表性強(qiáng),在一定程度上反映了我國(guó)氫氯噻嗪片產(chǎn)品的總體水平。
1 基本信息
1.1 評(píng)價(jià)性抽驗(yàn)涉及氫氯噻嗪片的基本信息 見表1。

表1 氫氯噻嗪片的基本信息
1.2 抽驗(yàn)樣品機(jī)構(gòu)分布 抽驗(yàn)樣品所涉及的醫(yī)療衛(wèi)生機(jī)構(gòu)隸屬于各軍區(qū)和總后勤部的醫(yī)院、門診部、干休所、療養(yǎng)院、部隊(duì)衛(wèi)生隊(duì)以及倉(cāng)庫(kù)等醫(yī)療衛(wèi)生機(jī)構(gòu),具體分布情況見圖1。

抽驗(yàn)樣品的醫(yī)療衛(wèi)生機(jī)構(gòu)分布情況
1.3 檢驗(yàn)標(biāo)準(zhǔn) 按中國(guó)藥典2010年版二部“氫氯噻嗪片”項(xiàng)下檢驗(yàn)[1],主要檢驗(yàn)項(xiàng)目為【性狀】、【鑒別】、【檢查】、【其他】、【含量測(cè)定】。
1.4 檢驗(yàn)結(jié)果 抽驗(yàn)氫氯噻嗪片樣品數(shù)339批,檢驗(yàn)結(jié)果均符合規(guī)定,合格率為100%。全軍各大區(qū)抽取樣品的檢驗(yàn)結(jié)果未見明顯差異。
2 溶出度實(shí)時(shí)測(cè)定法的考察
《中國(guó)藥典》2010年版對(duì)氫氯噻嗪片采用傳統(tǒng)溶出度測(cè)定法測(cè)定其溶出度[1],方法較為繁瑣,且無法得知溶出過程中的全部信息。筆者利用本次全軍抽驗(yàn)機(jī)會(huì),以光纖藥物溶出度實(shí)時(shí)測(cè)定儀對(duì)部分廠家10批次的氫氯噻嗪片進(jìn)行了溶出度測(cè)定,建立了在線考察氫氯噻嗪片溶出過程的方法,從而比較藥物溶出過程的差異,初步評(píng)價(jià)藥品的質(zhì)量差異。
2.1 儀器與試藥
2.1.1 儀器 FODT-601光纖藥物溶出度實(shí)時(shí)測(cè)定儀(上海富科思分析儀器有限公司),AE-240型電子天平(上海天普分析儀器有限公司)。
2.1.2 試藥 氫氯噻嗪對(duì)照品(中國(guó)藥品生物制品鑒定所,含量99.8%;批號(hào):100309-200702);氫氯噻嗪片(規(guī)格:25 mg);A廠:3批,批號(hào)101019,標(biāo)示為樣品1;批號(hào)101211,標(biāo)示為樣品2;批號(hào)110318,標(biāo)示為樣品3;B廠2批:批號(hào)110201,標(biāo)示為樣品4;批號(hào)110302,標(biāo)示為樣品5;C廠5批:批號(hào)110226,標(biāo)示為樣品6;批號(hào)110112,標(biāo)示為樣品7;批號(hào)101129,標(biāo)示為樣品8;批號(hào)101225,標(biāo)示為樣品9;批號(hào)110304,標(biāo)示為樣品10。
2.2 方法與結(jié)果
2.2.1 檢測(cè)波長(zhǎng)及光程選擇 根據(jù)標(biāo)準(zhǔn)溶液紫外吸收?qǐng)D譜,選擇272 nm作為測(cè)定波長(zhǎng),550 nm作為參比波長(zhǎng),以消除溶液中不溶微粒等的干擾。
2.2.2 探頭標(biāo)定 用系列標(biāo)準(zhǔn)溶液分別標(biāo)定6個(gè)光纖探頭,進(jìn)行線性回歸,得到6條標(biāo)準(zhǔn)曲線。結(jié)果顯示,在測(cè)定范圍內(nèi)線性關(guān)系良好,且6個(gè)通道測(cè)定結(jié)果的均一性較好(表2)。

表2 標(biāo)準(zhǔn)曲線測(cè)定結(jié)果(n=5)
2.2.3 溶出度試驗(yàn)方法 按中國(guó)藥典2010年版二部規(guī)定的氫氯噻嗪片溶出度測(cè)定條件,取6片采用轉(zhuǎn)籃法測(cè)定,由光纖藥物溶出度原位過程監(jiān)測(cè)儀自動(dòng)記錄吸收度值,繪制溶出曲線。
2.2.4 溶出度試驗(yàn)結(jié)果 按上述實(shí)驗(yàn)方法,測(cè)定了10批樣品的溶出度。中國(guó)藥典2010版二部規(guī)定的限度為60%,結(jié)果均符合規(guī)定。不同廠家之間、同一廠家不同批號(hào)樣品之間乃至同一廠家同一批樣品之間的溶出曲線差異均較大,說明氫氯噻嗪片的生產(chǎn)工藝不穩(wěn)定,見圖2。
2.2.5 統(tǒng)計(jì)學(xué)分析 在制劑的開發(fā)研究中,通過對(duì)比不同批次之間的溶出曲線,可以較準(zhǔn)確地反映藥物處方、工藝、生產(chǎn)場(chǎng)地及規(guī)模等因素變化對(duì)藥物體外釋放行為的影響。本文采用計(jì)算簡(jiǎn)單、判定結(jié)果可靠的f2因子方法作為評(píng)價(jià)體外溶出曲線相似性的方法,該方法作為評(píng)價(jià)體外溶出曲線相似性的方法已經(jīng)被美國(guó)FDA的化學(xué)類藥物評(píng)價(jià)與研究中心(CDER)和歐盟藥品審評(píng)管理局(EMEA)收載并推薦使用。f2因子的計(jì)算公式為:
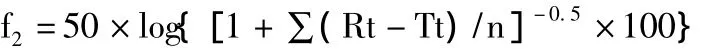
式中,Rt與Tt分別代表參比和受試制劑第t時(shí)間點(diǎn)的平均累積釋放度,n為測(cè)試點(diǎn)數(shù)。根據(jù)樣品溶出曲線,樣品1的批內(nèi)均一性較好,故選取1為參比,樣品2~10為受試制劑,選取4、6、8、10、15 min 點(diǎn)的溶出數(shù)據(jù),采用相似因子法進(jìn)行統(tǒng)計(jì)分析和比較。一般認(rèn)為,f2在50~100,可認(rèn)為2種制劑的溶出過程相似或等同。參比制劑和受試制劑在前4個(gè)時(shí)間點(diǎn)的組內(nèi)溶出值RSD不能超過20%,最后1個(gè)時(shí)間點(diǎn)的RSD不能超過10%,見表3。而統(tǒng)計(jì)分析結(jié)果顯示,2、4、5、9四批樣品符合相似因子法對(duì)數(shù)據(jù)變異的要求,其他的不能進(jìn)行f2因子計(jì)算。


圖2 不同廠家氫氯噻嗪片的實(shí)時(shí)溶出曲線
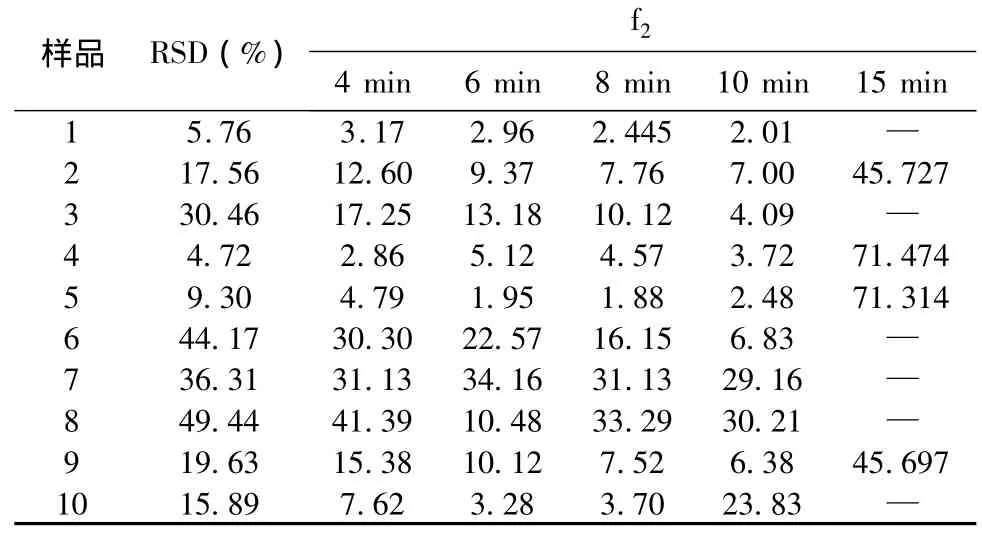
表3 統(tǒng)計(jì)分析結(jié)果
3 討論
改進(jìn)溶出度評(píng)價(jià)方法,以提高固體藥物制劑水平,縮小我國(guó)目前藥品內(nèi)在質(zhì)量方面與進(jìn)口藥品的差距,是我國(guó)醫(yī)藥工業(yè)發(fā)展的迫切需求;而對(duì)多個(gè)廠家生產(chǎn)的同類品種進(jìn)行科學(xué)、有效的溶出度測(cè)定,對(duì)于溶出度評(píng)價(jià)方法的改進(jìn)工作的實(shí)施,能夠提供翔實(shí)的實(shí)驗(yàn)依據(jù)。經(jīng)10批樣品溶出過程考察,所有樣品均符合中國(guó)藥典2010版二部的溶出度檢查規(guī)定,但其溶出過程卻各不相同,不同廠家之間、同一廠家批內(nèi)和批間的藥品溶出過程差異均較大,這種差異與藥物的療效密切相關(guān),必然影響藥物的臨床療效,實(shí)時(shí)檢測(cè)溶出度能較客觀地反映固體制劑的質(zhì)量。而根據(jù)傳統(tǒng)的標(biāo)準(zhǔn)檢驗(yàn),只能檢測(cè)終點(diǎn)的溶出值,無法監(jiān)測(cè)其實(shí)際溶出過程。因此,改進(jìn)溶出度評(píng)價(jià)方法勢(shì)在必行。相似因子統(tǒng)計(jì)分析結(jié)果反映出各廠家藥品的溶出過程差異較大,可推測(cè)不同廠家之間制劑工藝存在較大差異,且同一廠家同批號(hào)各片間有的也具有顯著性差異。藥物溶出度直接影響藥物的吸收和生物利用度,從而導(dǎo)致體內(nèi)作用強(qiáng)度不同,影響臨床效果。故制劑研究中對(duì)藥物溶出速率應(yīng)予以控制。光纖藥物溶出度實(shí)時(shí)測(cè)定儀能夠有效監(jiān)測(cè)氫氯噻嗪片的體外溶出過程,為改進(jìn)制劑工藝、監(jiān)控制劑工藝穩(wěn)定性,提高藥品分析能力提供有益的參考;且應(yīng)用這種儀器,可以減輕勞動(dòng)強(qiáng)度,提高測(cè)試精密度,對(duì)多數(shù)固體制劑質(zhì)量控制具有現(xiàn)實(shí)意義。研究論證采用光纖藥物溶出度實(shí)時(shí)測(cè)定法測(cè)定藥物溶出度的可行性,酌情修訂藥典標(biāo)準(zhǔn)中【檢查】項(xiàng)下溶出度的測(cè)定方法。
[1]中華人民共和國(guó)藥典委員會(huì).中華人民共和國(guó)藥典(二部)[S].北京:中國(guó)醫(yī)藥科技出版社,2010.556.附錄XC.
[2013-05-08收稿,2013-06-10修回] [本文編輯:羨秋盛]

