雌二醇誘導雌性大鼠真性性早熟模型的建立
楊 嶸,張立實,王以美,張 麗,黃麗娜,張廷芬,束玉磊,趙 君,彭雙清
(四川大學華西公共衛生學院1.毒理學教研室,3.營養與食品衛生學教研室,四川成都 610041;2.軍事醫學科學院疾病預防控制所毒理學評價研究中心,北京 100071)
性早熟是指女性兒童8歲前,男性兒童9歲前開始的第二性征發育。近年,全球兒童的性早熟發生率顯著增加,其對患兒身心健康產生嚴重影響[1]。性早熟按其性質可分為真性性早熟和假性性早熟兩種類型[2]。真性性早熟是由于下丘腦-垂體-性 腺 軸 (hypothalamic-pituitary-gonadal axis,HPGA)被提前激活而導致生殖能力的提前出現[3];假性性早熟是指HPGA并沒有提前啟動,僅表現為部分第二性征的提前出現。目前報道的真性性早熟模型的建立,主要有由達那唑[4]和N-甲基-DL-天冬氨酸[5]誘導的兩種,雌激素誘導真性性早熟的發生罕見報道。大鼠青春期發育過程與人類近似[6],且大鼠性發育各項指征明確,性早熟建模時間短(2~3個月),性周期短(4~5 d),因此本次研究選擇大鼠作為性早熟研究的實驗動物。連續5 d給予青春期前雌性大鼠 17β-雌二醇50 μg·kg-1,觀察大鼠性發育過程中HPGA功能的改變,探討雌二醇誘導真性性早熟模型建立的意義,及其作用機制。
1 材料與方法
1.1 儀器與試劑
CR3i型低溫高速冷凍離心機和MK3型多功能酶標儀(上海Thermo公司);BT224S型電子天平(德國Sartorius公司);CKX41型倒置顯微鏡和全自動高壓滅菌器(日本Sanyo公司);TC-412型PCR儀(美國 ABI)。17β-雌二醇,購自美國Cayman公司;大鼠黃體生成素(luteinizing hormone,LH),卵泡刺激素(follicle stimulating hormone,FSH),雌激素(estradiol,E2)ELISA 檢測試劑盒,購自美國Rapidbio.Lab公司;PCR轉錄試劑盒,購自美國Fermentas公司;促性腺激素釋放激素(gonadotropin releasing hormone,GnRH)、Kiss-1、G蛋白偶聯受體54(G protein-coupled receptor-54,GPR54)引物由Invitrogen公司合成(表1)。
參照文獻[7]并經過一系列預實驗,最終確定雌二醇的濃度為 50 μg·kg-1,生理鹽水為溶劑。
1.2 動物
SPF級Sprague-Dawley(SD)未孕大鼠,雌、雄鼠各15只,體質量250~300 g(♀),300~350 g(♂),由軍事醫學科學院實驗動物中心提供,動物生產許可證號:SCXK-(軍)2007-004。恒溫(22~26℃)、恒濕(40%~70%),自由攝食飲水。

Tab.1 Primers used in reversed transcriptase PCR
1.3 交配及動物分組給藥
大鼠1∶1合籠交配,自由飲食。孕鼠單籠飼養,生產后,選用雌性仔鼠,由親母自養。雌仔鼠在出生后(postnatal day)15日齡(PND15)時予以標記編號,隨機分為溶劑對照組和雌二醇模型組。每組20只,溶劑對照組ig給予生理鹽水,模型組ig給予雌二醇溶液 50 μg·kg-1(2.5 ml·kg-1),每天 1 次,連續5 d。仔鼠在PND21時斷奶。
1.4 觀察大鼠陰門開啟時間并測定大鼠第一個發情間期及性周期穩定后第一個發情期出現的時間
給藥結束后,隨機選擇溶劑對照組及模型組幼鼠各10只。每日觀察幼鼠的陰門開啟(vaginal opening,VO)情況,上、下午各檢查一次。陰門開啟后,陰道涂片法檢查[8]大鼠第一個發情間期(first diestrus,D1)和性周期穩定后第一個發情期出現的時間(first estrus in regular estrous cycle,E1)。陰道涂片法即用生理鹽水浸濕的棉簽輕擦大鼠陰道,取出后于載玻片上涂片,片子自然風干后,HE染色,低倍光鏡下觀察其細胞形態以確定大鼠性周期各個階段,每日8:00定時檢測。
1.5 ELISA法測定血清中性激素水平
溶液對照組和模型組另外10只幼鼠,幼鼠陰門開啟后定時做陰道涂片。模型組大鼠陰門開啟當天(第一時間點)及出現第一個發情間期當天(第二時間點)眼眶靜脈叢采血約1 ml,溶劑組大鼠同時1∶1采血,血漿室溫靜置 10 min,3500 ×g 離心15 min,取上清-80℃保存。ELISA法測定上述兩個時間點雌性大鼠血清中LH,FSH,E2的水平。
1.6 性器官病理學檢查及逆轉錄PCR檢測下丘腦GnRH,Kiss-1,GPR54和垂體GnRH受體基因表達水平檢測
同1.5步驟中所用幼鼠。模型組大鼠在出現第一個發情間期的當天下午4點頸椎脫臼處死,等數量處死溶劑對照組大鼠。取子宮、卵巢、陰道,稱質量,計算子宮、卵巢和陰道系數,臟器系數=臟器質量(mg)/體質量(g)。取下丘腦、垂體,逆轉錄PCR法測定下丘腦GnRH,Kiss-1,GPR54 mRNA和垂體GnRH受體mRNA的表達。擴增片段分別為105,350,104,122和550 bp片段。提取下丘腦、垂體總 RNA,逆轉錄為 cDNA后,PCR擴增。擴增體系總體積25 μl,條件設置為:94℃預變性1 min;94℃變性 30 s,56℃退火 30 s,72℃延伸 30 s,共40個循環。擴增產物在瓊脂糖凝膠中電泳,紫外凝膠圖像分析系統攝片并對拍攝的照片進行密度掃描,以目的基因條帶積分吸光度值(integrated absorbance,IA)對內參基因β肌動蛋白積分吸光度的比值表示目的基因的相對表達水平。
1.7 統計學分析
2 結果
2.1 一般狀態觀察
在整個實驗過程中,溶劑對照和模型組大鼠均無死亡,且生長狀況良好,進食及飲水均未見異常。與溶劑對照組大鼠比較,PND 15,PND 19和PND 35時,模型組體質量無統計學差異(表2)。
Tab.2 Effect of prepubertal exposure to 17β-estradiol(E2)on body mass of female SD rats
2.2 雌二醇對雌性大鼠VO,D1和E1的影響
如表3所示,與溶劑對照組比較,模型組大鼠VO,D1和E1出現的平均日齡著提前,分別提前了14.6 d,14.5 d 和11.3 d 左右(P<0.05)。提示雌二醇可誘導雌性大鼠的青春期啟動顯著提前。
2.3 雌二醇對SD大鼠動情周期中各階段陰道細胞涂片表現的影響
陰道涂片結果顯示,模型組大鼠脫落上皮細胞的周期性變化和溶劑組大鼠一樣,出現規則的4~5 d四期性周期表現,順序依次為發情期、發情后期、發情間期、發情前期,且兩組大鼠動情周期中各階段的陰道細胞涂片表現相同:發情期陰道涂片以無核的角化上皮細胞為主,一般無白細胞(圖1A1,B1);發情后期陰道涂片可見白細胞、有核上皮細胞和角化上皮細胞,且三者比例相當(圖1A2,B2);發情間期陰道涂片以白細胞為主,細胞量較多(圖1A3,B3);發情前期陰道涂片可見大量有核上皮細胞和少量的角化上皮細胞,細胞量較多(圖1A4,B4)。
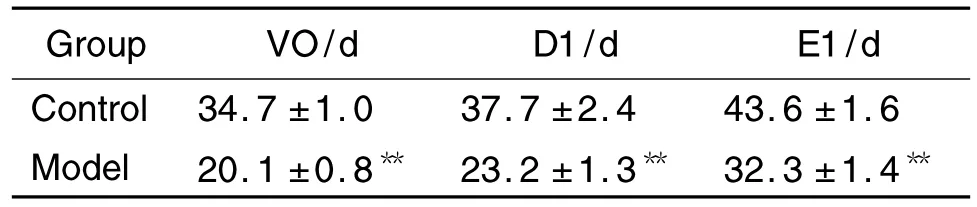
Tab.3 Effect of prepubertal exposure to E2on VO,D1 and E1 in SD rats
2.4 雌二醇對雌性大鼠子宮、卵巢和陰道指數的影響
如表4所示,與溶劑對照組比較,模型組大鼠陰道指數明顯增加,差異有統計學意義(P<0.05),而子宮和卵巢指數無顯著差異。
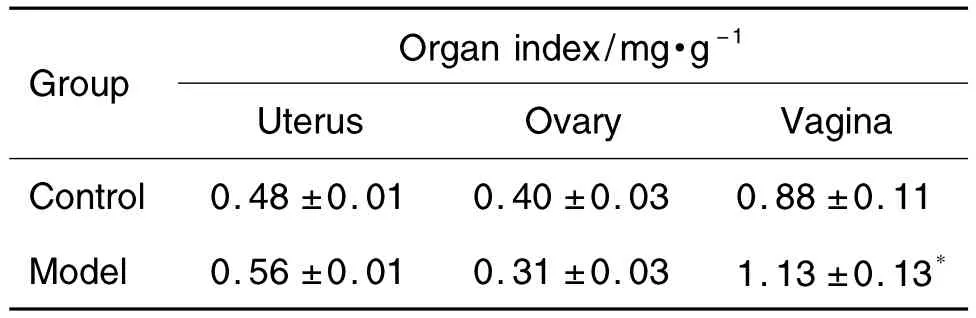
Tab.4 Effect of prepubertal exposure to E2on organ index in female rats
2.5 雌二醇對大鼠不同時間段血清LH,FSH和E2的變化
如表5所示,與溶劑對照組相比,模型組大鼠陰門開啟當天(第一時間點)血清LH和FSH的含量分別顯著增加了144%與139%(P<0.01);血清E2含量亦有增加,但無統計學差異。溶劑對照組和模型組大鼠 FSH/LH值均>1,但無統計學差異。
與溶劑對照組相比,模型組大鼠出現第一個發情間期當天(第二時間點)血清LH,FSH和E2含量分別顯著增加了176%,124%和207%(P<0.05);模型組大鼠FSH/LH值<1,與溶劑對照組比較有統計學差異(P<0.05)。

Fig.1 Effect of E2on vaginal epithelium during estrous cycle stages of female SD rats(HE ×100).A:control group(A1,estrus;A2,metestrus;A3,diestrus;A4,proestrus);B:model group(B1,estrus;B2,metestrus;B3,diestrus;B4,proestrus).
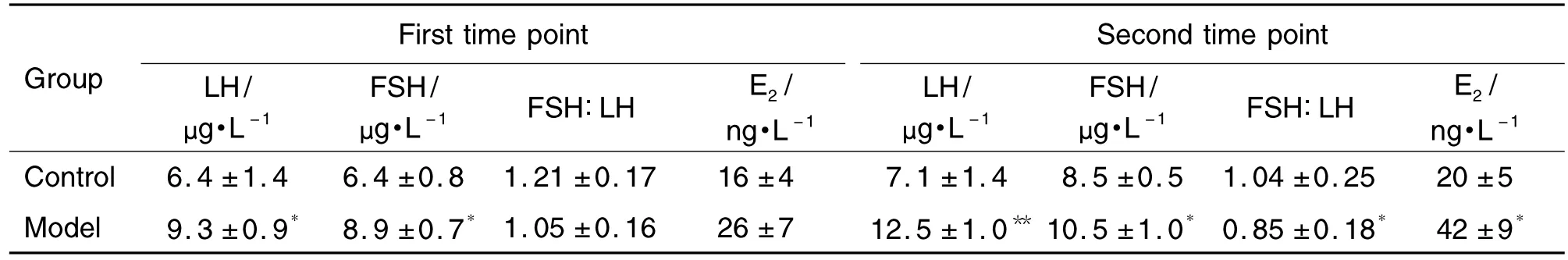
Tab.5 Effects of prepubertal exposure to E2on serum LH,FSH and E2levels in female SD rats
2.6 雌二醇對大鼠下丘腦GnRH,Kiss-1,GPR54與垂體GnRH受體mRNA表達水平的影響
逆轉錄PCR(圖2A)及其定量結果(圖2B)顯示,與溶劑對照組相比,模型組大鼠下丘腦GnRH、Kiss-1、GPR54和垂體GnRH受體mRNA表達均明顯增多(P<0.01);GnRH,Kiss-1,GPR54和GnRH受體mRNA相對表達水平分別增加了155%,130%,900%和175%(P<0.01)。
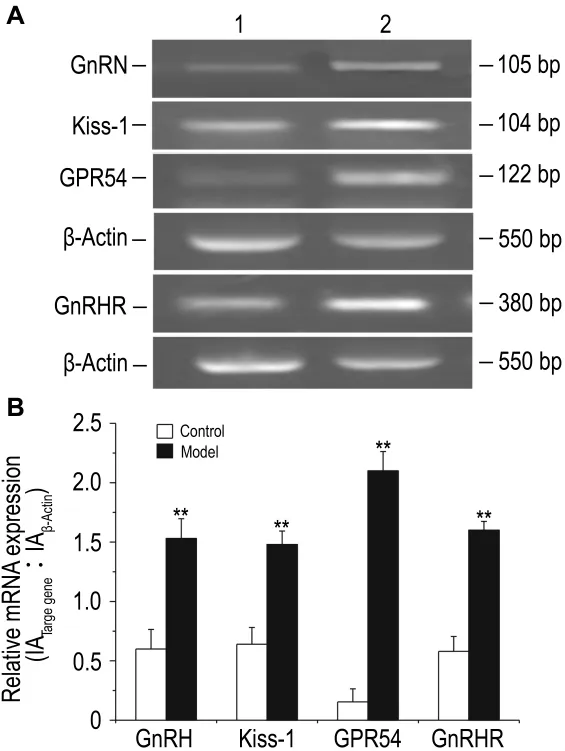
Fig.2 Effects of E2on mRNA expressions of GnRH,Kiss-1,GPR54 and GnRHR in female SD rats by reverse transcriptase PCR.See Tab.2 for rats treatment.B:quantitative analysis results of A.Lane 1:vehicle control;lane 2:model.±s,n=10.**P<0.01,compared with control group.
3 討論
陰門開啟和第一次排卵的發生是判斷雌性大鼠青春期啟動的兩個決定性標準,第一次排卵發生的間接指征為第一個發情間期的出現[6];而第一個規則性周期的出現是判斷女性青春期發育完成的終點[9],本次研究中采用E1代替第一個規則性周期的出現,提示模型組大鼠的青春期啟動提前。溶劑對照組和模型組大鼠動情周期中各階段陰道細胞涂片表現相同,動情周期的持續時間基本相同,說明給予雌二醇后,大鼠的動情周期表現與正常進入青春期組的大鼠相同。而模型組大鼠陰道指數相對升高,提示雌二醇可誘導大鼠第二性征提前出現。
臨床上對于兒童性成熟診療的基本步驟,首先是確定性激素活性是否增加[10],而激素檢測的基礎內容主要是FSH,LH和E2值。若FSH/LH>1,提示處于青春期前,反之則說明進入青春期[11-12]。本研究結果顯示,模型組大鼠LH,FSH和E2水平較溶劑對照組顯著提高,同時還觀察到溶劑對照組在血清性激素檢測的兩個時間點FSH/LH均>1,提示溶劑對照組大鼠在實驗結束時尚處于青春期前;而模型組大鼠在第二個時間點FSH/LH<1,提示在實驗結束時,模型組大鼠已出現真性性早熟。
激活GnRH釋放是促進青春期啟動的關鍵,近年研究發現,下丘腦GPR54與其配體kisspeptins(kiss-1基因編碼產物)對GnRH釋放的激活起關鍵作用[13]。研究顯示,雄性猴發育期間Kiss-1和GPR54 mRNA 含量增加[14],且 Kiss-1 和 GPR54基因敲除小鼠很難正常啟動性發育[15]。本研究發現,模型組下丘腦GnRH和垂體GnRH受體基因的表達水平明顯增多,提示雌二醇可誘導下丘腦GnRH和垂體GnRH受體mRNA合成增加;且模型組大鼠Kiss-1及GPR54 mRNA表達水平顯著增加,說明Kisspeptins/GPR54系統的激活在雌二醇誘導真性性早熟中發揮著重要的調節的作用。
綜上所述,雌二醇可通過上調幼齡雌性大鼠下丘腦Kiss-1基因的表達,誘導GnRH的合成和分泌,從而使雌性大鼠HPGA功能提前啟動,建立了良好的真性性早熟模型。
[1]Brito VN,Latronico AC,Arnhold IJ,Mendon?a BB.Update on the etiology,diagnosis and therapeutic management ofsexualprecocity[J]. Arq BrasEndocrinol Metabol,2008,52(1):18-31.
[2]Tian Z,Zhao H,Sun Y,Cai D,Chen B.Evaluation of the true precocious puberty rats induced by neonatal administration of danazol:therapeutic effects of nourishing ″Yin″-removing ″Fire″Chinese herb mixture[J].Reprod Biol Endocrinol,2005,3:38.
[3]Massart F,Saggese G.Oestrogenic mycotoxin exposures and precocious pubertal development[J].Int J Androl,2010,33(2):369-376.
[4]Sun Y,Tian Z,Zhao H,Wong ST,Chen B.Characteristic of hypothalamic kisspeptin expression in the pubertal development of precocious female rats[J].Neurosci Lett,2007,420(1):12-17.
[5]Pan J,Li HL,Zheng YN.Experimental study of true precocious puberty model in female rats[J].Chin J Endocrinol Metab(中華內分泌代謝雜志),2004,20(1):84-85.
[6]Roth C,Leonhardt S,Theiling K,Lakomek M,Jarry H,Wuttke W.Ontogeny of the GNRH-,glutaminase-and glu-tamate decarboxylase-gene expression in the hypothalamus of female rats[J].Brain Res Dev Brain Res,1998,110(1):105-114.
[7]Suzuki S,Handa RJ.Regulation of estrogen receptor-beta expression in the female rat hypothalamus:differential effects of dexamethasone and estradiol[J].Endocrinology,2004,145(8):3658-3670.
[8]Matagne V, Rasier G, Lebrethon MC, Gérard A,Bourguignon JP.Estradiol stimulation of pulsatile gonadotropin-releasing hormone secretion in vitro:correlation with perinatal exposure to sex steroids and induction of sexual precocity in vivo[J].Endocrinology,2004,145(6):2775-2783.
[9]Ojeda SR,Skinner MK.Puberty in the rat[M]∥Knobil E,Neil JD.The Physiology of Reproduction.2nd ed.New York:Raven Press,1994:2006,2061-2126.
[10]Wacharasindhu S, Srivuthana S, Aroonparkmongkol S,Shotelersuk V.A cost-benefit of GnRH stimulation test in diagnosis of central precocious puberty(CPP)[J].J Med Assoc Thai,2000,83(9):1105-1111.
[11]Partsch CJ,Sippell WG.Pathogenesis and epidemiology of precocious puberty.Effects of exogenous oestrogens[J].Hum Reprod Update,2001,7(3):292-302.
[12]Castellano JM,Bentsen AH,Sánchez-Garrido MA,Ruiz-Pino F,Romero M,Garcia-Galiano D,et al.Early metabolic programming of puberty onset:impact of changes in postnatal feeding and rearing conditions on the timing of puberty and development of the hypothalamic kisspeptin system[J].Endocrinology,2011,152(9):3396-3408.
[13]Tena-Sempere M.The roles of kisspeptins and G proteincoupled receptor-54 in pubertal development[J].Curr Opin Pediatr,2006,18(4):442-447.
[14]Shahab M,Mastronardi C,Seminara SB,Crowley WF,Ojeda SR,Plant TM.Increased hypothalamic GPR54 signaling:a potential mechanism for initiation of puberty in primates[J].Proc Natl Acad Sci USA,2005,102(6):2129-2134.
[15]Lapatto R,Pallais JC,Zhang D,Chan YM,Mahan A,Cerrato F,et al.Kiss1-/-mice exhibit more variable hypogonadism than Gpr54-/-mice[J].Endocrinology,2007,148(10):4927-4936.

