溫鹽變化對北極海冰細菌質膜的影響研究
竇京嬌,王 燕,孫 岳,林學政,姜 偉*
(1.山東輕工業學院 食品與生物工程學院,山東 濟南 250353;2. 國家海洋局 第一海洋研究所,山東 青島 266061;3. 國家海洋局 海洋生物活性物質重點實驗室,山東 青島 266061;4. 國家海洋局 海洋咨詢中心,北京 100860)
北極地區具有獨特的地理及氣候特征,除部分地區在短暫的夏季有冰雪融化外,其余均常年被冰雪覆蓋,且環境溫度在0~-50 ℃[1]。海冰是個半固體矩陣,冰晶間彌漫著大小不等、充滿鹵水的孔、道網絡,在海冰內部形成了一個溫度、鹽度以及營養鹽濃度急劇變化地封閉或半封閉的微生境[2]。在海冰融化過程中,局部鹽度急劇降低(<10),相反在海水結冰的過程中,由于鹽分被排斥在冰晶之外,形成鹽囊和鹽通道,造成其中的鹽度急劇上升(>150)。因此,海冰微生物不僅要經受溫度的季節性變化,還要經受鹽度的季節性變化[3-4]。盡管海冰環境特征具有強烈的負效應,但生存于海冰中的微生物在長期的進化過程中形成了一系列適應該生境所需的復雜的生理和新陳代謝特征,形成了獨特的適應機制。
對細胞的生存和生長來說,有功能的細胞膜是必不可少的。溫度降低對膜產生的影響首先表現為膜流動性的降低,并最終喪失功能,因此,保持低溫下膜的流動性是微生物耐冷機理中的重要方面,而脂肪酸的種類和組成是細胞維持膜流動性的決定性因素[5]。嗜冷菌可能具有在非常低的溫度下就可以發生相變的膜脂。許多微生物通過改變細胞膜的脂肪酸組成來保持其在低溫時的流動性。最常見的反應是通過增加去飽和酶的活力提高脂雙層中不飽和脂肪酸的質量分數;另一反應是縮短脂肪酸酰基鏈的長度、增加支鏈脂肪酸的比例或降低環狀脂肪酸的比例[6]。鹽度升高細菌受高滲透壓的影響,將破壞細菌的細胞膜,從而影響細菌的生理活動。在高鹽環境條件下,細胞為了維持正常的細胞形態和正常的生理功能必然會調動機體的生理生化反應,以便加強細胞膜的完整性和流動性。程書梅等[7]研究發現在高鹽沖擊條件下,耐鹽突變株細胞膜的穩定性明顯高于親株,由此推斷維持細胞膜的穩定性也是菌株抵御高鹽沖擊的一個重要原因。
我們通過分析溫、鹽變化對北極海冰細菌脂肪酸組成及質膜流動性的影響,將有助于人們對其低溫和高鹽適應方式有進一步的認識,以期為北極海冰細菌的環境適應機制提供科學依據,同時也為開發利用北極海冰細菌中的不飽和脂肪酸提供理論基礎。
1 材料和方法
1.1 菌株
菌株a24-4,R03-1和R03-8取自中國第4次北極科學考察所采集的海冰樣品,采用Zobell 2216E培養基篩選分離獲得,16S rDNA鑒定結果表明3株菌均屬于假交替單胞菌屬(Pseudoalteromonassp.),為革蘭氏陰性菌。
1.2 主要儀器、試劑和培養基
氣相色譜-質譜聯用儀(7890A GC; 5975C MSD)、F-4500熒光分光光度計(日本島津)、低溫振蕩培養箱(HZQ-F100)、脂肪酸甲酯混合標準品(Sigma公司)、1,6-二苯基-1,3,5-己三烯(DPH)(Sigma公司);甲醇、正己烷為色譜純;其余試劑均為分析純。
所使用培養基于1×105Pa下濕熱滅菌20 min,不同鹽度培養基的成分見表1。海水取自山東青島海域,鹽度約為30。

表1 培養基成分Table 1 Components of culture media
1.3 不同培養條件下菌株的培養
1)對照組:按2%接種量把菌株接種于鹽度為30培養基中,10 ℃, 150 r/min振蕩培養72 h;
2)低溫培養:按2%接種量將菌株接種于鹽度為30的培養基中,0 ℃, 150 r/min低溫培養箱振蕩培養144 h;
3)低溫脅迫:按對照組方法培養菌株24 h后移至0 ℃,150 r/min低溫振蕩培養48 h;
4)高鹽培養:按2%接種量將菌株接種于鹽度為90的培養基中,10 ℃,150 r/min振蕩培養72 h;
5)高鹽脅迫:按對照組方法培養菌株24 h,菌體離心濃縮加入鹽度為90的培養基中繼續培養48 h。
1.4 細胞膜流動性測定
1)取一定量的菌懸液,4 000 r/min離心5 min;2)收集菌體,用PBS洗滌2次,并重懸于PBS緩沖液中,調整其數量約為108個/ mL;3)取2 mL菌液,加入4 mL濃度為2×10-6mol/ L的DPH,30 ℃溫育30 min,即得到DPH標記的細胞膜。用帶有偏振裝置的熒光分光光度計測定并計算熒光偏振度[8]。檢測條件:溫度25 ℃,激發波長Ex=362 nm, 發射波長Em=432 nm,激發狹縫10 nm,發射狹縫10 nm。
熒光偏振度
(1)
(2)
式中IVV為起偏器和檢偏器光軸同為垂直方向時測得的熒光強度;IVH為起偏器和檢偏器光軸分別為垂直和水平方向時測得的熒光強度;G為光柵校正因子;IHV為起偏器和檢偏器光軸分別為水平和垂直方向時測得的熒光強度;IHH為起偏器和檢偏器光軸同為水平方向時測得的熒光強度。
1.5 細菌細胞膜脂肪酸組成的分析
細胞膜脂肪酸樣品處理:1)將培養好菌體置于-80 ℃冷凍干燥,然后置于10 mL螺口試管中,加入5 mL 0.4 mol / L 的KOH-CH3OH溶液,60 ℃下皂化1 h。2)冷卻后加入4 mL體積比為1∶9的HCl-CH3OH,60 ℃水浴20 min,冷卻。3)加入2 mL 3%NaCl溶液,用1 mL色譜純正己烷萃取甲酯化的脂肪酸[9],萃取樣品利用GC-MS聯用儀進行檢測。
色譜條件:DB-5MS毛細管柱(30 m×250 μm×0.25 μm膜厚,Agilent),載氣為高純氦氣(99.999%),流速1.0 mL / min,進樣器溫度280 ℃,柱溫280 ℃,檢測溫度260 ℃,進樣量1.0 μL。
質譜條件:電離方式EI,電子能量 70 eV, 離子源溫度 230 ℃, 四極桿溫度150 ℃。
定量分析:采取面積歸一化法分析各脂肪酸組分的質量分數。
1.6 數據處理與統計分析
通過SPSS(Version 19.0,SPSS Inc.)軟件處理數據。
2 結果與分析
2.1 溫度和鹽度對菌株生長的影響
將分離自海冰樣品的3株菌a24-4,R03-1和R03-8分別于不同溫度(0,5,10,15,20和25 ℃)和不同鹽度(0,30,60和90)條件下培養,觀察溫度和鹽度對菌株生長的影響,結果如圖1(圖中OD值為實測值×稀釋倍數)。由圖1可知,當培養基鹽度為0,溫度為0~20 ℃時菌體均不生長。而當培養溫度為25 ℃時,菌株有生長現象,OD值約1.0,在鹽度為0時3株菌出現了不同的生長情況,推測可能由于菌株a24-4與R03-1、R03-8對鹽度的需求不盡相同造成的。培養基鹽度為30,60和90時,菌體均在培養溫度為10 ℃達到最大生長量;在培養溫度為0,5和10 ℃時,培養基鹽度為30時,菌體OD值最大,而溫度為15,20和25 ℃時,菌株在鹽度為60時OD值最大。與a24-4生長情況不同,R03-1和R03-8在鹽度為0時各個培養溫度下均不生長,但均在培養溫度為10 ℃,培養基鹽度為30時達到最大量。因此3株菌均為嗜冷耐鹽菌,最適生長溫度和鹽度分別為10 ℃和30。
2.2 溫度對細胞膜流動性和脂肪酸組成的影響
2.2.1 溫度對細胞膜流動性的影響
溫度對細胞膜流動性的影響結果如表2所示。溫度影響細胞膜的流動性,溫度越高,分子的能量越大,分子運動速度加快,膜脂的活動性就越大,熒光探針易于進入類脂雙層而標記上。如果膜脂質烴鏈活動性很大,則DPH分子從吸收到發射隨磷脂分子的活動而有不同程度的傾斜或轉動,以致發射的熒光偏振度減少,即膜脂流動性增大;反之,如果脂質烴鏈活動性小,則DPH分子從吸收到發射在磷脂分子中排列整齊,發射的熒光偏振度值大,則膜脂的流動性小,熒光偏振度與膜流動性成反比。由表2知,菌株a24-4在低溫脅迫和低溫培養時細胞膜的熒光偏振度分別從0.253升高到0.258和0.265,與對照組相比差異不顯著(P>0.05);與此相同,菌株R03-8和R03-1在低溫下和低溫脅迫時熒光偏振度與對照組相比變化也不大(P>0.05),表明低溫下細胞質膜維持著正常的流動性。這與JAGANNADHAM等研究發現南極細菌Sphingobacteriumantarcticus生長在5 ℃環境下與生長在25 ℃環境下的膜流動性基本相同[10]的結果一致。
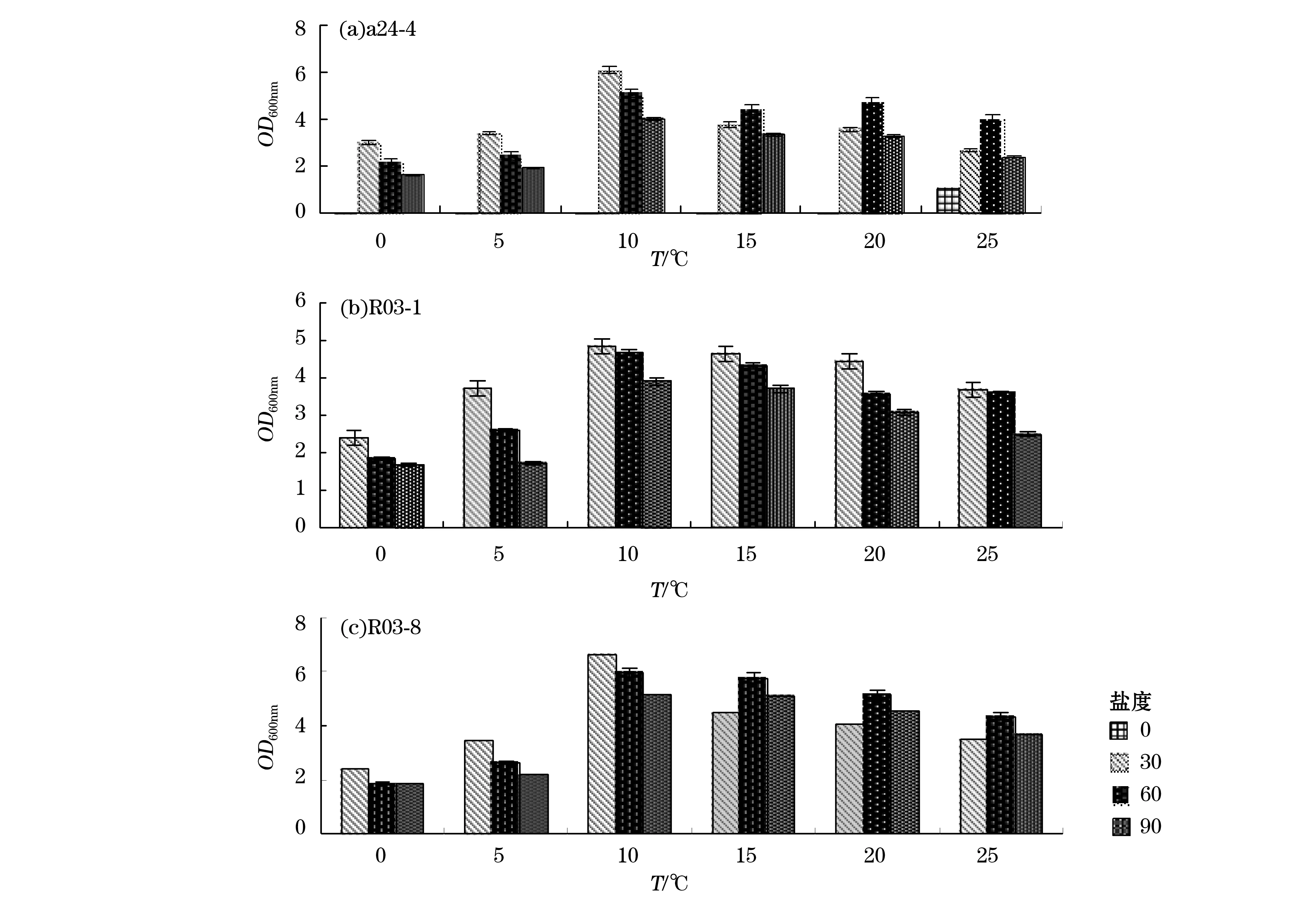
圖1 不同溫度和鹽度對菌株生長的影響Fig.1 Effect of different temperature and salinity on the growth of strains
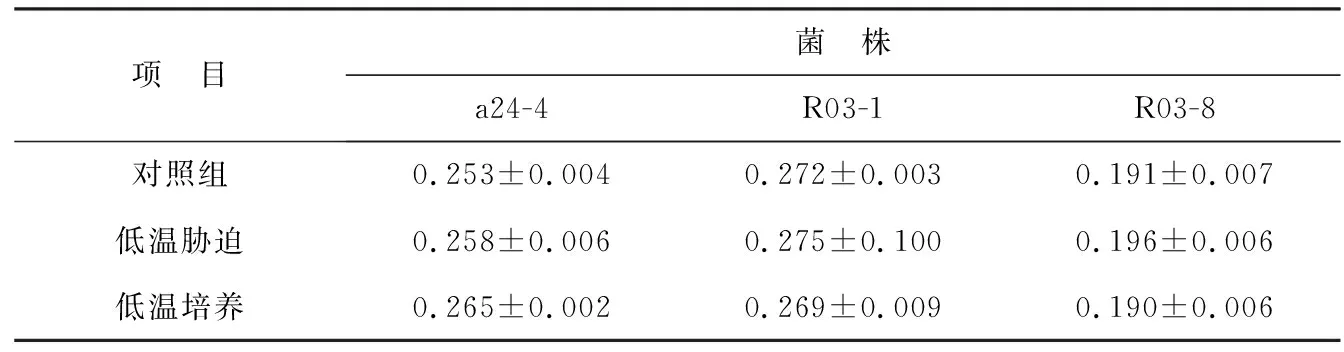
表2 溫度對細菌細胞膜熒光偏振度(P)的影響Table 2 Effect of temperature on the fluorescence polarization(P) of bacteria cell memrane
2.2.2 溫度對脂肪酸組成的影響
由表3可知,3株菌均能夠合成多種脂肪酸,包括直鏈飽和脂肪酸(C16∶0,C18∶0)和其他一些低熔點脂肪酸,如單不飽和脂肪酸(C16∶1,C18∶1)、支鏈脂肪酸(14-Me, C15∶0;15-Me, C16∶0)和環甲基脂肪酸(順-9,10環甲基十七烷酸、順-9,10-甲基十九烷酸)。與對照組相比,低溫脅迫和低溫培養時3株菌質膜脂肪酸組成和質量分數均發生了變化:1)3株菌質膜總單不飽和脂肪酸(UFAs)質量分數均明顯升高,在單不飽和脂肪酸中,C15∶1和C17∶1質量分數表現為降低,C16∶1和C18∶1質量分數升高,以C16∶1質量分數的變化最為顯著,對照組膜脂肪酸組成中C16∶1質量分數達到40%左右,而低溫培養時其質量分數可達60%以上;2)3株菌株在低溫脅迫和低溫培養時支鏈脂肪酸(BCFAs)質量分數均明顯升高,會出現甲基分支和甲基異構分支現象,如15-Me, C16∶1、14-Me, C16∶0,同時還會產生環甲基分支結構,如Cis-9,10-Me, C16∶0和Cis-9,10-Me, C18∶0。由此可見,3株菌通過調節細胞膜脂肪酸不飽和度和支鏈化程度來適應低溫環境;由各單不飽和脂肪酸的變化趨勢可知C16∶1可能對維持細胞膜流動性起著關鍵作用,而C15∶1和C17∶1兩種脂肪酸對菌株的低溫生長是非必需的。綜上所述,在冷適應條件下,3株菌均通過調節細胞膜脂肪酸不飽和度和支鏈化程度來降低熔點,進而增強菌株對冷的耐受力。
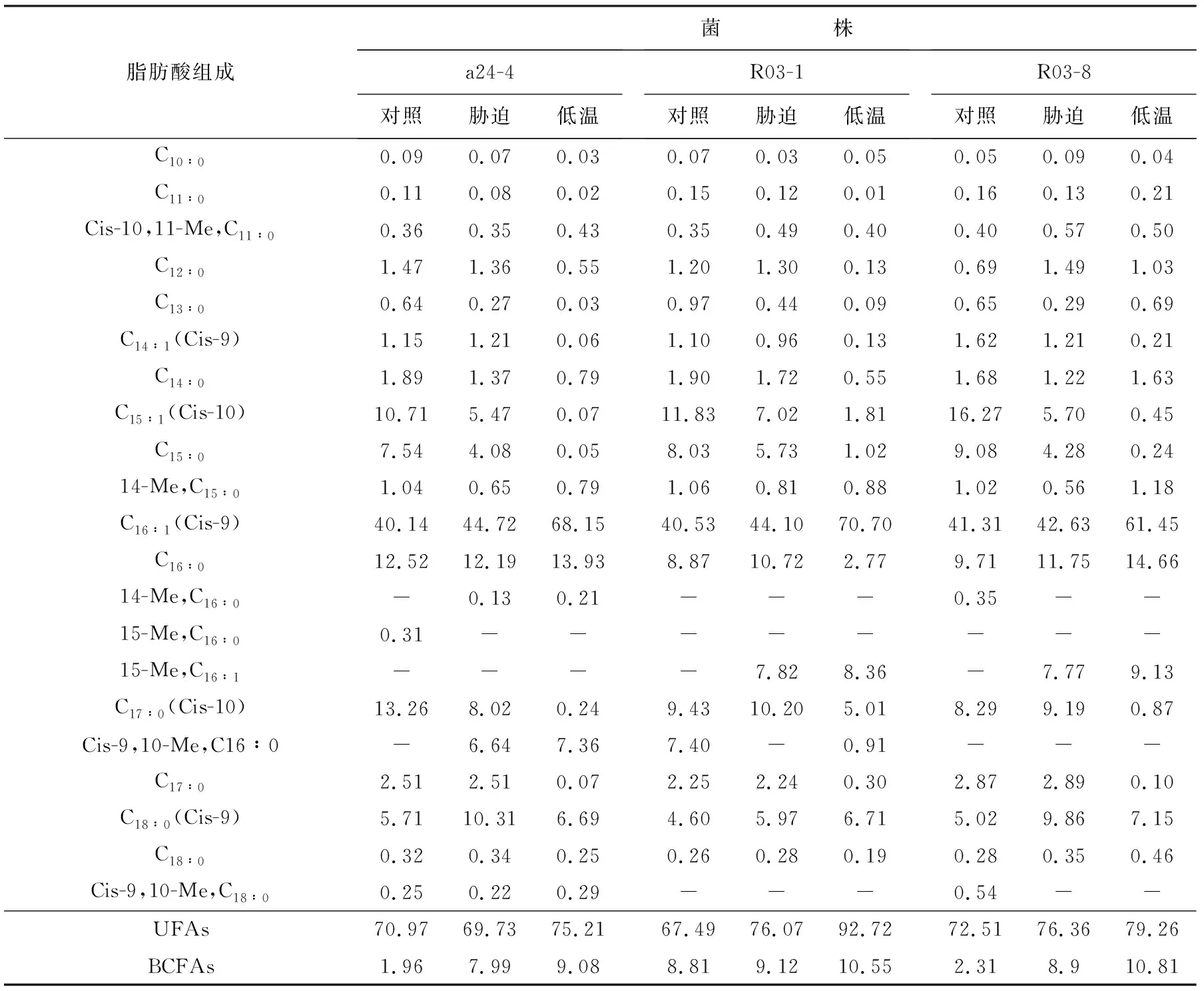
表3 溫度對脂肪酸組成影響(質量分數/%)Table 3 Effect of temperature on the fatty acid composition(mass fraction/%)
注:“-”代表未發現
2.3 鹽度對細胞膜流動性和脂肪酸組成的影響
2.3.1 鹽度對細胞膜流動性的影響
由表4知,3株菌在高鹽脅迫和高鹽環境下生長時,熒光偏振度增大,細胞膜流動性均有所降低,但無顯著性變化(P>0.05)。可能由于菌株本身為耐鹽菌,在高鹽條件下為適應環境,其可通過調節細胞膜組分維持一定的細胞膜流動性,來抵御高鹽沖擊。
表4鹽度對細菌細胞膜熒光偏振度(P)的影響
Table 4 Effect of salinity on the fluorescence polarization(P) of bacteria cell membrane
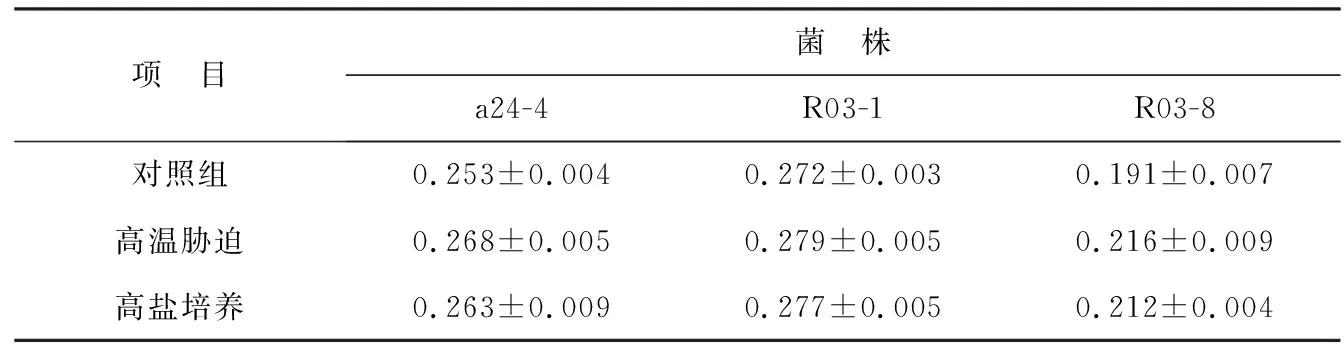
項 目菌 株a24-4R03-1R03-8對照組0.253±0.0040.272±0.0030.191±0.007高溫脅迫0.268±0.0050.279±0.0050.216±0.009高鹽培養0.263±0.0090.277±0.0050.212±0.004
2.3.2 鹽度對脂肪酸組成的影響
由表5知,高鹽培養時3株菌支鏈脂肪酸比例均顯著升高。因此,在對高鹽的適應過程中,支鏈脂肪酸的增加起重要作用:高鹽條件下,此3株菌通過調節細胞膜中支鏈脂肪酸的組成來維持細胞膜流動性,進而抵御高鹽沖擊,減少高鹽對質膜的損傷。從不飽和脂肪酸組成來看,3株菌的變化趨勢不盡相同,而 C16∶1在3株菌中質量分數均顯著升高,由此推測,C16∶1可能在高鹽環境下也是維持細胞正常生長的一個關鍵因素。
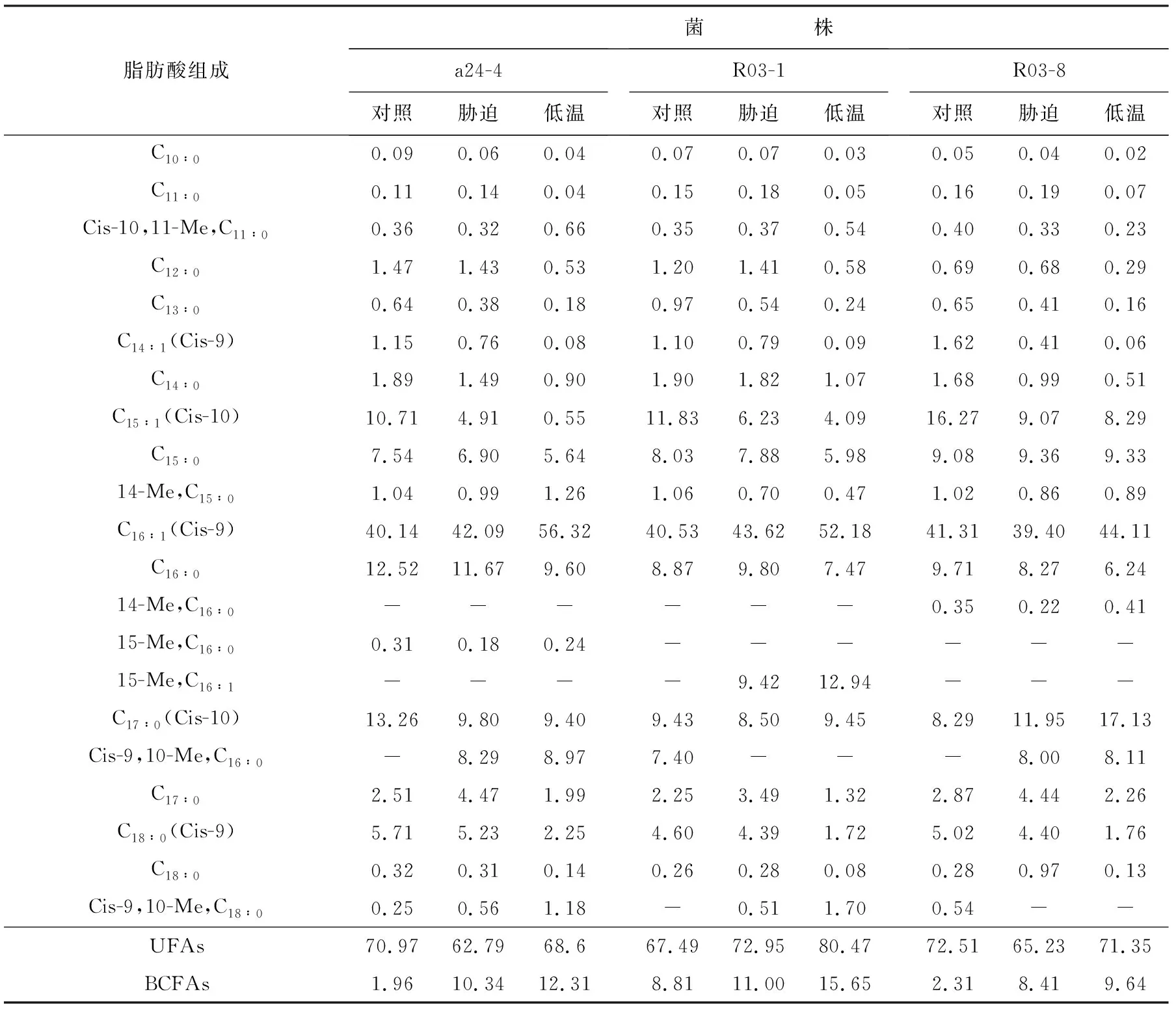
表5 鹽度對脂肪酸組成影響(質量分數/%)Table 5 Effect of salinity on fatty acid composition(mass fraction/%)
注:“-”代表未發現
3 討 論
極地生態系統的獨特性為研究惡劣條件下微生物的適應機制提供了極好的資源。細菌Pseudoalteromonassp.a24-4,Pseudoalteromonassp.R03-1和Pseudoalteromonassp.R03-8分離自北極海冰樣品。低溫下3株菌質膜均能維持正常流動性,膜不飽和脂肪酸和支鏈脂肪酸質量分數增加,說明菌株在低溫環境下通過調整質膜脂肪酸不飽和度和支鏈化程度來增加膜的流動性,增強菌株對冷的耐受力。這與Sofia等[11],Fernandez等[12],Wang等[13]和Chiar等[14]的研究結果一致。
低溫可以減慢大多數的生理進程,降低膜的流動性,會導致細菌細胞質膜上脂肪酸鏈更緊密的排列,使脂雙層凝膠化,從而限制了分子的運動,影響膜的功能。因此,維持最佳的膜流動性就成為微生物在低溫下生存的關鍵,而脂肪酸的種類和組成是細胞維持膜流動性的決定性因素。
對南極細菌外的其它冷適應性細菌的研究初步揭示了這些微生物為維持細胞質膜正常的流動性而采取的幾種策略。首先,通過冷誘導去飽和,使飽和脂肪酸轉變成不飽和脂肪酸的策略是非常普遍的,并且不飽和脂肪酸對膜的流動性影響顯著;其次,通過降低脂肪酸鏈的長度和合成支鏈脂肪酸來保持膜最佳流動性[15]。低溫下,質膜中脂肪酸的代謝發生了顯著變化,包括雙鍵的引入、脂肪酸鏈長度的降低和改變組成成分等,從而降低了膜的相變溫度,保持在低溫條件下的生物學功能[16]。李博等[17]研究發現,低溫下革蘭氏陽性菌主要利用分支脂肪酸來調整膜的流動性;而革蘭氏陰性菌則呈現較為多樣的適冷機制,10%以下革蘭氏陰性細菌以支鏈飽和脂肪酸為主要膜脂調整方式,絕大多數陰性菌以不飽和直鏈或不飽和支鏈脂肪酸為主要形式存在,即主要以不飽和鍵的形式來調整膜脂在低溫環境下的流動性。
在高鹽環境下,細胞通過細胞膜的被動應答和細胞內的主動調控,相應調整細胞膜的物理特性,進而抵御其對細胞造成的傷害。本研究表明:菌體通過調節質膜中支鏈脂肪酸的組成來增加對高鹽的抗性,顯示菌體通過這種積極的反應保護細胞,從而維持質膜的正常流動性。
目前關于鹽度對脂肪酸組成的研究報道很少,僅發現Xu等[18]對Dunaliellasp.高鹽適應性的研究報道,文中指出總飽和脂肪酸和單不飽和脂肪酸的質量分數隨著鹽度的增加而升高,多不飽和脂肪酸的質量分數隨著鹽度的升高而降低,本實驗結果與此不太一致,僅R03-1質膜總不飽和脂肪酸質量分數隨鹽度升高而升高,而a24-4和R03-8質量分數卻略有降低。但是C16∶1質量分數表現出明顯增加的趨勢,這與低溫培養時,3株菌中C16∶1質量分數也明顯增高結果一致。由此推測,C16∶1可能是北極海冰細菌環境適應過程中質膜脂肪酸組成中的必需脂肪酸,但有關C16∶1在適應極端環境中的地位及其作用機制還需進一步探討。
總之,在低溫和高鹽環境條件下,北極海冰細菌通過脂肪酸組成的變化保護膜正常流動,從而維持細胞正常功能,這是北極海冰細菌適應極端環境的一種機制。
參考文獻(References):
[1] LIN X Z, BIAN J, HE P Q. Molecular mechanism of cold-adaptation of polar microorganisms [J]. Chinese Journal of Polar Science, 2003, 15(1): 75-82. 林學政,邊際,何培青.極地微生物低溫適應性的分子機制 [J].極地研究, 2003, 15(1): 75-82.
[2] THOMAS D N, DIECKMANN G S. Antarctic sea ice-a habitat for extremophlies [J]. Science, 2002, 295 (25): 641-644.
[3] BROWN M V, BROWN J P. A molecular paylogenetic survey of sea-ice microbial communities (SIMCO) [J]. FEMS Microbiology Ecology, 2001, 35: 267-275.
[4] EDWARD F, DELONG. Marine microbial diversity: the tip of the iceberg [J]. Marine Biotechnology, 1997, 15: 203-207.
[5] HUNGER K, BECKERING C L, MARAHIEL M A. Genetic evidence for the temperature-sensing ability of the membrane domain of theBacillussubtilishistidine kinase DesK [J]. FEMS Microbiology Letters, 2004, 230(1): 41-50.
[6] ZHU G B, LU H J. The principle and technology of food flavor [M]. Beijing: Peking University Press, 1996. 朱國斌,魯紅軍.食品風味原理與技術[M].北京:北京大學出版社, 1996.
[7] CHENG S M, CHEN B J, GU J L, et al. Fluorescence polarization techniques for the determination of complete cell membrane flui-dity ofSaccharomycesCerevisiae[J]. Journal of Agricultural University of Hebei, 2005, 28(6): 95-97. 程書梅,陳寶江,顧金蘭,等.應用熒光偏振法測定釀酒酵母完整細胞膜的流動性 [J].河北農業大學學報, 2005, 28(6): 95-97.
[8] FURUSAWA M, TSUCHIYA H, NAYAYAMA M, et al. Cell growth inhibition by membrane-active components in brownish scale of onion [J]. Journal of Health Science, 2006, 52(5): 578-584.
[9] MYRON S. Bacterial identification by gas chromatographic analysis of fatty acids methyl esters (GC-FAME) [M].Newark, DE, USA: MIDI Inc., 2001.
[10] JAGANNADHAM M V, CHATTOPADHYAY M K, SUBBALAKSHMI C, et al. Carotenoids of an Antarctic psychrotolerant bacterium, Sphingobacterium antarcticus, and a mesophilic bacterium, Sphingobacterium multivorum[J]. Archives of Microbiology, 2000, 173(5): 418-424.
[11] SOFIA K M, ANTIS N. Cold dependence of fatty acid profile of different lipid structures of listeria monocytogenes [J]. Food Microbiology, 2005, 22(2-3): 213-219.
[12] FERNANDEZ MURGA M L, CABRERA G M, FONT DE VALDEZ G, et al. Influence of growth temperature on cryotolerance and lipid composition of lactobacillus acidophilus [J]. Journal of Applied Microbiology, 2000, 88(2): 342-348.
[13] WANG Y, JEROME D. Influence of cooling temperature and duration on cold adaptation of Lactobacillus acidophilus RD 758 [J]. Cryobiology, 2005, 50(3): 294-307.
[14] CHIAR A M, SYLVAIN L, SADO K, et al. Synthesis of cyclopropane fatty acids in Lactobacillus helveticus and Lactobacillus sanfranciscensis and their cellular fatty acids changes following short term acid and cold stresses [J]. Food Microbiology, 2010, 27(4): 493-502.
[15] KLEIN W, WEBER M H W, MARABICL M A. Cold shoek response of Bzeillus subtilis: isoleucine-dependent switch in the fatty acid branching pattem for membrane adaptation to low temperatures [J]. J. Bacteriol., 1999, 181: 5341-5349.
[16] THOMPOSON G A. Membrane acclimation by unicellular organisms in response to temperature change [J]. Bioenergetice Biomembmnes , 1989, 21: 43-60.
[17] LI B, MATTHIAS D, HE B F, et al. Isolation and classification of cold-adapted microorganisms and pattern of membrane fatty acids in cold-adaptation [J]. Microbiology China, 2010, 38(8): 1110-1116. 李博,MATTHIAS D,何冰芳,等.內陸土壤冷適應細菌的篩選分類與細胞膜脂肪酸的適冷機制[J]. 微生物學通報, 2010, 38(8): 1110-1116.
[18] XU X Q, BEARDALL J. Effect of salinity on fatty acid composition of a green microalga from an Antarctic Hypersaline Lake [J].phytoehemistry, 1997, 45(4): 655-658.

