響應面法優化南極菌Psychrobacter sp.B-3的發酵產糖條件
張 曲,宋益民,李 江
(1.青島科技大學 化工學院,青島 山東 266042;2.國家海洋局 第一海洋研究所,青島 山東 266061)
微生物在當今被普遍認為是一些生物活性物質和新化合物的高效生產者[1]。而生存于極地的微生物由于氣候極其苛刻、惡劣,這也意味著來自于極地微生物的生物活性物質對于人類可能具有特殊的意義[2]。極地微生物(海冰微藻和細菌)分泌產生大量的胞外多糖(EPSs),這些物質聚集在冰藻和細菌生存的海冰通道中,提供了海冰和冰水界面的有機碳,是能源傳輸的主要物質[3]。除了其生態學上的作用,國內外學者開始關注胞外多糖的生物學活性,在前期的研究工作中,從南極嗜冷桿菌Psychrobactersp. B-3的發酵液中分離獲得的胞外糖能夠顯著地誘導植物體內多種抗氧化酶的活性,以清除植物在受到傷病侵害時大量積累的活性氧,從而有效地防治設施蔬菜的病害。單獨施用EPS-B3對黃瓜白粉病和枯萎病的防治率分別達到42.99%和83.09%,因而具有廣闊的開發潛力[4]。但微生物EPSs產量低而不穩定限制了其開發應用,因此如何提高EPSs的產量顯得尤為重要。
響應面法是先利用合理的試驗設計并通過實驗得到的一定數據,采用多元二次回歸方程來擬合因素與響應值之間的函數關系,通過對回歸方程的分析來尋求最優工藝參數,解決多變量問題的一種統計方法[5]。本研究以南極菌Psychrobactersp.B-3菌株為研究對象,通過單因子實驗,Plackett-Burman設計,Box-Behnken實驗設計及響應面分析法等統計學方法,高效地實現了南極菌Psychrobactersp.B-3產胞外多糖的優化,為該胞外多糖以后的應用研究奠定了基礎。
1 材料和方法
1.1 材 料
1.1.1 菌 種
南極菌B-3源自中國第24次南極科學考察烏拉圭站(62°11′50.52″S,58°55′50.4″W)采集的海冰樣品,采用佐貝爾2216培養基篩選、分離獲得,經16S rDNA鑒定為Psychrobacter屬。
1.1.2 培養基
液體種子培養基:蛋白胨5 g/L,酵母粉1 g/L,陳海水:自來水為2:1,即2216E培養基。
初始液體發酵培養基:蛋白胨5 g/L,酵母粉1 g/L,陳海水:自來水為2:1,MgCl20.02 g/L。
發酵培養的初始溫度為10 ℃, pH為7,搖床轉速為150 r/min,發酵時間為72 h。
1.2 方 法
1.2.1 苯酚-硫酸法總糖標準曲線的制備
葡萄糖標準溶液的制備:準確稱取無水葡萄糖10 mg,加入100 mL容量瓶中,定容至刻度,濃度為100 μg/mL。利用苯酚-硫酸法測出葡萄糖的標準曲線[6]。
1.2.2 單因素篩選
分別以溫度、pH、碳源、氮源、金屬離子及海水配比作為參數進行單因素優化實驗,考察其對產糖量的影響。為確定各種環境因素對南極菌Psychrobactersp.B-3發酵產糖量的影響水平,通過選擇最佳的碳源,氮源及金屬離子來進行下一步的響應面優化實驗。
1.3 Plackett-Burman實驗設計及分析
根據前期單因素實驗及其它可能影響產糖的因素,選擇了10個因素:蛋白胨(X1),酵母粉(X2),海水配比(X3),pH(X4),溫度(X5),搖床轉速(X6),接種量(X7),裝液量(X8),培養時間(X9),BaCl2(X10),來進行12次實驗(N=12),用Plackett-Burman軟件進行實驗設計,實驗中每個因素分別設高(1),低(-1)兩個水平。以發酵液中的產糖量為響應值,通過SAS軟件對實驗結果進行回歸顯著性水平,選擇可信度高的顯著因素進一步開展響應面顯著性分析,根據結果對其進行顯著性分析。實驗中每個因素根據單因素實驗結果設定2個水平。
1.4 Box-Behnken設計及響應面分析
根據Plackett-Burman實驗確定的影響產糖的顯著因素,采用響應面軟件對其進行Box-Behnken響應面設計,以發酵液中的產糖量為響應值,通過SAS軟件對實驗結果進行回歸分析,從而獲得南極菌B-3發酵產糖的最佳條件。
2 結果與分析
2.1 葡萄糖標準曲線
以葡萄糖為標準品,根據標準曲線繪制方法進行標準曲線繪制,對測定數據用最小二乘法進行線性擬合,得到回歸方程為y=0.002 3x-0.004 8(R2=0.991 3)。
2.2 單因子實驗篩選結果
我們分別考察了溫度、pH、碳源、氮源、金屬離子及海水配比對產糖量的影響(圖1~6)。結果表明,最佳碳源為酵母粉,最佳氮源為蛋白胨,最佳金屬離子為BaCl2,陳海水與自來水配比為2:1,溫度10 ℃,pH為7。
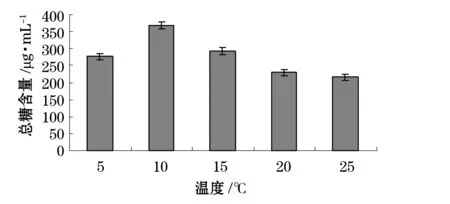
圖1 不同溫度對產糖的影響Fig.1 Effect of various temperatures on EPS production
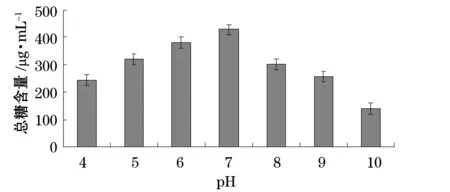
圖2 不同pH對產糖的影響Fig. 2 Effect of various pH on EPS production
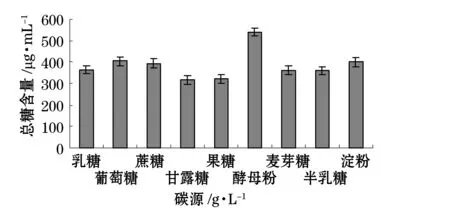
圖3 不同碳源對產糖的影響Fig.3 Effect of various carbon sources on EPS production
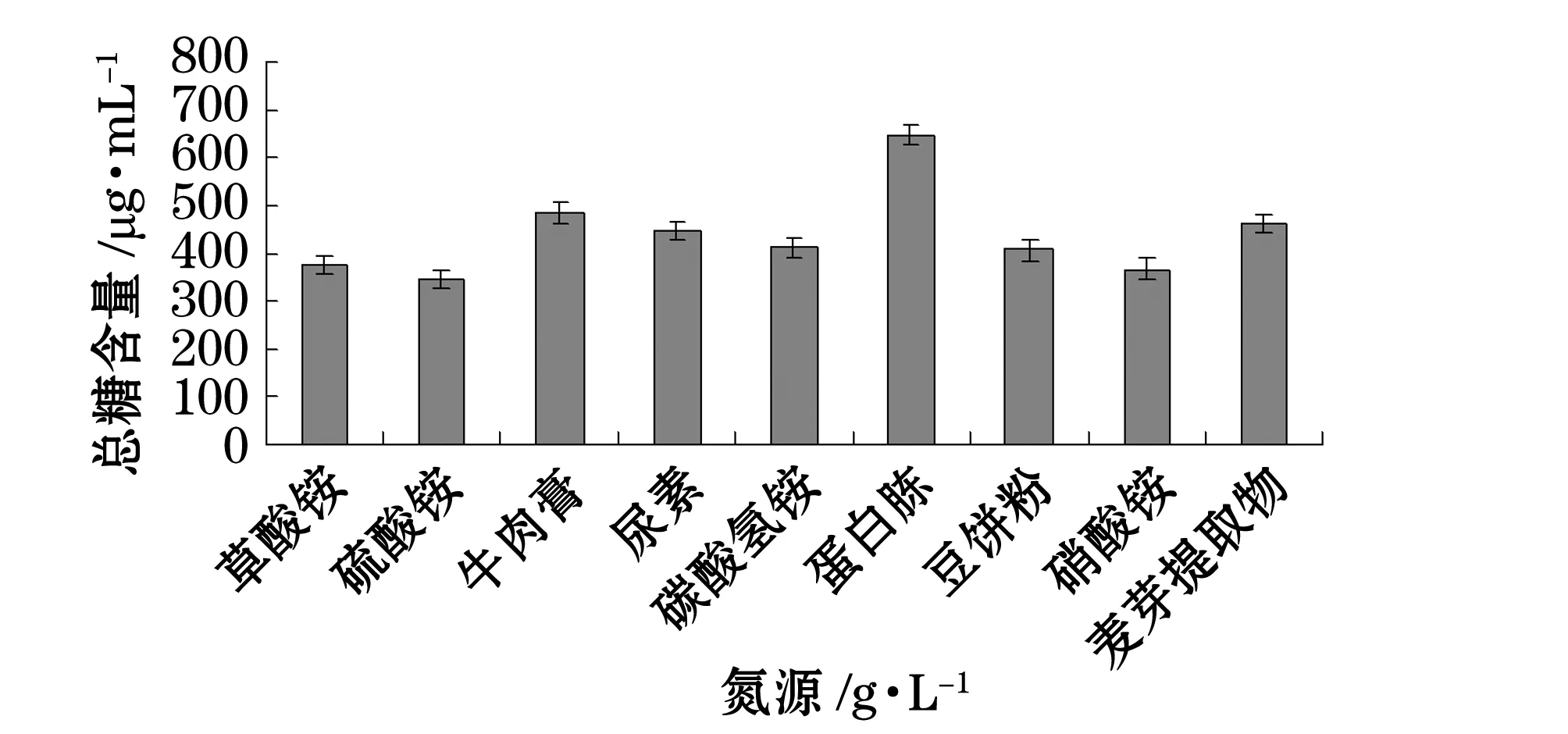
圖4 不同氮源對產糖的影響Fig.4 Effect of various nitrogen sources on EPS production
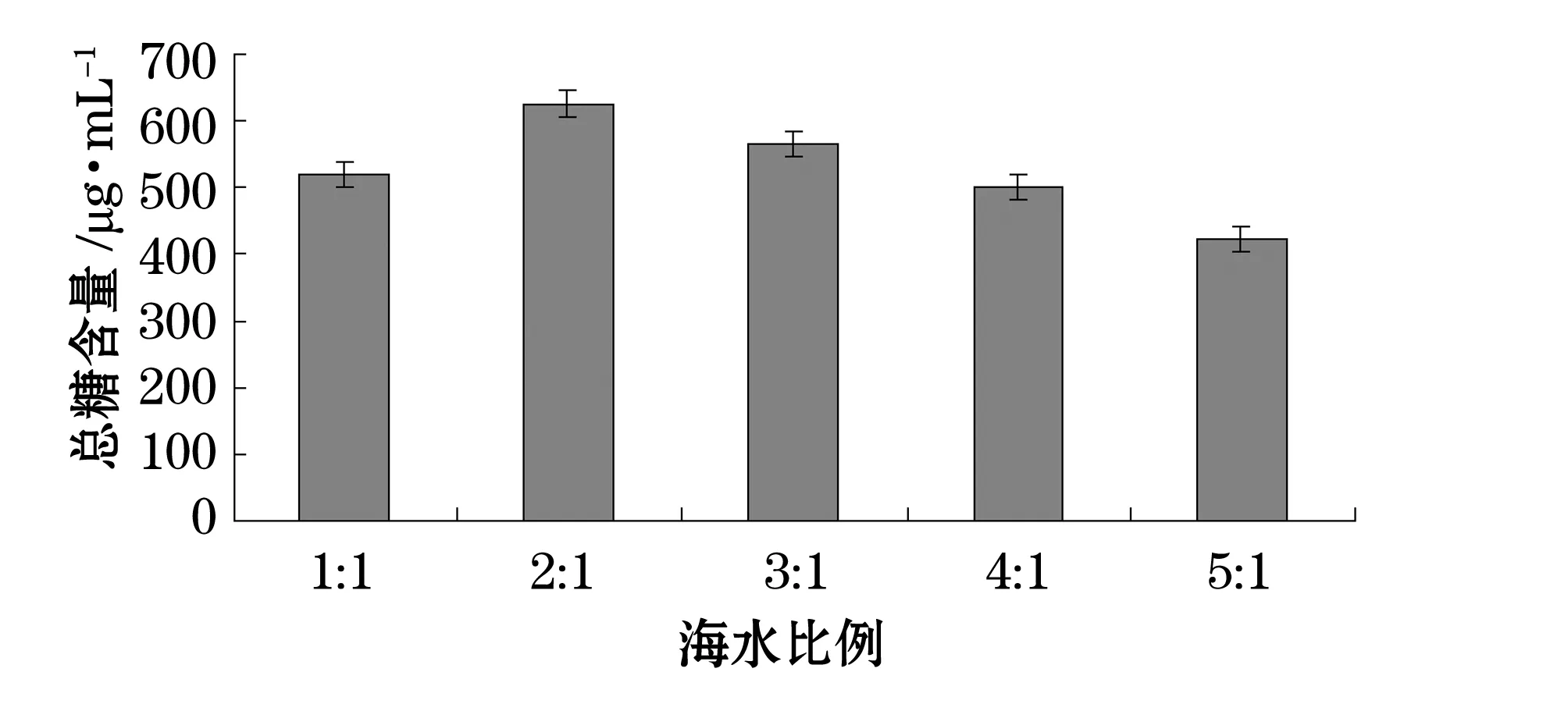
圖5 不同海水比例對產糖的影響Fig. 5 Effect of various seawater proportions on EPS production
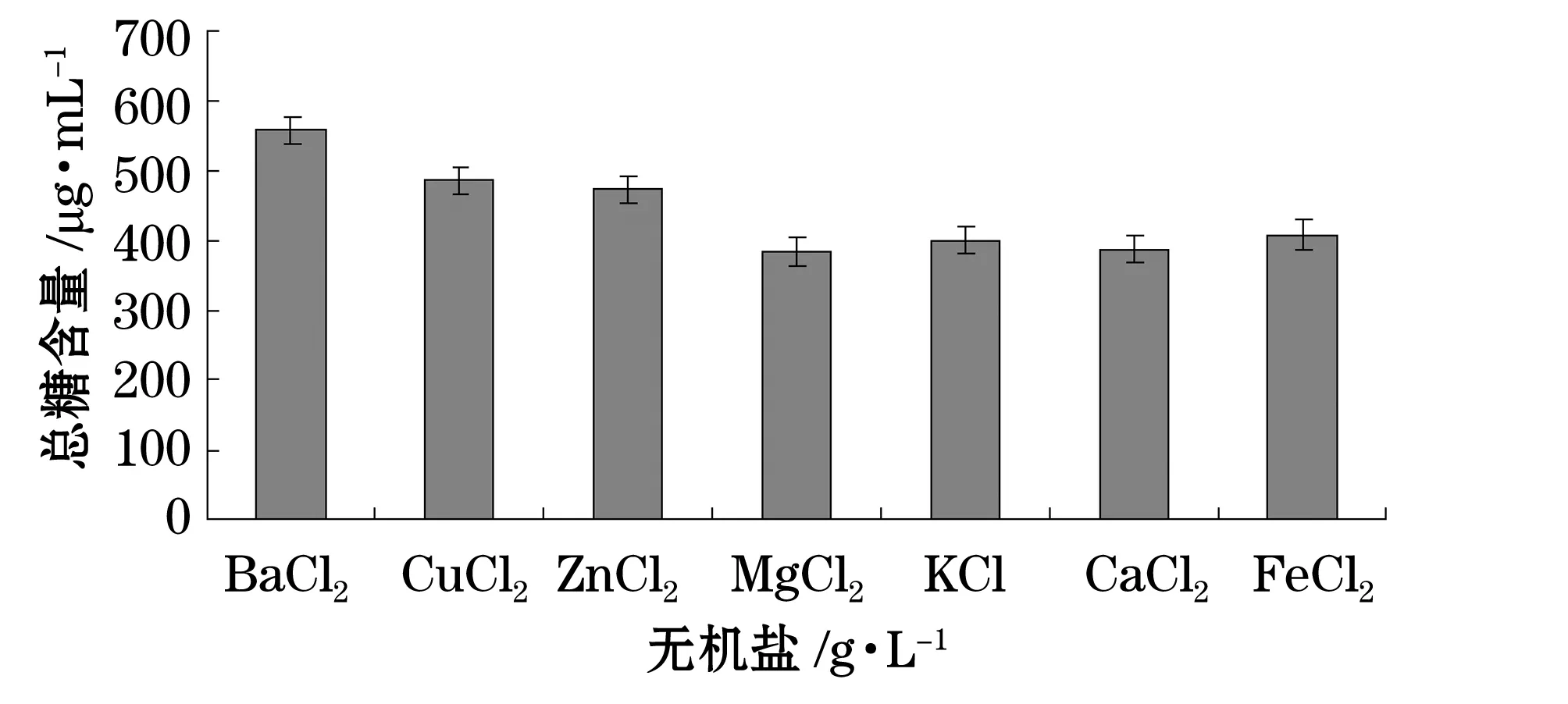
圖6 不同無機鹽對產糖的影響Fig. 6 Effect of various salts on EPS production
2.3 Plackett-Burman設計篩選結果
在前期單因子實驗的基礎上,本實驗選取可能影響產糖的10個因素:蛋白胨、酵母粉、海水配比、pH、溫度、搖床轉速、接種量、裝液量、培養時間、BaCl2。來進行實驗次數N=12的Plackett-Burman實驗。10個因素分別對應于表1中的10個列,每個因素分別取低水平“-1”和高水平“1”,并另設1個虛擬列,考察實驗誤差,以發酵液中產糖質量濃度為響應值(Y),實驗設計及結果見表1。運用SAS軟件,對實驗結果進行分析,得出各因素的t值和可信度水平,各因素主效應分析見表2。
一般選擇可信度大于90%以上的因素作為顯著因素[7]。由表2的主效應分析結果可知,在PB設計的二水平范圍內,影響南極菌B-3產糖的主要因素為酵母粉濃度、海水配比和裝液量,其可信度區間均在90%以上。由于發酵培養基的碳源、氮源均已確定,而其他因素對產糖的影響不顯著,故在下一步響應面分析中需要進一步考察酵母粉濃度、海水配比和裝液量對產糖量的影響,其余不顯著因素按照正負效應確定,正效應取高值,負效應取低值,即蛋白胨6 g/L,接種量1.5 %,培養時間64 h,BaCl20.03 g/L,并且根據實驗操作的實際情況將溫度定為10 ℃,轉速150 r/min,pH為7。

表1N=12的Plackett-Burman的實驗設計及響應值Table 1 Experimental design of Plackett-Burman and corresponding results(N=12)

表2Plackett-Burman實驗設計的因素水平及效應分析Table 2 Factors, levels and effect estimates of Plackett-Burman design
2.4 響應面分析
2.4.1 響應面實驗設計方案與結果
根據Plackett-Burman實驗結果,選擇酵母粉濃度、海水配比和裝液量為優化對象,以發酵液中產生的總糖含量為響應值來設計中心組合實驗,所設計的重要因素水平及編碼見表3,Box-Behnken實驗設計方案及結果見表4。
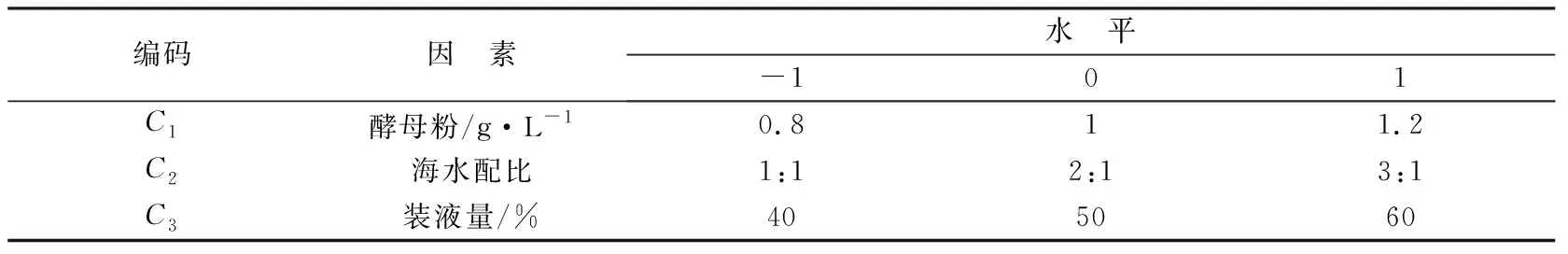
表3響應面因素水平編碼表Table 3 Factors and levels of response surface design
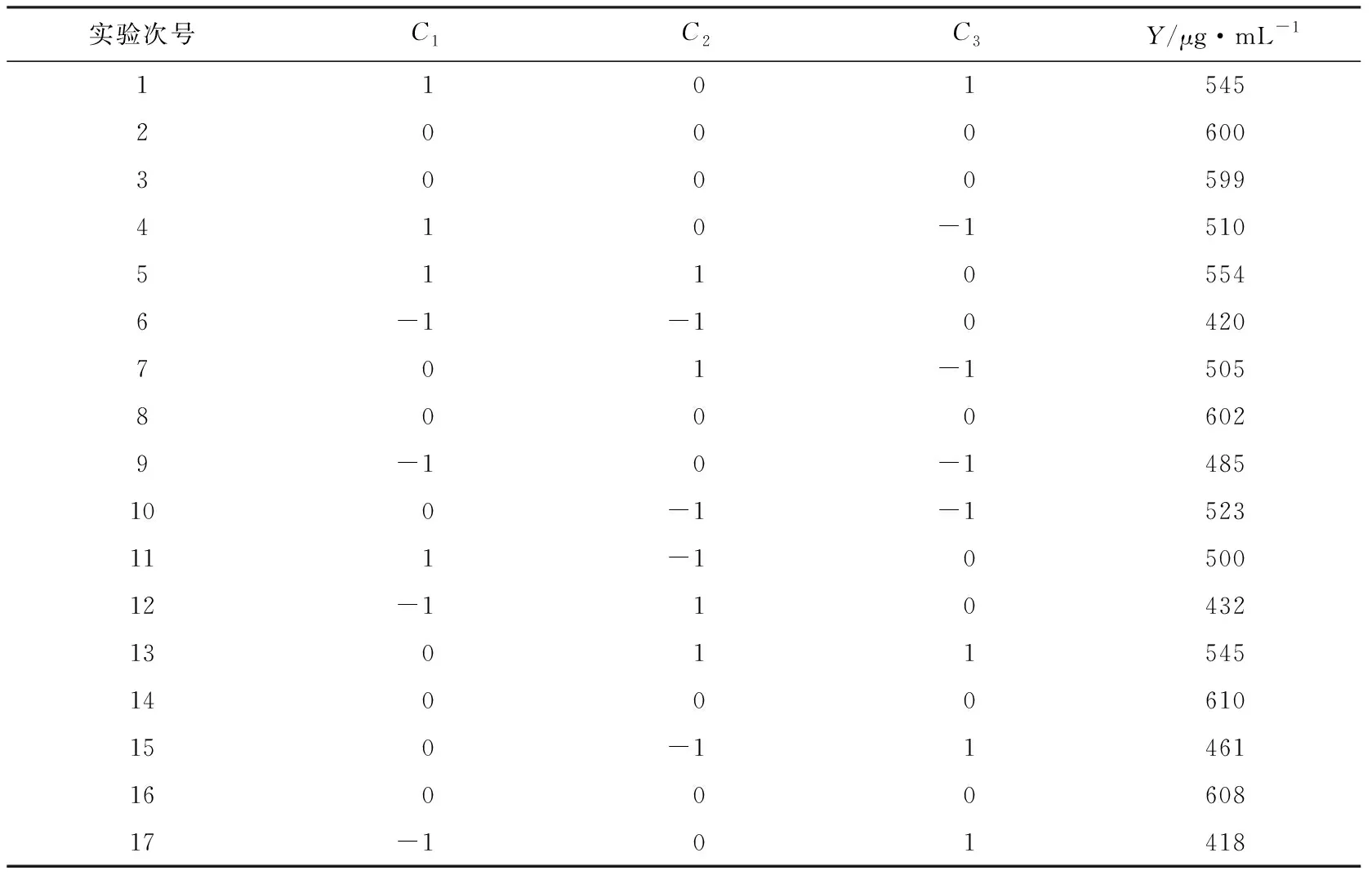
表4Box-Behnken實驗設計與結果Table 4 Experimental design and results of Box-Behnken
2.4.2 二次回歸方程擬合及方差分析
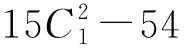
回歸方程的方差分析和可信度分析結果分別見表5和表6。
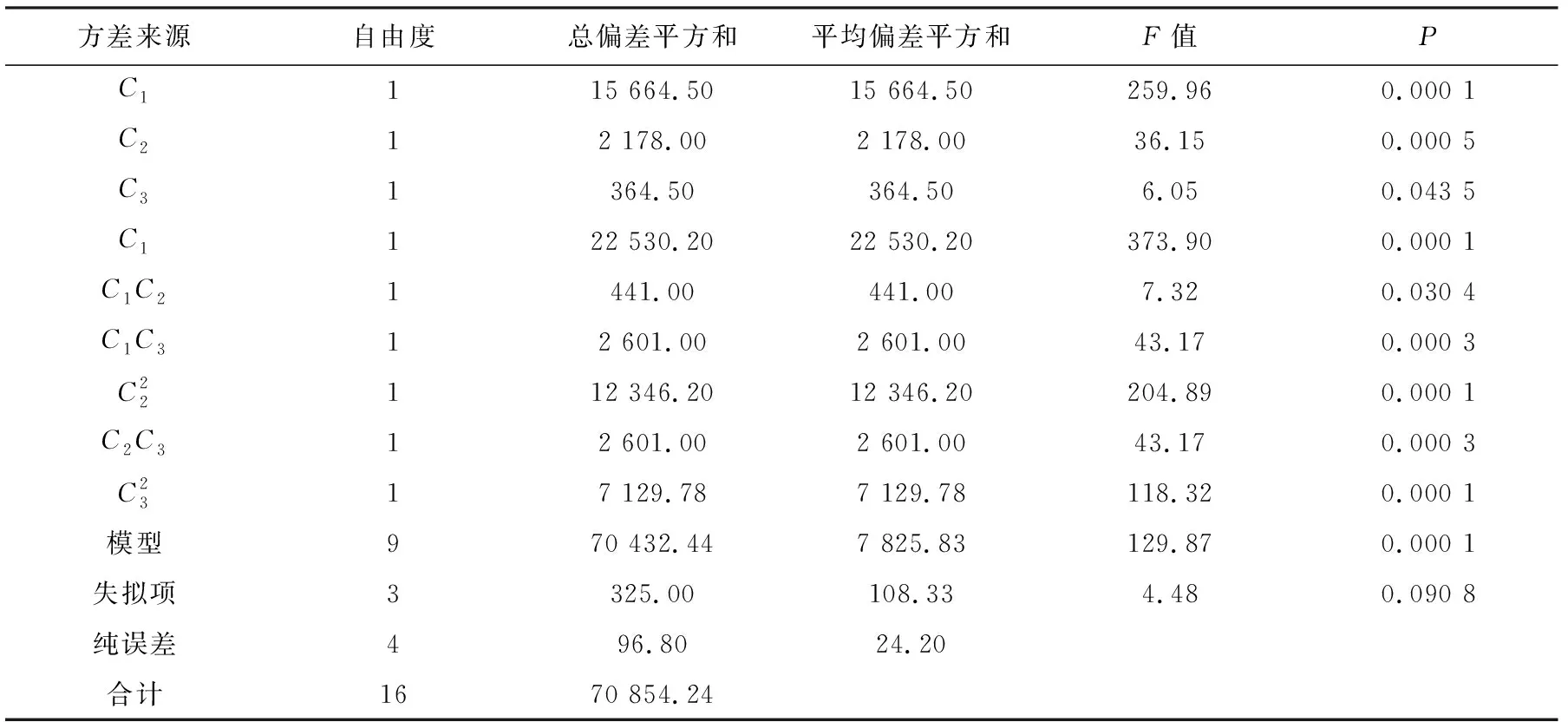
表5回歸方程的方差分析Table 5 ANOVA for the RSM experiment

表6模型可信度分析Table 6Reliability analysis for the modle
通過回歸方程的方差分析(表5)可知,回歸模型F值檢驗顯著(P=0.000 1<0.01),失擬項不顯著(P=0.090 8>0.05),即該模型在被研究的整個回歸區域擬合較好。從模型可信度分析(表6)可知,其決定系數(R2)=99.40%,這表明由這3個因素及其二次項能解釋響應值(Y)變化的99.40%,說明模型的相關度較高;校正決定系數(Adj.R2)=98.64%,表明98.64%的實驗數據的變異性能用此回歸模型解釋;預測決定系數(Pred.R2)=0.924 5,預測決定系數較高,說明模型對實驗預測的可靠性達92.45%,說明模型可靠性較好;Y的變異系數(C.V.)=1.48%,較低,說明實驗操作性較高。由此可見,該回歸模型具有較好的擬合度,可用該回歸方程對南極菌B-3產糖量進行分析和預測。
在α=0.05的顯著水平上,3個關鍵因素在所確定的濃度范圍內對產糖的影響都是顯著的,在所選的各因素水平范圍內,按照其對結果的影響排序為:酵母粉濃度>海水配比>裝液量。
2.4.3 響應面分析顯著因子水平的優化
利用SAS軟件對二次回歸模型進行規范分析,通過回歸方程來繪制分析圖,考察所擬合的相應曲面形狀,酵母粉濃度、海水濃度、裝液量之間的立體分析圖和等高圖見圖7~9。
結合圖7~9,運用響應面軟件進行分析,在回歸方程中存在穩定點為極大值,得到極大值所對應的各主要因素(C1,C2,C3)的編碼值分別為(0.331,0.204,0.084),其對應的實際值為(1.07,65.05,50.84),即酵母粉濃度、海水濃度、裝液量的最佳值分別為1.07 g/L,65.05%,50.84%,而此時模型發酵液中的產糖量最高,其預測值為613 μg/mL。
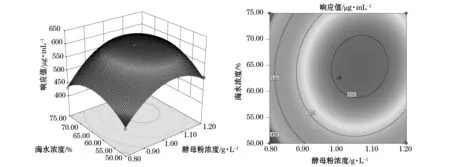
圖7 酵母粉濃度和海水濃度對產糖的交互影響Fig. 7 Reciprocal effect of yeast extract concentration and seawater concentration on EPS production
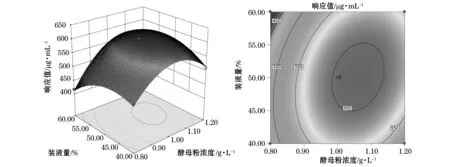
圖8酵母粉濃度和裝液量對產糖的交互影響Fig. 8 Reciprocal effect of yeast extract concentration and liquid volume on EPS production
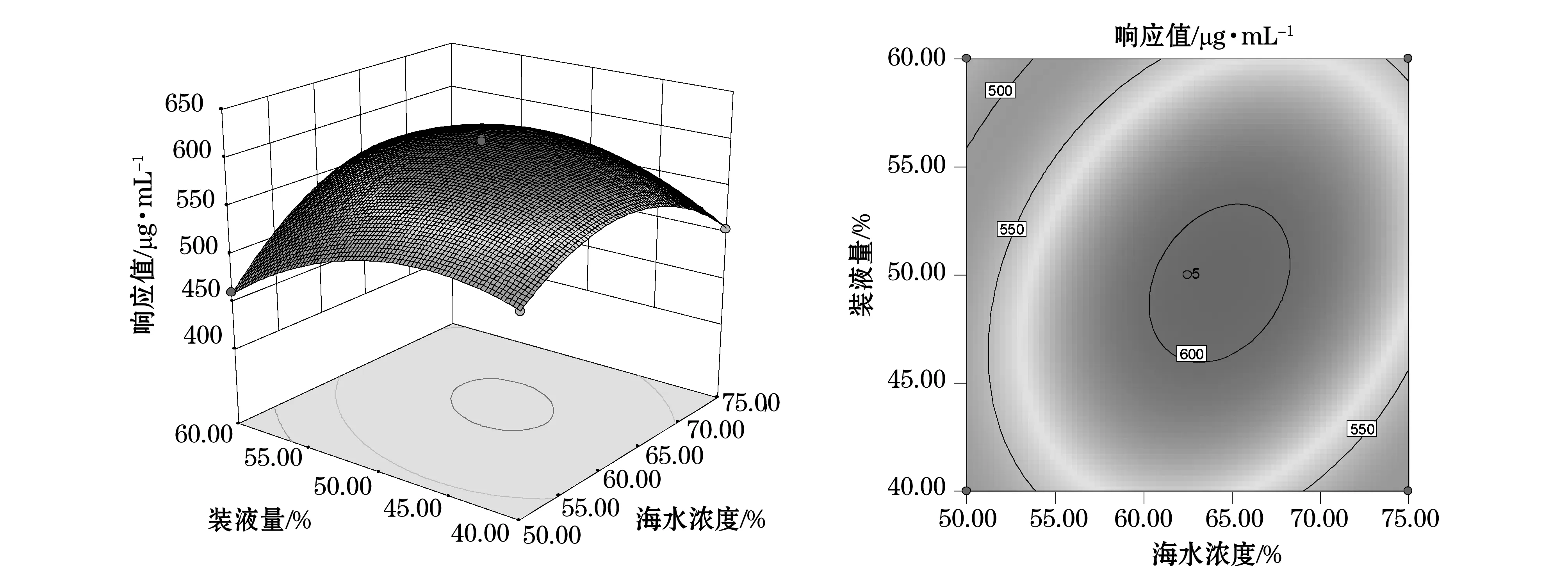
圖9海水濃度和裝液量對產糖的交互影響Fig. 9 Reciprocal effect of seawater concentration and liquid volume on EPS production
2.4.4 模型實驗
為了驗證響應面優化設計的準確性,以模型分析確定影響產糖主要因素的濃度來配置發酵培養基,并根據實驗操作的合理性,確定酵母粉濃度為1.1 g/L,陳海水與自來水的配比為2∶1,裝液量為50%,其余發酵條件按Plackett-Burman實驗確定,即蛋白胨6 g/L,接種量1.5%,培養時間64 h,BaCl20.03 g/L,溫度10 ℃,轉速150 r/min,pH為7,共進行3組實驗,每組至少3個樣本進行發酵。3組的平均產糖量分別為621 μg/mL,619 μg/mL,632 μg/mL,均值為624 μg/mL。這是原始發酵培養基平均444 μg/mL產糖量的1.4倍,產量提高了40%。實驗結果與預測值較接近,說明回歸方程能夠比較真實地反映各篩選因素對產糖量的影響,可見,用該回歸模型優化南極菌B-3產糖發酵培養基和條件是可行的。
3 討 論
糖類是自然界分布最廣、含量最豐富的生物高分子聚合物,也是自然界中分子結構最復雜的一類物質[9]。它們與蛋白質、核酸、脂肪一起組成了生物體內最重要的四類高分子化合物。糖的研究在經歷了1個多世紀的緩慢發展之后,從20世紀70年代開始,隨著分離分析技術的進步和分子生物學的發展,逐漸又得到了復興,并取得了巨大進展,糖生物學研究正成為生命科學研究領域又一新的前沿和熱點[10]。
一些糖類物質具有抗腫瘤,抗氧化性,和增強機體免疫力等非常有益的特性[11]。有些糖類物質特別適合用于制造功能性食品,這些糖類具有巨大的工業應用價值,并在眾多領域擁有著誘人的前景[12]。目前,我國雖在一些糖類的研究中取得了一定的進展,但在糖類的工業化過程中還存在著糖產量較低,產糖菌種較少等問題。因此,關于一些產糖菌的發酵培養條件優化就顯得尤為重要。
傳統的生物過程優化大多采用單一的單因素設計,較繁雜的正交設計或單一的響應面分析[13]。而本研究針對單一使用響應面法的不足之處,高效整合單因子實驗、Plackett-Burman設計、響應面中心組合設計等統計學方法,準確快速地實現了南極菌Psychrobactersp.B-3菌株產胞外多糖條件的優化研究,獲得了理想的結果。本研究從眾多影響產胞外多糖的因素中篩選出了主要因素并實現了因素水平的優化,較大地提高了南極菌B-3的產糖量,為以后的擴大生產和工業化利用打下了堅實的研究基礎。
參考文獻(References):
[1] XU C L,WANG Y Z,JIN M L, et al. Preparation, characterization and immunomodulatory activity of selenium-enriched exopolysaccharide produced by bacteriumEnterobactercloacaeZ0206[J]. Bioresource Technology, 2009, 100(6): 2095-2097.
[2] PURNIMA S, ASHUTOSH S, LISETTE M, et al. Chemical constituents and antioxidant activity of the Arctic mushroomLycoperdonmollePers[J]. Polar Research, 2012, 31: 17329-17338.
[3] KREMBS C, ENGEL A. Abundance and variability of microorganisms and transparent exopolymer particles across the ice-water interface of melting first-year sea ice in the Laptev Sea (Arctic)[J]. Mar. Biol., 2001,138:173-185.
[4] LI J,TAN J J,HE P Q. Induced disease resistance of Antarctic bacteria B-3 extracellular oligosaccharide on cucumber[J].Plant Diseases and Pests,2010,1(5):26-29.
[5] KALIL S J, MAUGERI F, RODRIGUES M I. Response surface analysis and simulation as a tool for bioprocess design and optimization [J]. Process Biochemistry, 2000, 35: 539-550.
[6] THERHO T T,HARTIALA K. Method for determination of the sulfate content of glycosaminoglycans[J].Anal. Biochem.,1971, 41: 471-476.
[7] CAO X H, CAI P, LI F, et al. Medium optimization for lipopeptide produced byBacillusnattoTK-1 using Response Surface Methodology[J].China Biotechnology,2007,27(4):59-65. 曹小紅.蔡萍,李凡,等.利用響應面法優化BacillusnattoTK-1產脂肽發酵培養基[J]. 中國生物工程, 2007, 27(4): 59-65.
[8] ELIBOL M, OZER D. Response surface analysis of lipase production by freely suspendedRhizopusarrhizus[J]. Process Biochemistry, 2002, 38(3): 367-372.
[9] RADEMACHER T W, PAREKH R B,DWEK R A. Recent advances in glycoconjugate analysis and glycobiology [J].Current Opinion Biotechnology,1998, 9(1): 74-79.
[10] SUTHERLAND I W. Bacterial exopolysaccharioles-a perception [J]. Adv. Microbiol. Physiol.,1972,8:143- 212.
[11] YANG L Q,ZHANG L M. Chemical structura1 and chain conformational characterization of some bioactive polysaccharides isolated from natural sources [J].Carbohydrate Polymers, 2009, 76(3):349-361.
[12] LIN Y W. Performance, application and prospects of several new microbial polysaccharides food additive [J].Food Research and Development, 2006, 27(3): 137- 138. 林燕文. 幾種新型微生物多糖食品添加劑的性能、應用及發展前景[J].食品研究與開發,2006, 27(3): 137-138.
[13] OU H Y, JIA S R. The application of SAS system in optimization of microbial culture conditions [J].Journal of Tianjin University of Light Industry, 2001, 36: 14-17. 歐宏宇, 賈士儒.SAS軟件在微生物培養條件優化中的應用[J]. 天津輕工業學院學報, 2001,36: 14-17.

