“毛細管區帶電泳同時分離BSA與單鏈DNA”開放實驗
屈 鋒,劉弘洋,吳景剛
(北京理工大學 生命學院,北京 100081)
1 實驗選題的意義
現代分析化學方法及技術的應用是當今科學技術和經濟發展的重要基礎,也是衡量一個國家科學技術發展水平的重要標志之一。當今的生物、醫學、食品、農業、環境等眾多學科領域的前沿研究,無一不是以現代分析化學的方法和技術為基礎和手段(如人類基因測序、蛋白質組學研究、食品安全檢測、環境保護監測等),因此學習現代分析化學基本方法和實驗技能對于多學科基礎研究和多行業實際應用具有極其重要的意義[1]。當前,我國分析化學專業的人才大多是通過綜合大學的化學學科分析化學專業培養,而大多數生物、醫學、食品、農業、環境等專業的學生在本科階段和研究生階段都很難有機會深入學習和完整掌握現代分析化學的基本方法和實驗技能。他們在解決科研和實際生產中的具體問題時常常面臨現代分析化學知識和實驗技能的不足。因此,有目的地培養非分析化學專業的學生對現代分析化學新技術、新方法的認知,加強學生實踐技能訓練、提高學生實際動手能力,并借此培養學生分析問題和解決問題的能力,對于相關學科的研究型人才培養十分必要[2]。
毛細管電泳技術(capillary electrophoresis,CE)作為分析化學學科前沿和熱點之一,不僅是微流控芯片技術的基礎,也是聯系電泳和液相色譜分析方法之間的新型分析技術,在生命科學、環境科學、食品科學等領域具有廣泛的應用和發展空間。目前分析化學實驗中的儀器分析基礎實驗大都是經典的光學、電化學、色譜等驗證性實驗。而生物學專業中,電泳實驗是最重要也是最基礎的實驗,大都只在生物化學實驗中有所涉及。毛細管電泳技術作為新型分析技術,與傳統電泳和液相色譜技術相比,具有高效、快速、實驗成本低、試劑和樣品用量少,以及儀器操作簡單等突出特點[3]。本文主要介紹以我校生命學院二年級生物工程和生物技術專業本科生為對象,開設蛋白質和核酸同時分析檢測的基礎型開放實驗的內容。
蛋白質和核酸是生命科學研究的基礎物質,蛋白質和核酸的分析檢測是生物學研究中必不可少的內容[4]。凝膠電泳是蛋白質和核酸分析的經典方法,目前仍廣泛應用[5]。凝膠電泳實驗是生物學專業本科生的基礎教學實驗,通常分別使用PAGE或SDSPAGE和瓊脂糖凝膠電泳定性檢測蛋白質和核酸。本開放實驗利用毛細管電泳同時分析蛋白質和核酸,目的是向學生介紹毛細管電泳高效、快速、成本低、試劑和樣品用量少、分析模式多樣等突出的特點,開闊學生的知識面,了解利用現代毛細管電泳分析技術快速進行蛋白質與核酸的同時定性、定量分析,并且比較毛細管電泳與經典凝膠電泳方法在原理及儀器和實驗操作上的差異。
2 實驗目的和內容
2.1 實驗目的
(1)掌握毛細管電泳的原理,能熟練使用毛細管電泳儀。
(2)了解毛細管區帶電泳同時分析蛋白質和核酸的基本原理,了解影響分析效果的因素,學習優化實驗條件的方法,確定優化的實驗條件。
(3)了解蛋白質和核酸樣品的荷電特性,學習利用毛細管區帶電泳對蛋白質和核酸標準樣品進行定性、定量分析的方法。
(4)學習對實驗結果進行正確的總結和討論,以及對實驗過程中出現的問題進行正確分析的方法。
2.2 實驗內容
本實驗通過毛細管區帶電泳法分析牛血清白蛋白(BSA)及單鏈核酸序列(ssDNA:5’-GGT TGG TGT GGT TGG-3’)標準樣品,確定蛋白質和單鏈核酸的出峰順序。考察電泳電壓、分離溫度、電解質溶液的pH值及有機溶劑和線性高分子聚合物添加劑對分析結果的影響。
3 實驗部分
3.1 實驗儀器
Agilent CE毛細管電泳儀配有DAD檢測器及恒溫控制系統(Agilent公司);漩渦混合器XW-80A(江蘇海門市其林貝爾儀器制造有限公司 );Adventurer電子天平(奧豪斯儀器有限公司);pH 211酸度計(意大利 HANNA 儀器公司);移液器(0.5~10μL,20~200μL,100~1 000μL,dragon公司);超聲波清洗器(寧波新芝生物科技股份有限公司);熔融石英毛細管柱(邯鄲市鑫諾光纖色譜有限公司)。
3.2 實驗試劑
H3BO3(北京化學試劑公司);Na2B4O7·10H2O(北京益利精細化學品有限公司);二甲基亞砜(DMSO)(北京北化精細化學品有限責任公司 )。以上試劑均為分析純。實驗中使用高純水配制溶液。
BSA購自北京紐樸生物技術有限公司;ssDNA購自生工生物工程(上海)股份有限公司。
3.3 實驗條件
75μm內徑熔融石英毛細管,長度33.5cm(有效長度 22.5cm),分離電壓 10kV,氣壓進樣 50 mbar10s,214nm 紫外檢測。50mMol/L H3BO3/Na2B4O7(pH 8.7)作為緩沖溶液,DMSO作中性標記物。新毛細管在使用前用1mol/L NaOH、0.1mol/L NaOH和去離子水依次沖洗30min進行活化;每2次進樣之間依次用0.1mol/L NaOH、去離子水、緩沖溶液分別沖洗5min。
4 結果與討論
4.1 實驗原理
毛細管電泳中,由熔融石英毛細管產生的電滲流大小決定溶液中組分的遷移速率,此外,蛋白質和核酸分子還受自身表面電荷和質量(荷質比)的影響。蛋白質與核酸分子因自身性質差異導致其在電泳過程中的遷移速率不同而分離[6]。因此,影響蛋白質和核酸分子分離的主要因素有電場強度、電解質溶液的組成和濃度以及電泳過程中的分離溫度。
4.2 蛋白質和核酸峰的確定
以50mmol/L H3BO3/Na2B4O7(pH 8.7)為緩沖溶液,在214nm紫外波長下檢測DMSO、BSA和ssDNA;通過單組分進樣可以確定,出峰順序依次為DMSO、BSA、ssDNA(圖1),即3種組分的遷移速率為DMSO>BSA>ssDNA。產生這種結果的原因是DMSO為中性分子,不帶電荷,電泳過程中作為電滲流的標記分子最先出峰,BSA的等電點為4.9,在pH 8.7電解液中帶負電荷,因此遷移較中性分子DMSO慢,ssDNA因大量磷酸基團存在而帶更多的負電荷[7],電泳過程中遷移速率最小,遷移時間最短。
圖1顯示,3種樣品混合進樣時,當樣品中BSA的濃度增加,其峰面積相應有所增加。此外,3種組分3次重復測定結果顯示,其遷移時間的RSD值在0.43%~1.06% 之間(見表1)。以上結果表明,該實驗條件下,蛋白質和核酸分子可以實現同時分離,且遷移時間的重復性很好。
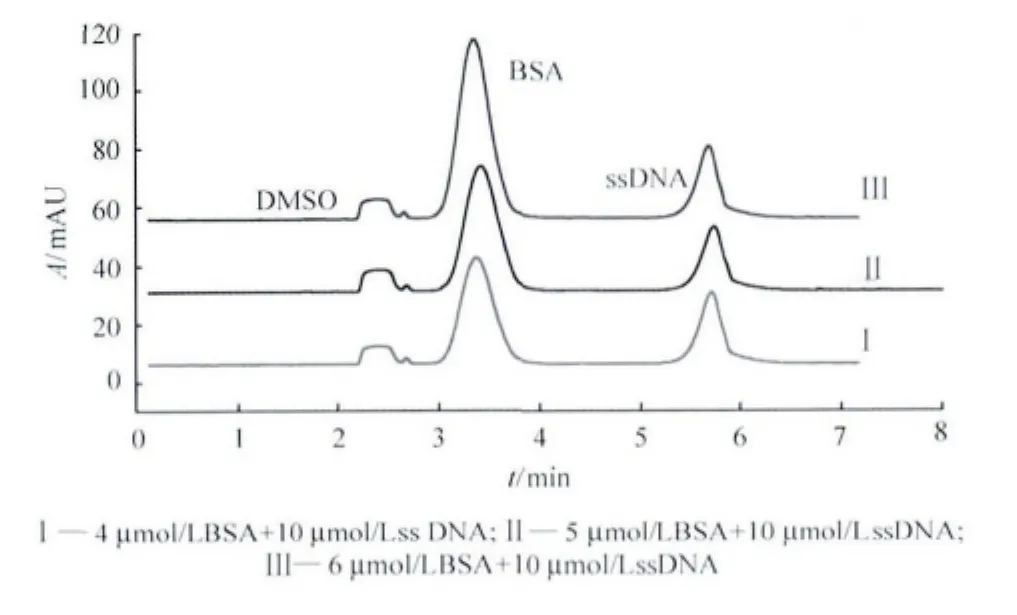
圖1 BSA與ssDNA標準樣品混合物的電泳圖
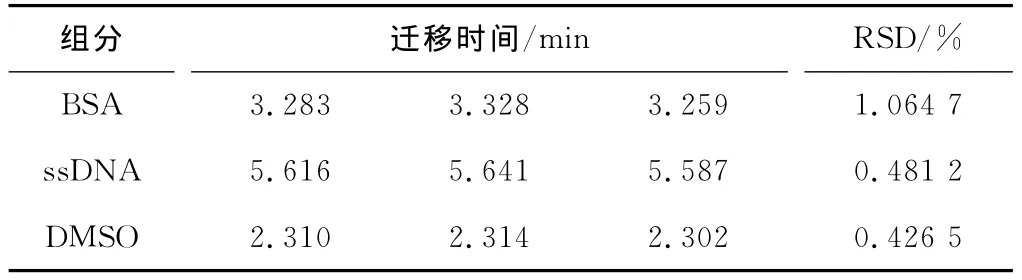
表1 BSA與ssDNA分離的遷移時間重復性(n=3)
4.3 電壓對分離的影響
電泳電壓影響電滲流和組分的遷移速度,影響組分的遷移時間。遷移速率(v)與工作電壓間有一線性關系:v=qE/6(q:樣品的有效電荷;E:電場強度;γ:樣品的表觀液態動力學半徑;η:介質的黏度),即當毛細管長度一定時,電滲流速度與工作電壓呈正比[8]。
當分離電壓為10~20kV時,3組分的表觀遷移時間隨電泳電壓增大而明顯加快,遷移時間縮短(見圖2)。扣除電壓增加導致的電滲流增大等因素,3組分的相對電泳遷移時間基本穩定,其RSD值<3% (見表2),說明相對電泳遷移時間可作為毛細管區帶電泳中組分定性的可靠參數[9]。此外,應用高電壓可加快電泳分析速度,但也可能使組分的分辨率降低,且產生較大的焦耳熱,影響基線穩定和靈敏度[10]。
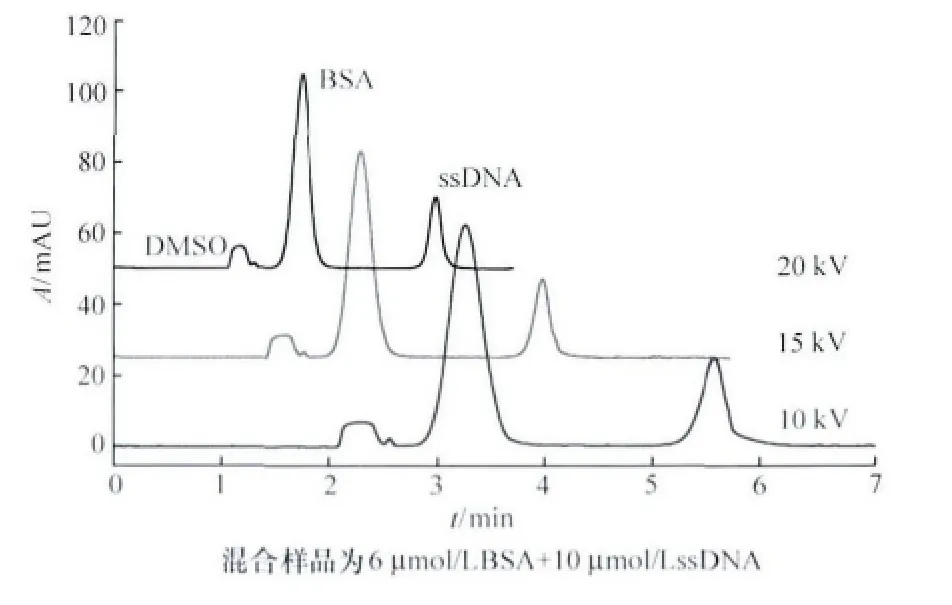
圖2 不同電壓對分離的影響
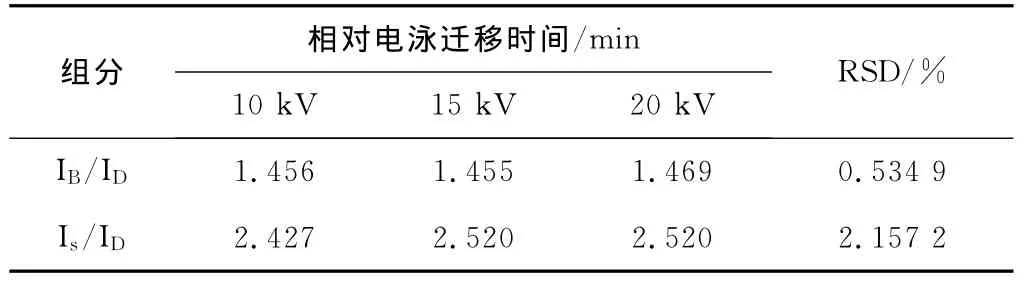
表2 電壓對相對遷移時間的影響(IB-BSA,Is-ssDNA,ID-DMSO)
4.4 分離溫度的影響
分離過程的溫度影響電解質溶液的黏度(溫度每變化1,將引起背景電解質溶液黏度變化2%~3%),從而影響電滲流,最終影響組分在電介質中的擴散。另外,由于緩沖液的pH值和蛋白質等電點都可能隨溫度而變,所以溫度還可能影響蛋白質所帶的電荷[11]。實驗考察15℃、20℃、25℃ 溫度下對分離效果的影響,結果見圖3。低溫時,有利于提高分辨率,如15℃時,核酸出現峰型分裂,可能因樣品存在雜質。高溫時,溶液黏度降低,電滲流增大,組分遷移時間縮短。故隨溫度升高,各組分遷移時間相應縮短。
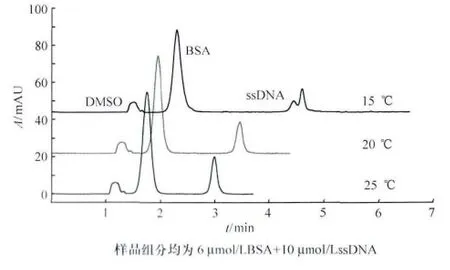
圖3 分離溫度對遷移時間的影響
4.5 緩沖液pH對分離的影響
電泳溶液的pH不僅影響毛細管內壁表面硅羥基的電離程度[12],而且影響組分的表面電荷,特別是對兩性分子蛋白質,其表面電荷受其等電點以及溶液pH影響,從而影響遷移時間。實驗比較了緩沖液pH 7.4~8.7對分離的影響,結果見圖4。
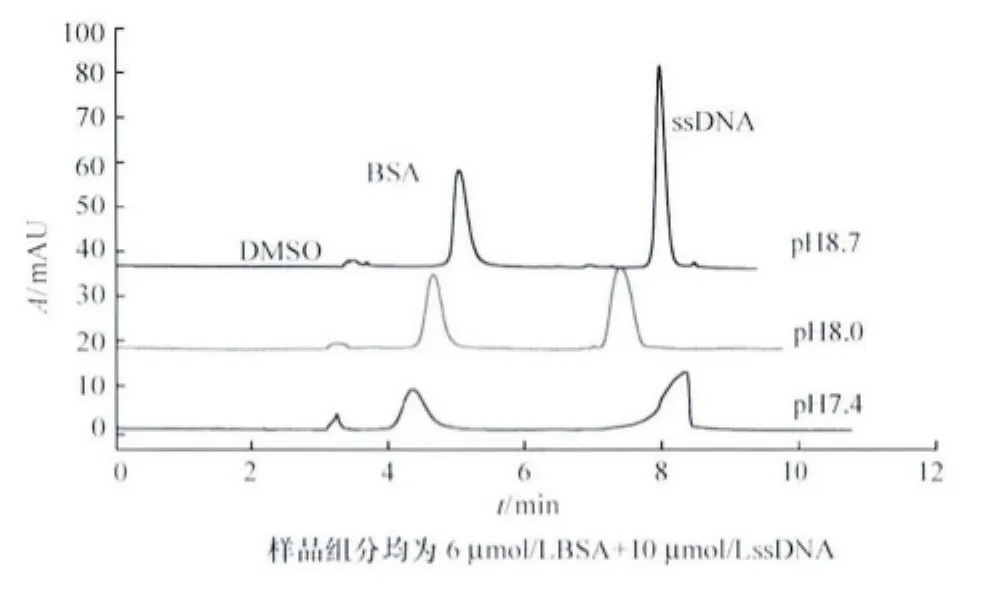
圖4 緩沖液pH對分離的影響
適當提高電泳溶液pH,可以增加電滲流,表觀淌度增加,相對分離時間縮短,分離效率提高;另一方面,改變電泳溶液pH,可改變溶質所帶電荷的性質或數量,使溶質淌度改變,從而改變分離選擇性,增加分離度[13]。由圖4結果可知,隨緩沖液pH增大,BSA和ssDNA峰型尖銳,峰高增大明顯,峰的分辨率提高,與理論推斷相符。
4.6 其他因素對分離結果的影響(選做)
完成上述實驗內容后,還可進一步選作其他條件優化實驗,如:電解質濃度的影響;加入有機溶劑的影響;加入高分子聚合物篩分介質的影響等。
5 結束語
本開放實驗的目的在于拓寬生物學專業學生對經典教材和實驗課教學內容的認知,了解蛋白質和核酸分析的新方法,了解現代分析新技術在生物學研究中的應用潛力。作為開放實驗,實驗中的很多環節都可由學生自行設計,例如學生可進一步選擇感興趣的蛋白質組分和核酸組分設計實驗方案,考察影響蛋白質和核酸混合物分離的主要因素,為CE毛細管電泳法在研究型課題中的應用奠定基礎。
(
)
[1]屈鋒,劉松南,任肖敏,等.“毛細管電泳快速分析蛋白質”開放實驗的實踐[J].實驗技術與管理,2009,26(4):26-28.
[2]屈鋒,宮紅梅,李秀珍,等.為生物學專業學生開設毛細管電泳開放實驗的探索與實踐[J].實驗技術與管理,2007,24(12):15-17.
[3]屈鋒,覃浩,馬文韜.毛細管膠束電動色譜分析飲料中的咖啡因開放實驗的實踐[J].實驗技術與管理,2008,25(12):27-33.
[4]Kraly J,Fazal Md A,Schoenherr R M,et al.Bioanalytical Applications of Capillary Electrophoresis Anal[J].Chem,2006(78):4097-4110.
[5]余和芬,孔璐,候燕芝,等.開設生物化學設計實驗,提高學生綜合素質[J].實驗技術與管理,2006,23(10):18-20.
[6]Learning to learn:An Introduction to Capillary Electrophoresis instrumentation[J].The Chemical Education,1996,l1(6):1-12.
[7]Nelson D L,Cox M M.Lehninger Principle of Biochemistry[M].周海夢,昌增益,譯.北京:高等教育出版社,2005.
[8]Tagliaroa F,Manettoa G,Crivellentea F,et al.A brief introduction to capillary electrophoresis[J].Forensic Science International,1998(92):75-88.
[9]張玉奎,陳農,王磊.幾種標準蛋白質的毛細管區帶電泳的分離及其遷移行為[J].分析化學,1994,22(8):798-800.
[10]陳義.毛細管電泳技術及應用 [M].2版.北京:化學工業出版社,2006.
[11]朱亮,許旭,林炳承.毛細管電泳中的溫度效應和溫度梯度技術[J].色譜,1999,17(1):21-25.
[12]朱健萍,胡昌勤,劉文英.毛細管電泳遷移時間重現性影響因素的探討[J].色譜,2006,24(4):396-401.
[13]林炳承.毛細管電泳導論[M].北京:科學出版社,1996.

