DEN2對鼠源性 DC TLR7、MyD88、NF-κB的表達與細胞因子分泌的影響①
曾 雯 左 麗 尹 科 張海燕
(貴陽醫學院免疫學教研室,貴陽550004)
登革病毒(Dengue virus,DEN)主要由埃及伊蚊及白紋伊蚊傳播,其感染已成為全球性重要的公共衛生問題,其中以登革2型病毒(Dengue virus type 2,DEN2)感染最為常見和嚴重[1]。目前認為登革病毒的致病機制主要與機體的免疫功能和病毒毒力有關,由此提出的發病機制包括抗體依賴的增強作用、細胞免疫和細胞因子的作用等,但仍未完全闡明。DEN為被覆包膜的單股、正鏈RNA病毒,基因組全長約11 kb,可編碼3種結構蛋白(C、M、E)和7種非結構蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5)。其中NS5蛋白是病毒基因組編碼的最大的蛋白,分子量104×103。近年來的研究表明,NS5蛋白具有RNA依賴的RNA聚合酶(RdRP)功能,即可以識別具有相對特異性的模板RNA并與之結合,合成與模板互補的RNA鏈,在病毒基因組復制過程中起關鍵作用,NS5可以成為阻斷或抑制病毒復制的靶標。樹突狀細胞(Dendritic cells,DCs)具有強大的捕獲、加工、遞呈抗原的能力,在對病原微生物的監測與應答中發揮著至關重要的作用,通過表達的Toll樣受體(Toll like receptors,TLRs)胞外區參與病原體相關分子模式(Pathogen-associated molecular pattern,PAMP)的識別[2],誘導初始 T 細胞活化和增殖,胞內段的髓樣分化因子88(Myeloid differentiation primary response protein 88,MyD88)作為重要的轉接蛋白參與細胞內信號傳遞,導致炎癥介質的釋放,在固有免疫及適應性免疫中發揮重要作用[3,4],因此認為TLR是連接固有免疫與適應性免疫的橋梁[5]。不同的TLR利用不同或相同的接頭蛋白向下轉導信號,其中與病毒識別相關的TLRs(TLR3、TLR7/8、TLR9),只有TLR3介導的是TRIF依賴型信號通路,而TLR7/8、TLR9介導的是MyD88依賴型信號通路。TLR與相應配體結合后在MyD88依賴方式中會產生核內因子κB(Nucleus factor kappa B,NF-κB)依賴細胞因子,IFN-γ誘導蛋白10(Gamma interferon inducible protein 10,IP-10)可誘導IL-12的聚集而使Th0向Th1方向極化[6],進而發揮相應作用。此外,還可產生IFN-α直接干擾病毒的復制,或活化NK細胞及CD8+T細胞從而在抗病毒感染中發揮作用。
本研究利用DEN2感染小鼠BMDC后,通過檢測樹突狀細胞中TLR7、MyD88、NF-κB的表達變化,觀察IFN-α、IP-10的分泌動態,探討 DEN對 TLR7-MyD88依賴型信號通路的影響,及其該信號通路介導IFN-α、IP-10的分泌對被感染 BMDC內 DEN2 NS5核酸水平的影響,以期探討MyD88依賴型信號通路在DEN2感染中的作用。
1 材料與方法
1.1 實驗動物及病毒株 6~8周齡C57BL/6小鼠,雌雄隨機,體重(16±2)g,購于重慶騰鑫比爾有限公司,許可證號:SCXK(渝)2007-0003編號:000031。登革2型病毒NGC株(DEN2 NGC株):購于中國預防科學院流行病研究所,本室常規液氮保存。
1.2 主要試劑 重組小鼠白細胞介素4(rmIL-4)、重組小鼠粒細胞-巨噬細胞集落刺激因子(rmGMCSF)均購自美國Peprotech公司。RPMI1640培養基、H-DMEM培養液、青鏈霉素購自美國Hyclone公司。流式抗體 Hamster Anti-mouse CD11c APC(IgG1)、Rat Anti-mouse I-A/I-E FITC(IgG2a)、Rat Anti-mouse CD86 PE(IgG2a)均購自美國BD公司。Western blot抗體 Rabbit polyclonal anti-TLR7、Rabbit polyclonal anti-MyD88、Rabbit polyclonal anti-NF-κB p65、Rabbit polyclonal anti-GAPDH均購自美國 Abcam公司。TRIzol、M-MLV逆轉錄試劑盒、PCR試劑均購自美國Invitrogen公司。IP-10、IFN-α ELISA檢測試劑盒均購自美國eBioscience公司。DEN2 NS5基因區(上游5'-ACAAGTCGAACAACCTGGTCCAT-3',下游 5'-GCCGCACCATTGGTCTTCTC-3')及 GAPDH(上游 5'-CATCACTGCCACCCAGAAGA-3',下游5'-TGAAGTCGCAGGAGACAACC-3')引物由上海捷瑞生物有限公司合成。FITC標記兔抗DEN2 E蛋白抗體購自上海億欣公司。
1.3 方法
1.3.1 C57BL/6小鼠 BMDC的制備 6~8周齡C57BL/6小鼠,雌雄隨機,頸椎脫臼處死,75%酒精浸泡消毒,無菌取股骨、脛骨,注射器沖出骨髓細胞,1 000 r/min,5分鐘,棄上清,加入紅細胞裂解液室溫作用2~3分鐘,D-Hanks洗滌2次,用含10%胎牛血清、100 U 雙抗、10 ng/ml rmGM-CSF、1 ng/ml rmIL-4的RPMI1640培養液配成1×106ml-1細胞懸液,2 ml/孔接種于12孔板,37℃ 5%CO2培養2~3天,棄非貼壁細胞,全量換液后繼續培養[7],培養5天收集細胞,流式細胞術檢測其純度及成熟情況。
1.3.2 DEN2 吸附鼠源性 BMDC 10-5.8TCID50 的DEN2 100 μl感染1.1 ×106個 C57BL/6 小鼠髓源性DC,感染MOI=0.4,37℃孵育4 小時,D-Hanks洗滌2次,補充含10%胎牛血清、100 U雙抗、10 ng/ml rmGM-CSF,1 ng/ml rmIL-4的RPMI1640培養液培養24小時;取DEN2感染組及正常組BMDC,37℃甲醛熏蒸30分鐘固定于載玻片上,PBS洗滌3次,10 μl兔血清封閉30分鐘,PBS洗滌同前,滴加FITC標記抗DEN2抗體(1∶100稀釋;含0.02%伊文斯藍),37℃避光 1小時,PBS洗滌3~5次,熒光顯微鏡觀察。
1.3.3 Western blot動態檢測 DEN2感染鼠源性BMDC 后 TLR7、MyD88、NF-κB、GAPDH 蛋白的變化DEN2(MOI=0.4)感染鼠源性 BMDC,同時設正常對照,于感染后24、48、72小時收集細胞,TRIzol法提取細胞總蛋白,Western blot動態檢測感染組及正常對照組 TLR7、MyD88、NF-κB、GAPDH 蛋白的變化。利用BCA法進行蛋白定量,分別取各組不同時間點100 μg蛋白上樣;SDS-PAGE分離總蛋白,0.8 mA/cm2膜面積恒流半干轉膜1小時,5%脫脂牛奶室溫封閉1小時,PBST洗膜3次,5~10分鐘/次;一抗 4℃ 孵育過夜;(TLR7、MyD88、NF-κB 稀釋比例為 1∶1 000、GAPDH 稀釋比例為1∶3 000)。次日,PBST充分洗膜,加入標記 HRP的羊抗兔 IgG(1∶1 000稀釋),常溫孵育1~2小時,PBST洗膜4次,5~10分鐘/次,ECL孵育5分鐘后曝光顯影。Quantity one軟件分析蛋白曝光條帶灰度值,與同組GAPDH灰度相比得到相對灰度比值,以24小時正常對照組蛋白表達為參照,做統計學分析。
1.3.4 ELISA檢測鼠源性 BMDC培養上清 IFN-α、IP-10的水平 DEN2(MOI=0.4)感染鼠源性BMDC,同時設正常對照,于感染后24、48、72小時收集細胞培養上清,雙抗體夾心ELISA法動態檢測感染組及正常對照組IFN-α、IP-10的水平,按試劑盒說明書操作,具體操作如下:96孔酶標板分設標準孔、空白孔、待測樣品孔,各孔均設復孔。(1)Wash buffer潤濕酶標板,分別加標準品、樣本稀釋液、待測樣本50 μl/孔,并在各孔中加入生物素化抗小鼠IFN-α/IP-10 50 μl,18 ~25℃孵育2 小時,Wash buffer洗板4次,甩干;(2)加HRP標記的親和素100 μl/孔,18~25℃孵育1小時,洗板同前;(3)底物工作液(TMB)100 μl/孔,18~25℃避光孵育30分鐘,加終止液100 μl/孔,酶標儀在測量波長450 nm,參考波長630 nm,讀取各孔吸光值及濃度。為排除細胞數目對上清中待檢蛋白含量的影響,按每孔細胞數為1×106個校正所得數據。
1.3.5 RT-PCR動態檢測鼠源性 BMDC中 DEN2載量 TRIzol法提取DEN2感染組及對照組不同時間點BMDC總RNA,按Invitrogen M-MLV逆轉錄試劑盒說明書操作,定量逆轉錄5 μg cDNA,利用500 ng cDNA進行PCR擴增內參GAPDH及DEN2 NS5核酸,反應體系為 50 μl,依次加入 dddH2O 34.3 μl,cDNA 5.0 μl,10 × PCR buffer 5.0 μl,dNTP 1.0 μl,MgCl21.5 μl,上游引物(10 μmol/L)1.5 μl,下游引物(10 μmol/L)1.5 μl,ExTaq 0.2 μl。PCR 擴增條件:94℃ 4分鐘;94℃ 30秒;64℃ 45秒;72℃ 1分鐘;72℃ 7分鐘進行34個循環,1%瓊脂糖凝膠電泳分析5 μl PCR產物。
1.4 統計學處理 采用SPSS17.0統計軟件進行數據分析,所有計量數據均采用±s表示,使用獨立樣本t檢驗處理數據,P<0.05具有統計學意義。
2 結果
2.1 C57BL/6小鼠 BMDC的獲得 rmGM-CSF、rmIL-4聯合誘導C57BL/6小鼠骨髓前體細胞,培養至第5天流式細胞術檢測其純度及成熟情況;CD11c為小鼠BMDC的特異性標志,其表達情況可反映小鼠BMDC純度;CD86、I-A/I-E等共刺激信號分子是DC成熟的重要標志,LPS可刺激DC成熟,高表達CD86、I-A/I-E等共刺激分子。誘導得到的BMDC經流式細胞術檢測純度達70%(圖1);且未成熟情況與LPS刺激組相比具統計學意義(P<0.05),結果見表1。
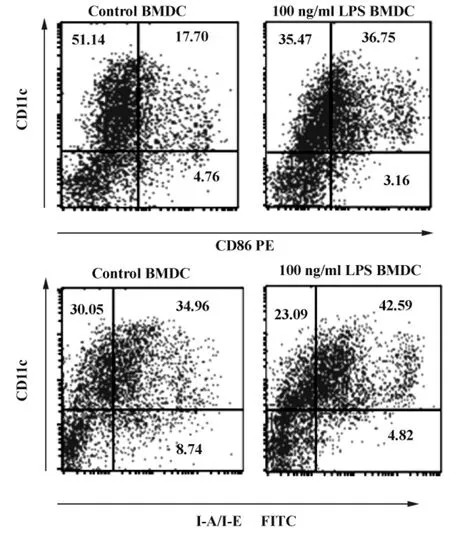
圖1 流式細胞術鑒定C57BL/6小鼠BMDC的純度及成熟情況Fig.1 The purification and maturity of bone marrow dendritic cells from C57BL/6 was identificated by Flow cytometry
2.2 DEN2吸附鼠源性BMDC情況 DEN2(MOI=0.4)感染鼠源性BMDC 24小時后,通過直接免疫熒光檢測DEN2吸附BMDC的情況,暗場中觀察到正常對照組細胞膜被伊文斯蘭襯染為紅色(圖2A、B);DEN2感染組,暗場中可觀察到FITC標記的抗DEN2 E蛋白抗體可與被感染BMDC上的DEN2抗原相結合(圖2C、D)。
2.3 DEN2 對鼠源性 BMDC 中 TLR7、MyD88、NF-κB表達的影響 采用Western blot動態檢測DEN2感染組及正常對照組 TLR7、MyD88、NF-κB、GAPDH的表達(圖3);通過對不同時間目的蛋白條帶進行灰度掃描,24小時正常對照組蛋白表達為參照,半定量分析各蛋白表達。觀察到病毒感染組TLR7蛋白的表達24小時高于正常對照組,48、72小時均低于正常對照組(圖4A);病毒感染組MyD88蛋白的表達24、48小時高于正常對照組,72小時時表達明顯降低,低于72小時正常對照組(圖4B);病毒感染組NF-κB蛋白的表達各時間點均高于正常對照組,在48小時表達最高,72小時有所下降,結果見圖4C。
表1 樹突狀細胞膜表面分子的表達(±s,n=3)Tab.1 The expression of membrane surface molecules of dendritic cells(±s,n=3)

表1 樹突狀細胞膜表面分子的表達(±s,n=3)Tab.1 The expression of membrane surface molecules of dendritic cells(±s,n=3)
Note:Compare with Non LPS stimulation group,1)P <0.05.
Membrane surface molecules The percent of membrance surface molecules(%)Non LPS stimulation LPS stimulation CD11c 71.36 ±3.44 73.29 ±1.25 CD86 29.2 ±4.55 48.82 ±7.221)I-A/I-E 43.55 ±4.01 51.06 ±6.411)
2.4 DEN2促進鼠源性BMDC分泌IFN-α、IP-10采用ELISA法動態檢測DEN2感染組及正常對照組BMDC培養上清IFN-α、IP-10的水平,觀察到DEN2感染組IFN-α、IP-10水平均高于正常對照組,且具統計學意義(P<0.05);DEN2感染組IFN-α隨著時間延長分泌量逐漸增加,72小時分泌量達(933.94±29.02)ρg/ml也具有統計學意義(P <0.05)。DEN2感染組IP-10呈現先升高,48小時達高峰,分泌量為(834.44 ±43.60)ρg/ml,72 小時有所降低,具有統計學意義(P<0.05),結果見圖5。
2.5 C57BL/6小鼠 BMDC中 DEN2動態變化DEN2(MOI=0.4)感染培養5天的C57BL/6小鼠BMDC,24、48、72小時收集感染組及正常對照組細胞,通過 RT-PCR、1%瓊脂糖凝膠電泳分析 DEN2 NS5 PCR產物,觀察到感染組及正常對照組GAPDH(圖6A)表達一致,感染組在177 bp處得到特異性DEN2目的條帶,DEN2核酸水平(圖6B)24小時較高,48小時達高峰,72小時有所減弱。

圖2 DEN2 NGC株吸附BMDC(×200)Fig.2 Characterization of DEN2 NGC strain adhered to BMDC(×200)

圖3 DEN2 NGC株感染BMDC后TLR7、MyD88、NF-κB、GAPDH蛋白表達Fig.3 The protein expression of TLR7,MyD88,NF-κB,GAPDH in BMDCs infected with DEN2 NGC
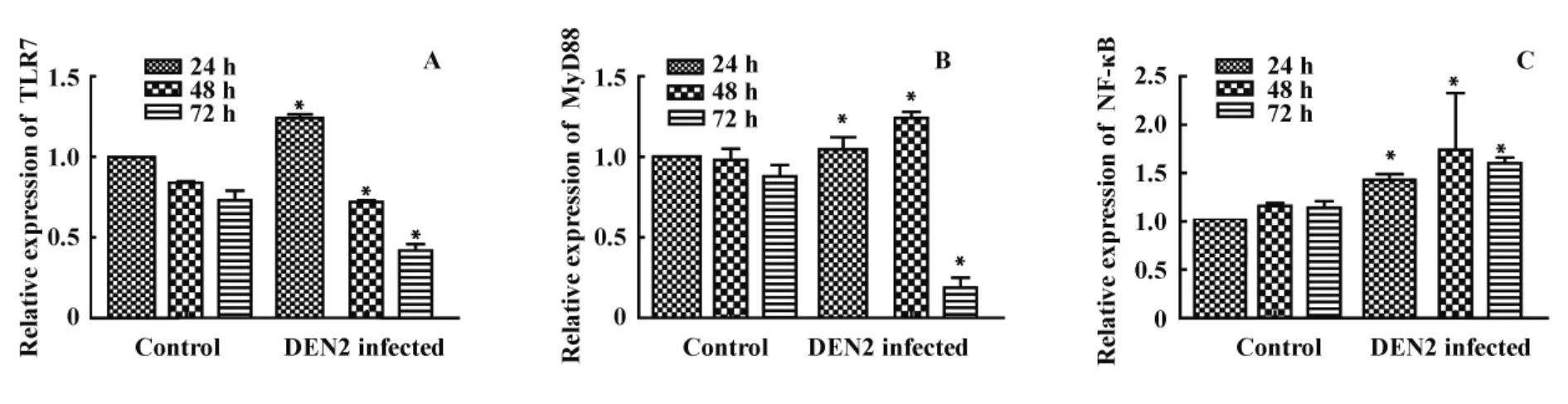
圖4 DEN2 對BMDC TLR7、MyD88、NF-κB蛋白表達的影響Fig.4 Effects of DEN2 on expression of TLR7,MyD88,NF-κB in BMDC
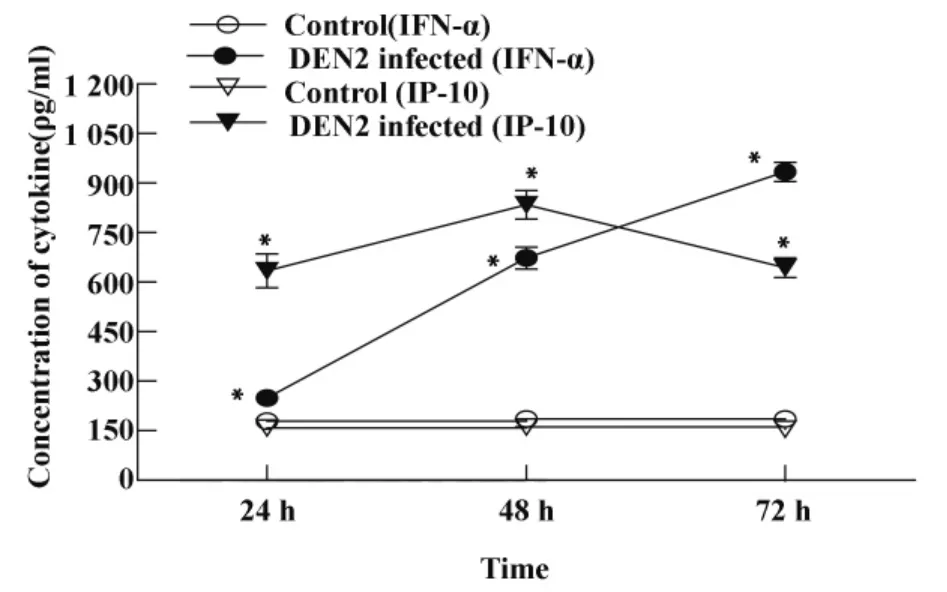
圖5 DEN2對小鼠BMDC分泌IFN-α、IP-10的影響Fig.5 Effects of DEN2 infection on secretion of cytokines(IFN-α,IP-10)in BMDCs
3 討論
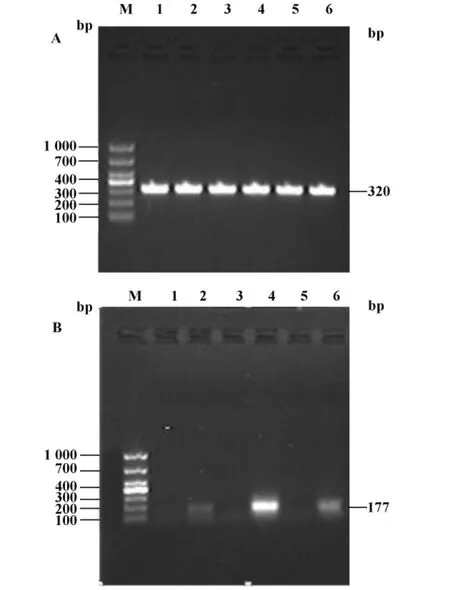
圖6 RT-PCR檢測DC中DEN2 RNAFig.6 Detection of DEN2 RNA in BMDCs by RT-PCR
DC作為目前已知功能最強大的抗原提呈細胞,近年來受到越來越多的關注,其中骨髓來源的DC可識別多種RNA病毒,包括麻疹病毒、HIV病毒、漢坦病毒、黃病毒及流感病毒[8,9]。分布在 DC上的TLRs可識別危險信號,在啟動抗細菌和病毒感染的固有免疫應答發揮關鍵作用[10]。BMDC被DEN2感染后,主要通過TLR3、TLR4、TLR7和TLR8識別及介導抗 DEN免疫反應[11],其中 TLR7及TLR8主要通過識別ssRNA介導抗DEN2免疫反應,為MyD88依賴途徑。TLR7廣泛分布于小鼠和人類的抗原提呈細胞(DCs、B細胞、單核巨噬細胞),此外自然殺傷細胞和T細胞中也有表達[12]。靜息狀態下,TLR7主要定位于內質網,是哺乳動物單鏈RNA的受體,在受到病原體刺激后,可與內質網跨膜蛋白UNC93B1相互作用,并轉移至胞內體膜上以識別相應的 PAMPs[13],在整個信號轉錄過程中,TLR7對配體的識別及轉錄控制方面起到了非常重要的作用[14],有研究提示TLR7缺陷的小鼠產生Ⅰ型干擾素的能力要弱于野生型小鼠,從而不利于病毒的清除,TLR7或MyD88的缺乏將減弱固有免疫并促進病毒在組織中的擴增[15]。TLR7與相應配體結合后可招募下游接頭蛋白分子啟動信號轉導途徑;MyD88是除TLR3外所有TLR下游信號所必須的,MyD88通過產生大量趨化因子使單核巨噬細胞及T細胞聚集發揮免疫應答作用,從而限制病毒的復制及擴散[16]。MyD88依賴途徑主要活化下游分子NF-κB、p38 MAPK及JNK,使其泛素化后轉位入核,可協同DC增加炎性細胞因子的分泌,其中NF-κB的活化,可促進 DC分化成熟及 TNF-α的分泌[17],在 TLR信號調節中起到積極作用。此外TLR7/MyD88途徑可活化 IRF-3、IRF7引起 IFN-α、IP-10的大量分泌,從而抑制DEN復制和感染擴散。
本研究利用DEN2感染小鼠髓源性DC,動態檢測 TLR7、MyD88、NF-κB 蛋白表達變化,在病毒感染后24 小時,TLR7、MyD88、NF-κB 的蛋白表達均較正常對照組增高,提示表達于DC內的TLR7識別單鏈DEN,從而表達明顯增高,并啟動MyD88信號途徑將識別信息向下傳遞,最終使NF-κB活化而引起一系列細胞因子的產生;而隨著感染時間的延長,TLR7的表達較24小時降低,此時病毒的核酸水平較24小時增高。有文獻報道,肝癌細胞中TLR7 RNA及蛋白的表達受損及減少是由于丙肝病毒的復制,用IFN-α預處理肝癌細胞以抑制病毒的復制可使TLR7的表達不減少,同時提出雖然丙肝病毒的復制可使TLR7的表達減少,但與此同時,仍上調其它信號通路的活化,且活化程度與病毒感染有關[18],故考慮TLR7表達的降低可能是由于病毒在細胞內復制所致,但其下游MyD88信號通路已被活化,故MyD88、NF-κB的表達在感染組均較正常組增高,MyD88、NF-κB表達增加,可促進 DC分化成熟,且NF-κB的活化可在病毒感染早期階段介導炎性細胞因子的分泌,并隨之促進Ⅰ型干擾素、趨化因子的分泌而發揮抗病毒作用。隨著時間的延長,在DEN2 感染72 小時后,TLR7、MyD88、NF-κB 的蛋白表達不論在正常細胞組還是病毒感染組均較前下降,TLR7介導的信號通路在病毒感染早期發揮作用,導致病毒感染細胞凋亡,而使病毒感染組TLR7、MyD88、NF-κB的表達下降,與病毒自身復制及DEN2感染后產生相關細胞因子發揮抗病毒作用有關。
傳統觀念認為,pDC在識別病毒后可產生大量的IFN-α。近期研究發現骨髓來源DC識別病毒也可產生大量的IFN-α,并具有強大的刺激T細胞活化的能力[19]。病毒感染DC時可刺激細胞產生大量的IFN-α/β,啟動宿主迅速而強烈的抗病毒應答[20],抑制體外DEN感染擴增并誘導產生IP-10,從而抑制病毒對其它細胞的感染,引起被感染細胞的凋亡,最終清除感染的病毒。本研究觀察到,當DEN2感染小鼠髓源性DC 24小時后IFN-α的分泌較正常對照組升高,且隨著時間延長,分泌量不斷增加;DEN2感染72小時后,IFN-α量達到最高,而此時病毒載量卻較48小時降低,因此可推斷IFN-α在此過程中發揮了抗病毒作用。
IP-10是IFN-γ誘導蛋白10,屬CXCL10趨化因子家族,可招募淋巴細胞、特異性CTL細胞到達感染部位識別病毒感染的DC,啟動T細胞免疫應答,為適應性免疫應答提供條件,Ⅰ型干擾素的產生可抑制病毒感染的傳播并導致大量趨化因子IP-10的產生。最近研究指出,CXCL10缺乏的小鼠對DEN易感,除了缺乏募集淋巴細胞的能力,還缺乏促進病毒清除的抗病毒活性[21]。因此IP-10在抗DEN中發揮重要作用,它可通過啟動適應性免疫應答和直接的抗病毒方式以發揮抗病毒作用。本研究證實DEN2感染組IP-10的分泌在感染后24小時較正常組明顯升高,48小時達頂峰,72小時又有所下降,但仍遠高于正常對照組。IP-10可使Th1細胞聚集在病毒感染的部位而發揮Th1型免疫應答,48小時病毒復制達最高峰,此時IP-10的分泌也達頂峰,可使IL-12等細胞因子聚集,為募集Th1細胞創造條件,激活初始T細胞,進而啟動適應性免疫應答;此外,它直接抗病毒作用的發揮也使DEN2在BMDC內的核酸水平在72小時有所下降。
本課題組研究已證實,小鼠被DEN2感染后,血清中Th1、Th2類細胞因子水平發生變化[22]。在本研究中DEN2感染BMDC后,觀察到TLR7、MyD88及NF-κB的表達變化和IFN-α、IP-10分泌的明顯增加,結合BMDC內DEN核酸水平的變化,可證明在DEN2感染BMDC后,可改變MyD88依賴型信號通路并促進IFN-α、IP-10的產生,抑制病毒的復制,在抗DEN感染的固有免疫應答中發揮一定作用。
1 Murrell S,Wu S C,Butler M.Review of dengue virus and the devel-opment of a vaccine[J].Biotechnology Advances,2011;29(2):239-247.
2 Kawai T,Akira S.The roles of TLRs,RLRs and NLRs in pathogen recognition[J].Immunol,2009;21(4):317-337.
3 Teri L Kissner,Gordon Ruthel,Emily D Cisney et al.MyD88-dependent pro-inflammatory cytokine response contributes to lethal toxicity of staphylococcal enterotoxin B in mice[J].Innate Immunity,2011;17(5):451-462.
4 Monika Avbel J,Simon Horvat,Roman Jerala.The role of intermediary domain of MyD88 in cell activation and therapeutic inhibition of TLRs[J].Immunol,2011;187(5):2394-2404.
5 Appledorn D M,Patial S,McBride A et al.Adenovirus vector-induced innate inflammatory mediators,MAPK signaling,as well as adaptive immune responses are dependent upon both TLR2 and TLR9 in vivo[J].Immunol,2008;181(3):2134-2144.
6 Nembr ini C,Abel B,Kopf M et al.Strong TCR signaling,TLR liglands and cytokine redundancies ensure robust development of type 1 effector T cell[J].Immunol,2006;176(12):7180-7188.
7 Singh S K,Streng-Ouwehand I,Litjens M et al.Design of neo-glycoconjugates that target the mannose receptor and enhance TLR-independent cross-presentation and Th1 polarization[J].Eur J Immunol,2011;41(4):916-925.
8 Humbert J M,Frecha C,Bouafia F A et al.Measles virus glycoprotein-pseudotyped lentiviral vectors are highly superior to vesicular stomatitis virus G pseudotypes for genetic modification of monocyte-derived dendritic cells[J].Virol,2012;86(9):5192-5203.
9 Ferreira C S A,Frenzke M,Leonard V H J et al.Measles virus infection of alveolar macrophages and dendritic cells precedes spread to lymphatic organs in transgenic mice expressing human signaling lymphocytic activation molecule(SLAM,CD150)[J].Virol,2010;84(6):3033-3042.
10 Jakub Siednienko,Thusitha Gajanayake,Katherine A et al.Absence of MyD88 results in enhanced TLR3-dependent phosphorylation of IRF3 and increased IFN-β and RANTES production[J].Immunol,2011;186(4):2514-2522.
11 Taro Kawai,Shizuo Akira.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nature Immunology,2010;11(5):373-384.
12 Bauer S,Pigisch S,Hangel D et al.Recognition of nucleic acid and nucleic acid analogs by Toll-like receptors 7,8 and 9[J].Immunobiology,2008;213(3-4):315-328.
13 Brinkmann M M,Spooner E,Hoebe K et al.The interaction between the ER membrane protein UNC93B and TLR3,7,and 9 is crucial for TLR signaling[J].Cell Biol,2007;177(2):265-275.
14 Carlo Iavarone,Katrin Ramsauer,Andriy V Kubarenko et al.A point mutation in the amino terminus of TLR7 abolishes signaling without affecting ligand binding[J].Immunol,2011;186(7):4213-4222.
15 Sophia Davidson,Gerard Kaiko,Zhixuan Loh et al.Plasmacytoid dendritic cells promote host defense against Acute Pneumovirus infection via the TLR7-MyD88-dependent signaling pathway[J].Immunol,2011;186(10):5938-5948.
16 Kristy J Szretter,Stephane Daffis,Jigisha Patel et al.The innate immune adaptor molecule MyD88 restricts West Nile virus replication and spread in neurons of the central nervous system[J].Virol,2010;84(23):12125-12138.
17 Nadege Ade,Diane Antonios,Saadia Kerdine-Romer et al.NF-κB plays a major role in the maturation of human dendritic cells induced by NiSO4 but not by DNCB[J].Toxicological Sciences,2007;99(2):488-501.
18 Serena Chang,Karen Kodys,Gyongyi Szabo.Impaired expression and function of Toll-like receptor7 in hepatitis C virus infection in human hepatoma cells[J].Hepatology,2010;51(1):35-42.
19 Meredith O’Keeffe,Ben Fancke,Mark Suter et al.Nonplasmacytoid,high IFN-α producing,bone marrow dendritic cells[J].Immunol,2012;188(8):3774-3783.
20 Seo Y J,Hahm B.Type I interferon modulates the battle of host immune system against viruses[J].Adv Appl Microbiol,2010;73:83-101.
21 Peng-Peng Ip,Fang Liao.Resistance to dengue virus infection in mice is potentiated by CXCL10 and is independent of CXCL10-mediated leukocyte recruitment[J].Immunol,2010;184(10):5705-5714.
22 陳文婕,左 麗,潘 宇 et al.DEN2 NGC株感染BALB/c小鼠TH1/TH2類細胞因子產生的差異[J].中國免疫學雜志,2007;23(1):21-24.