肺結核患者合并乙肝病毒感染與發生藥物性肝炎關系的隊列研究
許光輝 陳志宇 甄志斌 蒙是升 湯志強 黃廣軍
肺結核和慢性乙型肝炎在我國是嚴重危害人民健康的常見病和多發病。化療方案中異煙肼(H)、利福平(R)、吡嗪酰胺(Z)是目前殺滅結核菌最強的藥物,但在聯合應用時容易發生藥物性肝損傷,在合并慢性乙肝(HBV)的肺結核患者中,由于本身肝臟存在炎癥壞死,肝損傷就更加嚴重,據研究報告發生率達50%左右或更高[1-4]。關于結核病患者的肝損害研究多數為回顧性分析,不能獲得病因關系。因此,筆者使用隊列分析的研究方法對本所治療的結核患者進行了追蹤分析,現報告如下。
1 資料與方法
1.1 一般資料 選擇2009年10月1日-2012年2月1日在本所進行抗結核治療的初治結核患者,年齡14~65歲,治療前肝功能正常,并排除乙肝病毒外的其他病毒性肝炎感染和HIV感染。肺結核診斷標準參照2001年中華醫學會的肺結核診斷和治療指南。暴露因素為合并慢性乙肝病毒感染。暴露組人群為在研究人群內乙肝表面抗原陽性的肺結核患者,共計87例。對照人群:采取內對照隨機1:1配對原則進行選取,共計87例(匹配因素為性別相同;年齡相差3歲以內,開始抗結核治療時間相差不超過1周)。
1.2 實施方法
1.2.1 所有患者使用治療方案 2HRZE(S)/4HR;間歇或每日療法,藥物劑量按指南規定使用。
1.2.2 在治療前調查一般人口學特征 包括年齡、性別、職業、戶籍、民族,并告知患者堅持治療。治療前均進行痰抗酸桿菌、肝功能、肝炎病毒標志物、HIV抗體、胸部X線等檢查。治療過程中強化期每2周復查一次肝功能,鞏固期每一月復查一次,并同時詢問患者是否出現惡心嘔吐、乏力、納差、厭油厭食、腹痛腹瀉腹脹、發熱皮疹關節痛、黃疸。當出現相關癥狀或其他不適時及時就診并增加檢查次數。
1.2.3 觀察終點及終點事件 發生抗結核藥物誘導的藥物性肝炎;完成6個月的觀察時間。
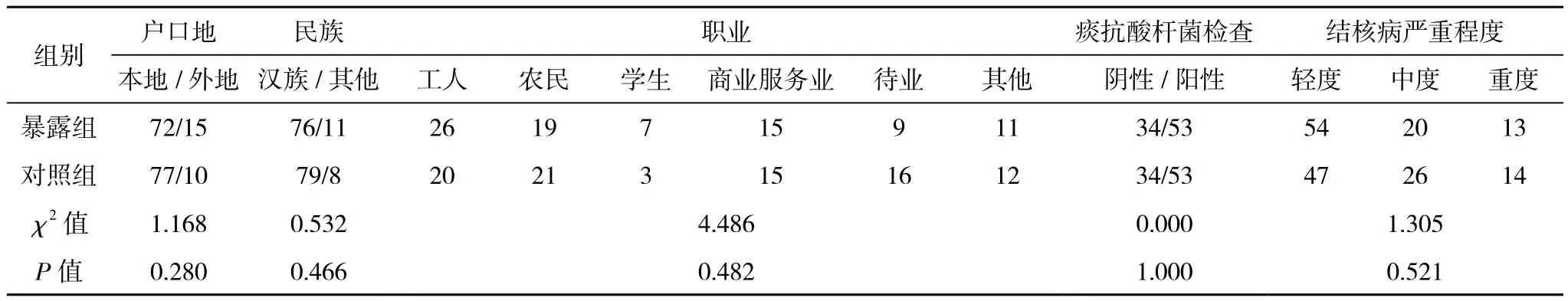
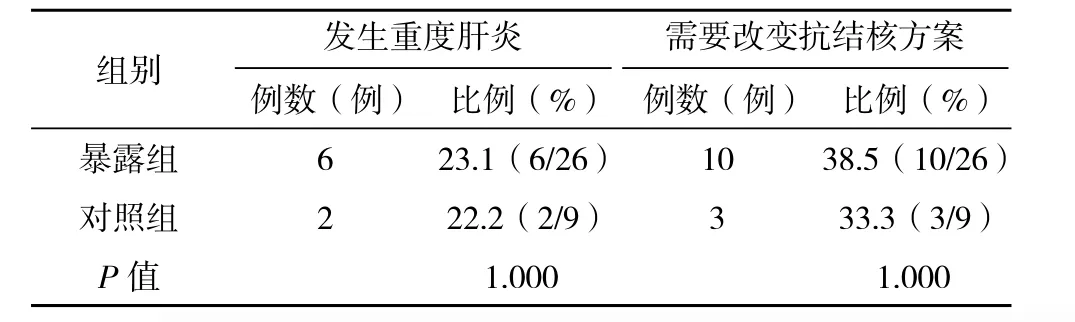
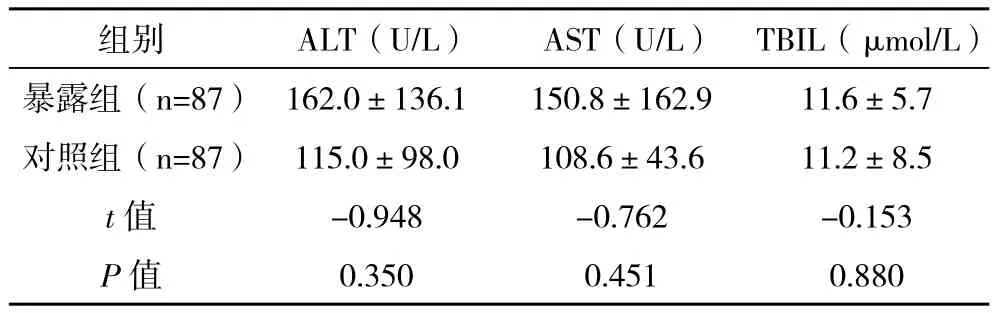
1.3 抗結核藥物誘導肝炎診斷標準 藥物性肝炎診斷標準[5-6]:治療前肝功能正常;藥物使用標準劑量;有或無肝炎癥狀;治療后丙氨酸氨基轉移酶(ALT)和/或天門冬酸氨基轉移酶(AST)超過正常上限2倍,伴或不伴有血清總膽紅素(TBIL)異常(正常上限:ALT:37 IU/L;AST:40 IU/L;TBIL:22.0 μmol/L);停藥后肝功能正常或明顯好轉。排除發生其他原因引起的肝損傷。重度藥物性肝炎:5 ULN≤ALT/AST或ULN 1.4 質量控制 1.4.1 對研究人群的患者進行準確的試驗前檢查避免部分患者不能進入試驗,降低選擇偏倚。詳細告知和主動電話隨訪要求患者規則回訪是本實驗的關鍵。 1.4.2 由研究者本人進行每一次的對照組的隨機匹配。參與研究人員為科研和臨床經驗豐富的醫生。由本人對隨訪內容進行詳細講解,并制作成表,保證了對研究內容的正確和統一理解,減少信息偏倚,回收表時,由本人進行及時核查,發現錯填、漏填情況時,隨時更改或再次電話聯系進行補充,確保調查信息的完整性和正確性。 1.4.3 實驗室檢查均在本單位進行,使用統一的儀器和標準,而且本單位實驗室檢測具有較好的質量控制。 1.4.4 數據錄入時使用Epi-data 3.1軟件建立數據庫,資料由本人統一錄入,并通過設計程序控制對錄入的數據進行邏輯糾錯;每錄入一份調查表即進行核對,及時發現錯誤并糾正。 1.5 統計學處理 采用Epi-data建立數據庫,所有資料經檢查、核對后由本人統一錄入計算機。所有數據采用SPSS 11.0軟件包進行統計分析,正態連續型資料以(±s)表示,離散型資料用率或構成比描述,比較采用 字2檢驗,多組均數比較采用方差分析,均數兩兩比較采用LSD-t檢驗,檢驗水準α=0.05。 2.1 一般情況 入選暴露組病例87例,失訪5例,失訪率5.7%。男67例,女20例,男女性別比例為3.4:1,平均年齡(35.6±12.9)歲。對照組87例,平均年齡(35.8±12.2)歲。兩組人群在戶口地、民族、職業構成、痰抗酸桿菌、結核病影像嚴重程度方面差異無統計學意義(P>0.05)。詳見表1。 表1 兩組人群一般特點比較 2.2 抗結核藥物誘導藥物性肝炎的發病率 2.2.1 暴露組中26例患者發生藥物性肝炎,發病率為29.9%,由于有失訪,經校正后發病率為30.8%。對照組中9例發生患者發生藥物性肝炎,發病率為10.3%,校正后發病率為10.7%。暴露組發生抗結核藥物誘導肝炎的發病率高于對照組,差異有統計學意義( 字2=10.336,P=0.001)。相對危險度RR為2.9 ( 字2=10.28),95%的置信區間是(1.51,5.55),表明乙肝病毒感染與肺結核患者發生藥物性肝炎之間存在關聯。歸因危險度AR為20.1,歸因危險度百分比AR%為65.3%。但兩組在發生重度肝炎和發生需要改變抗結核治療方案的患者方面差異無統計學意義(P>0.05)。詳見表2。 表2 兩組發生重度肝炎和需要改變抗結核治療方案方面比較 2.2.2 兩組發生藥物性肝炎時的轉氨酶水平 慢性乙肝組的患者發生藥物性肝炎時轉氨酶水平均高于對照組,但差異無統計學意義(P>0.05)。詳見表3 表3 兩組患者發生藥物性肝炎時的肝功能指標比較(±s) 表3 兩組患者發生藥物性肝炎時的肝功能指標比較(±s) 組別 ALT(U/L) AST(U/L) TBIL(μmol/L)暴露組(n=87) 162.0±136.1 150.8±162.9 11.6±5.7對照組(n=87) 115.0±98.0 108.6±43.6 11.2±8.5 t值 -0.948 -0.762 -0.153 P值 0.350 0.451 0.880 我國是世界結核病高負擔國家,又是乙肝大國,兩者合并感染率達13%[7]。標準的短程化療方案是治療結核病的基石,聯合應用常常發生藥物性肝炎。有學者認為抗結核藥物是發展中國家誘發肝損害甚至急性肝衰竭最重要的原因,合并HBV會導致更容易發生肝損傷[8-10]。 多數學者認為,HBV感染者其肝功能指標即使在正常范圍,但肝細胞均有不同程度炎性改變及少量肝細胞的點狀壞死[11],當肝臟有病理改變時,肝血流灌注障礙,肝血流量減少,其解毒、排泄功能及儲備和再生能力下降。同時肝病時藥物與血漿白蛋白結合能力下降,藥物的半衰期延長,游離藥物濃度增高,增加了藥物的肝臟毒性,而且雙重感染患者的肝損害在病理上也比單一感染嚴重[12]。由于HRZ均具有潛在的肝毒性,那么在有基礎肝病的患者中,各種進入肝臟的藥物會加劇肝代謝負擔,導致肝損害加重而發病。 在抗結核治療過程中慢性乙肝患者是否更容易發生藥物性肝損害仍然存在較大爭議。De Castro等[13]的前瞻性研究發現肺結核患者合并HBV感染雖然表現出一定的發生藥物性肝損傷危險度,但無統計學意義。國內陳志飛等[14]發現合并乙肝的患者更容易發生中重度肝損害,而在藥物性肝炎發生率方面和無乙肝的結核病患者無統計學意義的差異。 筆者的研究使用前瞻性隊列研究,可以獲得發病率,同時使用了隨機配對的原則選取對照,在入組時匹配了年齡、性別,而且兩組人群在一般人口學特征和疾病本身特點方面的基線數據均無明顯差異,進一步避免了多個混雜因素對病因的干擾。研究結果發現合并慢性乙肝的肺結核患者藥物性肝炎發病率為30.8%,是對照組的2.9倍,明顯高于乙肝表面抗原陰性的患者。同時筆者的研究發現,發生藥物性肝炎時,合并慢性乙肝組的轉氨酶的水平高于無乙肝的患者,但并無統計學差異。筆者的研究中藥物性肝炎發病率偏低的原因:一是多數研究采用回顧性分析,二是采用的肝炎判定標準不同,三是入選病例基礎肝功能狀況及肝炎病毒載量構成不同。但是不同的研究均表明,乙肝病毒感染是發生藥物性肝損害的危險因素[1-2,4,9,15]。 筆者的結果顯示,兩組發生重度肝炎與需要調整藥物的差異方面無統計學意義,表明乙肝患者使用標準的治療方案是可行的,與國內研究結果相似[14]。而且即使發生藥物性肝炎后,可以使用雙環醇、還原型谷胱甘肽、甘草酸制劑等來保護肝臟,必要時可以采用利福噴汀、喹諾酮類、氨基糖苷類等低肝毒性藥物來保證治療的持續性[3,14]。因此,提示在對待基礎肝功能正常的慢性乙肝肺結核患者,制定抗結核治療方案時仍應該堅持首選一線抗結核藥物的原則,不能由于過度片面地擔心肝炎的發生而導致不合理、不夠強力的治療措施,影響治療效果,更會增加病患的經濟負擔。 通過本研究筆者發現,乙肝病毒感染是肺結核患者抗結核治療過程中發生藥物性肝炎的病因之一。對于肺結核患者抗結核治療前進行乙肝標志物和肝功能的檢驗,以及在抗結核治療期間嚴密監測,必要時聯合護肝治療是具有重要意義的。 [1]潘朝霞,段愛玲.HBV-M陽性肺結核患者抗結核治療肝功能損害臨床分析[J].中國防癆雜志,2009,31(7):413-414. [2]黃麗華,耿文奎,張靜,等.781例初治肺結核患者抗結核組合藥物間歇療法肝損害的調查[J].中華流行病學雜志,2009,30(3):286-289 [3]蔣瑞華,許家璉.抗結核化療對乙肝病毒標志物陽性者肝功能損害及對策[J].臨床肺科雜志,2005,10(1):42-44. [4]潘越峻,張春蘭,范慧敏,等.合并慢性乙型肝炎對抗癆治療肺結核患者療效的影響[J].實用肝臟病雜志,2008,11(3):171-173. [5]Dssing M,Wilcke J T R,Askgaard D S, et al.Liver injury during antituberculosis treatment :an 11-year study[J].Tubercle and Lung Disease,1996,77(4):335-340. [6]郭英江,崔德健.抗結核藥所致肝損害[J].中華結核和呼吸雜志,1998,21(5):308-309. [7]李飛躍,申輝,楊華林,等.涂陽肺結核合并乙型肝炎流行病學分析[J].實用預防醫學,2010,17(2):280-281. [8]Devarbhavi H.Antituberculous drug-induced liver injury: current perspective[J].Trop Gastroenterol,2011,32(3):167-174 [9]Huang L H, Geng W K, Zhang J,et al.Study on liver damage caused by anti-TB drug intermittent treatment on patients with HBV-TB coinfection[J].Zhonghua Liu Xing Bing Xue Za Zhi,2009,30(3):286-9 [10]李仁龍,劉靖元,馬翔,等.抗結核化療對乙型肝炎病毒陽性肺結核病人的肝功能影響[J].中國防癆雜志,2006,28(增刊):26-27. [11]Byoung Hoon Lee,Won-Jung Koh, Moon Seok Choi,et al. Inactive Hepatitis B Surface Antigen Carrier State and Hepatotoxicity During Antituberculosis Chemotherapy[J].Chest,2005,127(4):1304-1311. [12]許偉華,車曉文,姚桂芹,等.乙型肝炎病毒合并結核菌感染時的肝功能變化[J].中華傳染病雜志,2002,20(2):116-117. [13]De Castro L,Do Brasil P E, Monteiro T P, et al.Can hepatitis B virus infection predict tuberculosis treatment liver toxicity? Development of a preliminary prediction rule[J]. Int J Tuberc Lung Dis,2010,14(3):332-340. [14]陳志飛,韓丹,孫學智.乙肝表面抗原攜帶狀態結核患者抗結核治療對肝損害的影響分析[J].中國防癆雜志,2007,29(4):343-345. [15]許光輝,陳維清,陳華,等.抗結核藥物誘導肝損傷的影響因素探討[J].藥物流行病學雜志,2008,17(6):377-380.2 結果
3 討論

