放療聯合唑來膦酸治療骨轉移癌止痛療效分析
陳寶玉 張鳴竹 房振羽
骨是晚期惡性腫瘤常見的轉移部位,多引起頑固性疼痛和功能障礙,嚴重影響患者的生活質量,放射治療是較好的治療方法之一,但多數患者為多發骨轉移且病灶受部位影響而使放療受限制,提示臨床工作者應探索放射治療聯合其他方法治療骨轉移癌。現將本科室2008年5月-2011年5月收治的62例骨轉移癌單純放療及放療聯合唑來膦酸治療報告如下。
1 資料與方法
1.1 一般資料 將2008年5月-2011年5月本科室收治的62例骨轉移癌放射治療患者,隨機分為放療聯合唑來膦酸組31例和單純放療組31例。放療聯合唑來膦酸組:男20例,女11例;年齡38~81歲,中位年齡59歲;疼痛:重度15例,中度11例,輕度5例。單純放療組:男22例,女9例;年齡39~81歲,中位年齡58歲;疼痛:重度16例,中度10例,輕度5例。全組病例預計生存時間大于3個月,無心肺功能嚴重不全。原發病灶均病理學診斷,骨轉移病灶均經X線片、CT、ECT、MRI、PET-CT中兩種以上影像檢查明確診斷,34例單發,28例多發。
1.2 治療方法 放射治療采用西門子PRIMUS M型直線加速器6MVX射線或15MVX射線或電子線。根據患者病情及全身狀況不同而給予放療分次劑量不等。對行走嚴重困難給予大分割,每次Dt 3 Gy,每周5次,總量30 Gy;其余給予常規分割,每次Dt 2 Gy,每周5次,總量40~50 Gy。放療聯合唑來膦酸組,第1天唑來膦酸4 mg靜滴,每4周重復,共用4~6個周期。第2天開始行放射治療。
1.3 觀察指標及判斷標準
1.3.1 疼痛評價標準 VRS法分為四級。0級:無疼痛;Ⅰ級:疼痛可忍受,能正常生活,睡眠不受干擾;Ⅱ級:疼痛明顯,不能忍受,要求服用鎮痛藥,睡眠受干擾;Ⅲ級:疼痛劇烈,不能忍受,需要服用鎮痛藥,睡眠嚴重受干擾,可伴有植物神經功能紊亂表現或被動體位[1]。
1.3.2 止痛療效評價標準 完全緩解(CR):治療后完全無痛;部分緩解(PR):疼痛較治療前明顯減輕,睡眠基本不受影響,能正常生活;輕度緩解(MR):疼痛較前減輕,但仍明顯,睡眠受干擾;無效(NR):與治療前相比無減輕。總有效率為CR+PR+MR。
1.3.3 活動能力分級 0級:活動自如;Ⅰ級:活動受限;Ⅱ級:活動明顯受限;Ⅲ級:完全不能活動。
1.3.4 活動能力的改善評價標準 顯效:活動能力提高2級以上;有效:提高1級者;無效:未提高或降低者。
1.4 統計學處理 采用SPSS 10.0統計軟件,計數資料行字2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組止痛效果比較 放療前疼痛分布:單純放療組Ⅰ級5例;Ⅱ級例15;Ⅲ級11例。放療聯合唑來膦酸組Ⅰ級4例;Ⅱ級16例;Ⅲ級11例。放療后疼痛分布:單純放療組0級13例,Ⅰ級6例,Ⅱ級7例,Ⅲ級5例。放療聯合唑來膦酸組0級18例,Ⅰ級7例,Ⅱ級5例,Ⅲ級1例。單純放療組緩解22例,總有效率71%;放療聯合唑來膦酸組緩解29例,總有效率93.5%,兩組總有效率比較,差異有統計學意義(字2=5.42,P<0.05)。見表1。
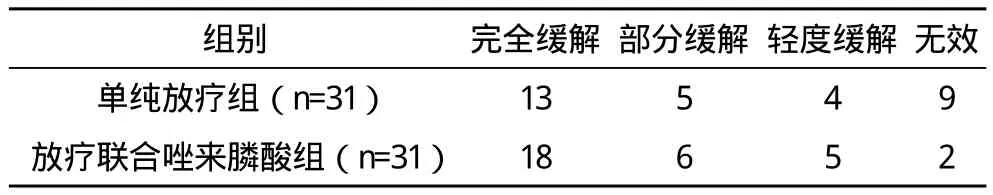
表1 治療后兩組止痛效果比較 例
2.2 兩組活動能力改善情況比較 治療后兩組活動能力均有改善。放療前活動能力情況:單純放療組Ⅰ級14例;Ⅱ級15例;Ⅲ級2例。放療聯合唑來膦酸組Ⅰ級10例;Ⅱ級20例;Ⅲ級1例。放療后活動能力情況:單純放療組0級17例,Ⅰ級8例,Ⅱ級5例,Ⅲ級1例。放療聯合唑來膦酸組0級23例,Ⅰ級5例,Ⅱ級3例,Ⅲ級0例。單純放療組顯效11例,有效8例,無效12例,總有效率61.3%;放療聯合唑來膦酸組顯效15例有效11例,無效5例,總有效率83.9%,兩組比較,差異有統計學意義(字2=3.97,P<0.05)。見表2。

表2 治療后兩組活動能力改善情況 例
2.3 不良反應 主要不良反應為白細胞下降及惡心及嘔吐,主要為照射野包及部分消化器官,聯合組有患者出現發熱及肌肉酸痛。
3 討論
骨是中晚期惡性腫瘤常見遠處轉移器官,僅次于肺、肝。骨轉移可導致劇烈疼痛、功能活動障、病理性骨折、高鈣血癥、脊髓壓迫,可以加快病情的發展,是患者生活質量下降和死亡的主要原因之一。
骨轉移癌最常見于乳腺癌、肺癌、前列腺癌、甲狀腺癌及多發性骨髓瘤的骨破壞,轉移癌發生部位以椎骨、骨盆骨及肋骨最為多見,約占80%左右,其次為股骨、顱骨、和肱骨。骨轉移癌的預后依原發病的不同而異。骨轉移癌治療方法有手術、化學治療、放射治療、內分泌治療、雙膦酸鹽、止痛藥等。
放射治療可有效地緩解大多數骨轉移引起骨疼痛和神經痛。放射治療骨轉移癌止痛作用又快又好,骨轉移癌放療后80%~90%的患者可以獲得較持久的止痛效果,同時也有延長生存期的作用[2]。放射治療緩解疼痛的機制尚不完全清楚,化學性疼痛介質釋放減少和受到抑制可能是放療作用的主要機制,在數天內疼痛開始緩解應主要歸因于各種化學疼痛介質的減少,而長期持續緩解效應則應歸因于腫瘤負荷減少和重新鈣化[3]。但多數患者為多發骨轉移且病灶受部位影響而使局部放療受限制,而要加用全身治療。
唑來膦酸是一種特異性地作用于骨的二磷酸化合物,它能抑制因破骨活性增加而導致的骨吸收。主要作用機制是通過抑制破骨細胞的活化和活化破骨細胞的增生來抑制骨吸收,減少骨基質生長因子的釋放或抑制癌細胞粘附于骨基質;抑制破骨細胞的對骨小梁的溶解和破壞,從而阻滯腫瘤引起的溶骨性病變、減少骨吸收、減輕疼痛及降低由骨轉移所致的高鈣血癥及其他并發癥的發生率;通過抑制甲醛戊酸途徑,阻滯細胞周期來誘導破骨細胞和單核細胞前體細胞的凋亡,從而達到抑制骨吸收的目的;具有直接的體內、外抗腫瘤作用[4-5]。故放射治療聯合唑來膦酸兩者可以在時間和空間起協同作用,共同發揮控制疼痛,在緩解骨痛的同時,對骨轉移癌有明顯的治療作用,可保護和修復被破壞骨質的功能,明顯延緩病變的進展;可以降低骨轉移癌患者發生骨相關事件的風險,改善生活質量,為骨轉移癌患者帶來臨床益處[6-7]。
本報道骨轉移癌單純放療止痛總有效率71%,比大多數文獻報道低,主要原因為本研究病例有部分患者為多發骨轉移,且有些病灶放療受限制。放療聯合唑來膦酸止痛總有效率93.5%,與單純放療組比較,差異有統計學意義(字2=5.42,P<0.05)。治療后兩組活動能力均有改善。單純放療組總有效率61.3%,放療聯合唑來膦酸組總有效率83.9%,兩組比較,差異有統計學意義(字2=3.97,P<0.05)。骨轉移癌放射治療的目的在于緩解患者疼痛,保持功能。特別是負重骨的功能,改善生活質量[8]。故放療聯合唑來膦酸能提高放療效果,特別對多發骨轉移癌有些病灶放療受限制,更能顯示出超過單純放療的優勢。
盡管近10年來,對骨轉移癌發生機制、防治方法等方面進行了大量研究,目前仍未找到有效的根治手段。骨轉移癌的放射治療是一種姑息性治療,以減輕或控制骨痛,預防或減少病理性骨折等相關癥狀發生,保持骨的穩定性為治療目的。因此,設計照射方式時應多方面考慮,以既方便、經濟,止痛效果又好,而且不出現嚴重的治療反應為原則。對預期生存期短的患者可給予大分割。有些患者局部放療1~2次后,疼痛不僅沒有好轉。甚至加重者,可能與放療后組織充血有關,其后可以逐步緩解。
綜上所述,放療聯合唑來膦酸治療骨轉移癌,止痛效果好,使患者活動能力得到了改善。與單純放療比較未增加明顯毒副作用,是一種臨床值得應用的惡性腫瘤骨轉移癌治療方法,特別是對多發骨轉移灶患者,有部分病灶不能行放療者。臨床上,需要醫生根據患者具體情況,合理選用治療方法,最大限度地減輕患者的痛苦,提高生存質量,延長生存期。
本研究未對患者生存率進行研究,且病例數偏少,故目前該方案治療優點需要大宗的臨床試驗進一步研究,及治療結束后如何鞏固療效有待更進一步研究。
[1]孫燕,石遠凱.癌癥疼痛的處理[M].北京:人民衛生出版社,2007:258-260.
[2]谷銳之.腫瘤放射治療學[M].北京:北京醫科大學中國協和醫科大學聯合出版社,1993:817.
[3]陸軍,鄧敬蘭,趙海濤,等.脊柱轉移癌放療聯合椎體成形術治療的前瞻性研究[J].中華放射腫瘤學雜志,2005,14(1):42.
[4]Evdokiou A, Abrinidis A. Induction of cell death of human osteogenic sarcoma cells by zoleroniacid resembles anoikis[J]. Bone,2003,33(2):216.
[5]Nevile-Webbe H, Coleman R E. The use of zoledronic acid in the management of metastatic bone disease and hypercalcagemia[J]. Palliat Med,2003,17(6):539.
[6]吳瑾,周莉華,蔣曉東.唑來膦酸聯合放療治療骨轉移癌的臨床療效[J].現代腫瘤醫學,2008,16(1):110-111.
[7]吳云峰,雷俠.單純放療與放療聯合唑來膦酸治療骨轉移瘤臨床觀察[J].現代腫瘤醫學,2008,16(1):112-113.
[8]朱國培摘譯.美國放射學院的合理治療原則[J].中華放射腫瘤學雜志,2000,9(4):287.

