黏著斑激酶在2 型糖尿病大鼠腎組織中的表達變化及意義*
李 霜, 王圓圓, 劉麗榮, 石 磊, 石明雋, 肖 瑛, 張國忠, 郭 兵
(貴陽醫學院病理生理學教研室,貴州 貴陽550004)
糖尿病(diabetes mellitus,DM)作為一組遺傳和環境相互作用引起的代謝綜合征,患病率正逐年上升。糖尿病腎病(diabetic nephropathy,DN)已成為導致終末期腎衰竭及DM 病死率增加的重要原因,但DN 的發生機制仍未充分闡明。近來研究表明,黏著斑激酶(focal adhesion kinase,FAK)作為一種非受體型蛋白酪氨酸激酶,在肝纖維化及心肌纖維化組織中表達增多和磷酸化增強,而FAK 的內源性抑制因子FRNK(FAK-related non-kinase)的表達卻減少,提示FAK 在臟器纖維化過程中可能發揮重要作用[1-3]。但在2 型糖尿病(the type 2 diabetes mellitus,T2DM)中,腎組織中FAK 蛋白的表達變化及意義仍不清楚。我們前期研究發現,DM 大鼠血糖、血肌酐、血甘油三酯、血總膽固醇及24 h 尿蛋白量較對照組均顯著升高,但血清胰島素水平與對照組相比無明顯差異;HE 染色下見正常組腎小球形態完整,輪廓清晰,腎小管未見異常;DM 16 周組大鼠腎小球體積增大和系膜基質增多,腎小管管腔擴張,上皮細胞脫落,部分腎小管基底膜不完整,間質可見炎癥細胞浸潤[4]。為此,本研究采用高脂高糖飲食加小劑量鏈脲佐菌素(streptozocin,STZ)腹腔注射的方法,復制大鼠T2DM 模型,并觀察FAK 在T2DM 大鼠腎組織中的動態變化,探討FAK 在DN 發病機制中的作用及可能機制。
材 料 和 方 法
1 材料
1.1 動物 SD 大鼠30 只,雄性,體重(200 ±20)g,由貴陽醫學院實驗動物中心提供,清潔級。
1.2 主要試劑 STZ 購自Sigma;纖維連接蛋白(fibronectin,FN)兔多克隆抗體、FAK 兔多克隆抗體、轉化生長因子β1(transforming growth factor beta 1,TGF-β1)兔多克隆抗體和細胞外信號調節激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)兔多克隆抗體購自武漢博士德公司;p-FAK(Tyr397)兔多克隆抗體購自博奧森生物技術有限公司;p-ERK1/2 兔多克隆抗體購自Santa Cruz;總RNA 提取試劑盒、2 ×Taq PCR MasterMix、1 500 bp DNA Marker 購自天根生化科技有限公司;RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas);胰島素測定試劑盒購自天津九鼎生物醫學工程有限公司;考馬斯亮藍測定試劑盒購自南京建成生物工程研究所;血糖、血肌酐、甘油三酯和總膽固醇測定試劑盒購自四川邁克科技有限公司;FAK 及β-actin 引物均由大連寶生物工程技術有限公司合成。兩步法免疫組化檢測試劑購自北京中杉金橋生物技術有限公司;Western 印跡用PVDF 膜和Whatman 3 mm 濾紙購自Millipor;超敏ECL 化學發光試劑盒購自碧云天生物研究所。
1.3 主要器材 強生穩步倍加型血糖儀(強生公司),超低溫冰箱(Sanyo),高速低溫離心機(Beckman),電泳系統及電轉移裝置(Amersham),凝膠成像系統(Bio-Rad),梯度PCR 擴增儀(Bio-Rad),超凈工作臺(蘇州凈化設備有限公司),瞬時離心機(上海捷瑞公司),Olympus 圖象采集系統(Olympus)。
2 方法
2.1 糖尿病模型的制備和分組 將SD 大鼠隨機分成正常對照組(NC,n =6)和高脂高糖組(HG,n =24)。大鼠適應性飼養1 周后,HG 組以高脂高糖飼料喂養,飼料組成如下:67%常規飼料、20% 蔗糖、10%豬油、2%膽固醇、1%蛋黃。喂養12 周時,稱體重,測空腹血糖,尾動脈取血測血清胰島素水平;HG組飼養12 周后又隨機分為高脂高糖對照組(HC,n=6)和糖尿病組(DM,n =18),DM 組大鼠按30 mg/kg劑量腹腔注射STZ (以pH 4.5、0.01 mol/L 無菌檸檬酸緩沖液配成1%濃度)。72 h 后測空腹血糖,血糖≥13.8 mmol/L 作為2 型糖尿病大鼠,18 只大鼠全部建模成功,成模大鼠隨機分為糖尿病8 周組(DM8,n =6)、12 周組(DM12,n =6)和16 周組(DM16,n =6)。NC 組以常規飼料喂養,各組大鼠均自由飲水。
2.2 動物標本的采集 分別于實驗的第20 周、24周和28 周(即糖尿病8、12 和16 周)處死DM8、DM12 和DM16 各組大鼠,于第28 周處死NC 和HC組大鼠。處死前1 d 代謝籠收集24 h 尿液,記錄尿量。禁食6 ~8 h,麻醉后稱體重,股動脈放血、收集血液,4 ℃離心,分離血清,-20 ℃保存;處死大鼠,開腹取腎臟,稱重,一側腎臟固定于4%多聚甲醛供制作石蠟切片用,另一側腎臟于-80 ℃保存供Western blotting 和RT-PCR 檢測。
2.3 免疫組化染色 采用免疫組化SP 法檢測TGFβ1(1 ∶50)、FN(1 ∶100)、FAK(1 ∶50)、ERK1/2(1∶100)和p-ERK1/2(1∶100)在各組大鼠腎組織的分布和表達,PBS 作為陰性對照,DAB 顯色,蘇木素復染。蛋白陽性表達計數方法參考本實驗室既往的研究[6],計數10 個高倍視野(400 倍),取均值。
2.4 Western blotting 檢測 取-80 ℃保存的各組大鼠腎皮質,每組100 mg,分別加入組織蛋白提取液后勻漿、離心、取上清,用BCA 試劑盒(碧云天)測定各組蛋白質濃度,按所測得濃度計算每泳道所需體積,加入加樣緩沖液煮沸10 min。經10% SDSPAGE 凝膠電泳分離,再轉移至PVDF 膜上,脫脂奶粉室溫封閉1 h,加入FAK、p-FAK (Tyr397)或β-actinⅠ抗,工作濃度分別為1∶150、1∶100 和1∶300,4℃孵育過夜。次日用TBST 洗膜后,加入相應的辣根過氧化物酶標記的Ⅱ抗(濃度均為1∶5 000)室溫孵育1 h,ECL 化學發光試劑,暗室曝光,Bio-Rad 凝膠成像系統掃描膠片,Quantity One 軟件分析各條帶的面積和灰度值,兩者乘積為積分灰度值,每個樣本重復操作3 次。以同一張膠上 FAK 和 p-FAK(Tyr397)與相應的β-actin 條帶所測積分灰度值的比值,即相對積分灰度值對FAK 和p-FAK (Tyr397)蛋白進行半定量。
2.5 RT-PCR 檢測腎組織FAK mRNA 的表達
TRIzol一步法提取大鼠腎皮質的總RNA,核酸蛋白儀測RNA 的濃度和純度(A260/A280均在1.8 ~2.0 之間),取4 μg 腎組織總RNA 按RevertAidTMFirst Strand cDNA Synthesis Kit 說明進行逆轉錄,合成cDNA,-20 ℃保存備用。以cDNA 為模板進行FAK和β-actin(作為內參照)共同擴增。FAK 上游引物5'-ACTTGGACGCTGTATTGGAG-3',下游引物5'-CCTGTTGCCTTTCTGGATAC-3',產物985 bp;β-actin 上游引物5’-GAAATCGTGCGTGACATTAAG-3’,下游引物5’-CTAGAAGCATTTGCGGTGGA-3’,產物490 bp。擴增條件:94 ℃預變性5 min,進入循環:94 ℃45 s,59.2 ℃45 s,72 ℃60 s,35 個循環后,再72 ℃10 min。反應產物做1. 5% 瓊脂糖凝膠電泳,Bio-Rad 凝膠成像系統掃描,應用Quantity One 軟件將各FAK 條帶的吸光度值與β-actin 條帶吸光度值的比值作為FAK 相對表達水平參數,進行半定量分析。
3 統計學處理
數據以均數±標準差(mean ± SD )表示,采用SPSS19.0 軟件處理,多組數據差異比較用ANOVA分析,兩組間數據相關性比較用直線相關分析。以P <0.05 為差異有統計學意義。
結 果
1 大鼠一般情況
實驗過程中,糖尿病大鼠呈現明顯多尿、多飲、多食,生長緩慢,血糖維持在較高水平(≥13. 8 mmol/L)。單純高脂高糖組大鼠無上述表現,體重增長顯著,血糖無明顯升高。
2 免疫組化結果
各組大鼠腎小管上皮細胞胞漿均可見FAK 蛋白表達,DM12 和DM16 組FAK 蛋白表達較NC 組和HC 組顯著增加(P <0.05),見圖1。
TGF-β1在NC 和HC 組腎組織幾乎無表達。DM8 組腎小管上皮細胞TGF-β1表達較NC 組和HC組顯著增多(P <0.05),表達隨病程進展明顯升高且持續高表達至DM16 組,見圖1。
NC 和HC 組ERK1/2 在腎小管上皮細胞胞漿內表達,且有少量p-ERK1/2 表達,并可見核表達。隨糖尿病進展ERK1/2 表達無明顯增加,但DM8 組p-ERK1/2 在腎小管上皮細胞胞漿內的表達較NC 組和HC 組顯著增多(P <0.05),且核內表達也明顯增多,并持續高表達到糖尿病形成后16 周,見圖1。
各組大鼠腎組織中FN 沿腎小管基底膜呈線性分布。在NC 和HC 組腎組織中,FN 可見少量表達。DM8 組FN 表達增多且較NC 組和HC 組明顯增加(P <0.05),隨病程發展逐漸增多,至DM16 組達到高峰,見圖1。
3 Western blotting 結果
NC 組和HC 組大鼠腎組織有FAK 總蛋白和p-FAK(Tyr397)表達,兩組無顯著差異,DM8 組FAK和p-FAK(Tyr397)表達無明顯增加(P >0. 05),DM12 組和DM16 組FAK 和p-FAK(Tyr397)表達較NC 組、HC 組及DM8 組顯著增多(P <0.05),且p-FAK(Tyr397)與FAK 總蛋白表達趨勢一致,見圖2。
4 RT-PCR 結果
NC 和HC 組有FAK mRNA 表達,DM8 組無明顯增加,DM12 和DM16 組FAK mRNA 比NC、HC 組及DM8 組表達明顯增加(P <0.05),見圖3。
5 相關性分析
腎皮質中FAK 與TGF-β1、p-ERK1/2、FN 陽性蛋白表達隨DM 病情進展呈增多趨勢,相關性分析結果顯示,DM12 和DM16 組FAK 與TGF-β1、p-ERK1/2、FN 呈顯著正相關(r 值分別為0. 792、0. 558 和0.593,P <0.01)。
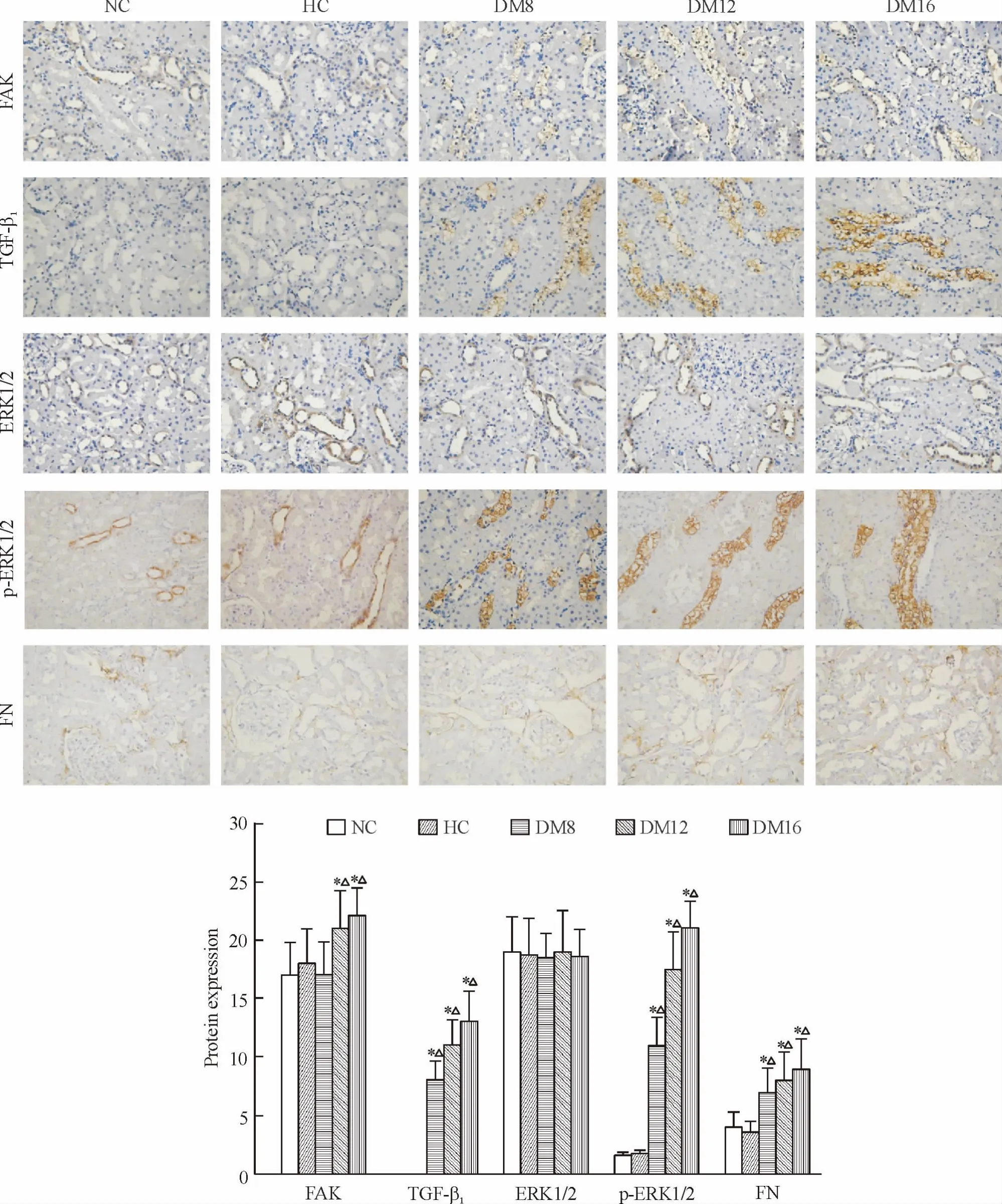
Figure 1. Expression of FAK,TGF-β1,ERK1/2,p-ERK1/2 and FN proteins in renal tubular cells of rats in each group (immunohistochemical staining,×400). Mean±SD. * P <0.05 vs NC group;△P <0.05 vs HC group.圖1 FAK、TGF-β1、ERK1/2、p-ERK1/2 和FN 蛋白在各組大鼠腎小管上皮細胞中的表達情況
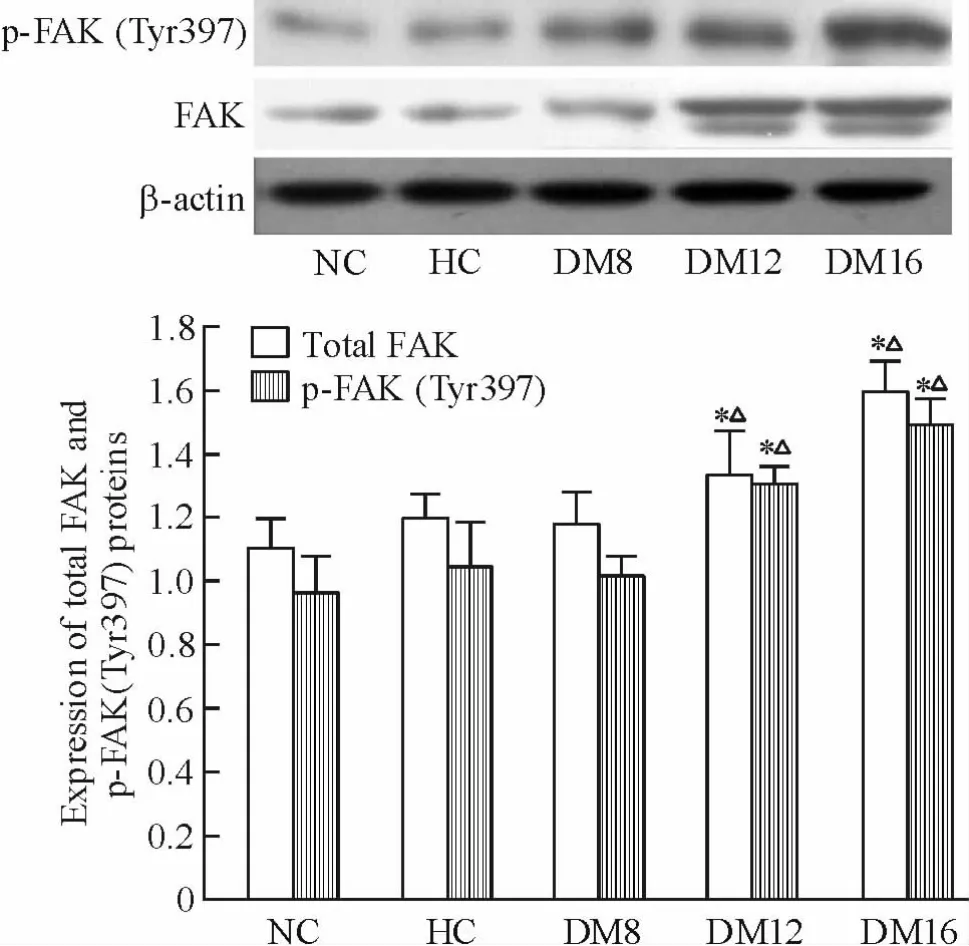
Figure 2. The expression levels of total FAK and p-FAK(Tyr397)in rat kidney tissues in each group detected by Western blotting. Mean ± SD. n = 6. * P <0.05 vs NC group;△P <0.05 vs HC group.圖2 Western blotting 檢測總FAK 和p-FAK(Tyr397)蛋白在各組大鼠腎組織中的表達
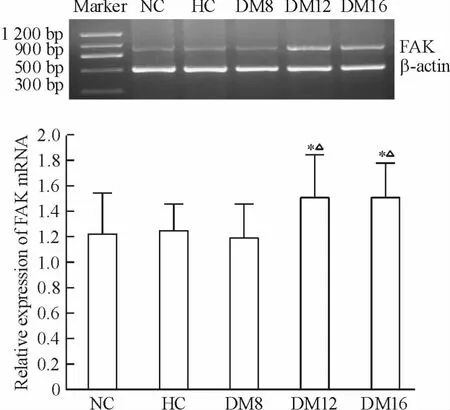
Figure 3. Expression of FAK mRNA in rat renal cortex in each group detected by RT-PCR. Mean ± SD. n =6. * P <0.05 vs NC group;△P <0.05 vs HC group.圖3 RT-PCR 檢測各組大鼠腎皮質FAK mRNA 的表達
討 論
本實驗采用高脂高糖飲食加小劑量STZ 的方法復制2 型糖尿病動物模型,DN 發展為慢性腎衰竭的最終通路是腎小球硬化及腎小管-間質纖維化,但其發病機制尚未充分闡明。TGF-β1是目前已知的致腎纖維化作用最強的多肽因子之一,它能誘導腎臟固有細胞表型轉化及促進胞外基質(extracellular matrix,ECM)增生,在腎小管-間質纖維化進行性發展中起關鍵作用。TGF-β1主要通過激活Smad 通路發揮其致纖維化效應[5-6],同時也可激活其它非Smad通路來促進纖維化病變的發生發展。黏著斑激酶FAK 是一種胞質非受體酪氨酸激酶,有多個酪氨酸磷酸化位點,其中Tyr397 是其自主磷酸化位點,不同的酪氨酸位點的磷酸化可為其它信號轉導分子提供位點[7]。體外研究表明,TGF-β1刺激人腎小管上皮細胞HK-2 能呈時間依賴性促進FAK 總蛋白及p-FAK(Tyr397)的表達,且p-FAK(Tyr397)表達趨勢與FAK 相同[8-9],Shikano 等[10]也發現1 型糖尿病大鼠腎小球內磷酸化FAK 與樁蛋白(paxillin,PL)表達增多,胰島素治療后,腎小球FAK 與PL 的表達明顯減少,提示FAK 可能與糖尿病的發病有關。本研究結果顯示,T2DM 大鼠成模后12 周腎小管上皮細胞中FAK 蛋白及mRNA 表達增加(P <0.05)且持續到16 周,p-FAK(Tyr397)表達趨勢與總FAK 一致,同時DM12、DM16 組的腎小管上皮細胞中FAK 蛋白表達量與TGF-β1呈顯著正相關(P <0.01),提示FAK 可能參與TGF-β1致腎小管間質纖維化的過程。進一步研究發現,FAK 可能參與TGF-β1介導的腎小管上皮細胞向間質細胞轉分化(epithelial-mesenchymal transition,EMT)的發生和發展[9],促進α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)表達增多、E-鈣粘蛋白(E-cadherin)減少,使腎小管上皮細胞轉分化成為肌成纖維細胞從而介導腎間質纖維化。Ding等[11]用TGF-β1刺激人及大鼠肺成纖維細胞后促使FAK、p-FAK(Tyr397)和α-SMA 表達增多,而用FAK的內源性抑制因子FRNK 轉染肺成纖維細胞后,α-SMA 的蛋白表達量下降了約85%。本研究結果亦發現T2DM 大鼠腎組織的FAK 隨著病程進展在蛋白和轉錄水平表達均明顯增多的同時,腎間質ECM 主要成分FN 表達顯著增多,提示在DN 病變過程中FAK 的表達增加,促進了TGF-β1介導腎間質ECM的沉積,使DN 的纖維化病變加重。
但TGF-β1究竟通過何種機制誘導了FAK 表達增加,目前尚不清楚。Walsh 等[12]用TGF-β1刺激IEC-6 細胞(大鼠空腸細胞)和Caco-2BBE 細胞(人結腸細胞)導致FAK 及p-FAK(Tyr397)的蛋白表達量增多后,運用siRNA 技術降低了Smad2 蛋白的表達,使TGF-β1促進FAK 蛋白總量表達增多的效應被阻斷。同樣使用p38 MAPK siRNA 降低p38MAPK蛋白的表達也抑制了TGF-β1誘導的FAK 蛋白總量表達增多的效應。這提示Smad 和p38 MAPK 信號通路在TGF-β1誘導的FAK 蛋白總量增加的過程中起到很重要的作用。而在2 種細胞類型的培養液中同時添加p38 MAPK 阻滯劑SB203580,Smad2/3 依然能被TGF-β1最大程度活化,提示p38 MAPK 并不是Smad 信號通路的上游分子,p38 MAPK 與Smad信號通路是獨立的。推測TGF-β1通過p38 MAPK與Smad 信號通路促進FAK 蛋白的表達。有研究表明,當FAK 活化后可進入Ras 途徑激活位于胞漿內的ERK1/2,被活化的ERK1/2(p-ERK1/2)迅速進入胞核內,可以使轉錄因子如AP-1 磷酸化進而增強FN 基因的轉錄活性,最終導致FN 的產生[13-14]。在本實驗中,隨著FAK 及其磷酸化水平的上調,雖然ERK1/2 總蛋白在NC、HC 和DM 各組大鼠腎小管上皮細胞中的表達無顯著差異,但DM 各組大鼠腎組織中p-ERK1/2 的表達卻顯著升高(P <0.01),進一步證實DM 腎組織中的ERK1/2 的活性明顯高于正常對照組,但蛋白含量無明顯變化[15]。DM 腎小管上皮細胞中p-ERK1/2 表達增多,可使AP-1 活化繼而誘導腎間質FN 的生成增多,增加ECM 成分的表達;同時由于T2DM 大鼠腎組織中p-ERK1/2 與TGF-β1呈顯著正相關(P <0. 01),提示p-ERK1/2還可增強TGF-β1/Smads 信號通路的活性,參與了TGF-β1介導的腎間質纖維化的發病[16]。
總之,本研究表明,在2 型糖尿病時,FAK 可能作為TGF-β1的下游分子之一表達增多以及被活化,并通過活化ERK1/2 使FN 表達增多,從而參與了糖尿病腎病的發生發展。然而在DN 的發展過程中,FAK 表達的上調受哪些因素的影響以及TGF-β1究竟通過何種機制誘導FAK 表達增加,有待進一步研究證實。
[1] 張曉嵐,霍曉霞,申建剛,等. 黏著斑激酶酪氨酸磷酸化促大鼠肝纖維化形成[J]. 基礎醫學與臨床,2007,27(2):143-147.
[2] 劉小菁,傅 華,楊 麗,等. 肝纖維化大鼠肝竇內皮細胞整合素α6β1及粘著斑激酶表達的變化[J]. 中華肝臟病雜志,2001,9(6):349-351.
[3] Taylor JM,Rovin JD,Parsons JT. A role for focal adhesion kinase in phenylephrine-induced hypertrophy of rat ventricular cardiomyocytes[J]. J Biol Chem,2000,275(25):19250-19257.
[4] 崔 龍,劉瑞霞,李曉穎,等.糖尿病大鼠腎臟病變及其SnoN 蛋白表達的變化[J]. 貴陽醫學院學報,2009,34(1):16-20.
[5] Hills CE,Al-Rasheed N,Al-Rasheed N,et al. C-peptide reverses TGF-β1-induced changes in renal proximal tubular cells:implications for treatment of diabetic nephropathy[J]. Am J Physiol Renal Physiol,2009,296(3):F614-F621.
[6] 楊 勤,謝汝佳,張國忠,等. 轉化生長因子胞內信號蛋白Smad2/3 在糖尿病大鼠腎臟表達的動態觀察及意義研究[J]. 中國病理生理雜志,2006,10(22):1879-1884.
[7] Wong VW,Rustad KC,Akaishi S,et al. Focal adhesion kinase links mechanical force to skin fibrosis via inflammatory signaling[J]. Nat Med,2011,18(1):148-152.
[8] 孫 勇,劉建國. 整合素與鈣通道協同調節人腎小管上皮細胞轉分化過程及其機制[J]. 山東醫藥,2007,47(8):7-9.
[9] 鄧冰清,朱忠華,張 春,等. 黏著斑激酶在轉化生長因子β1 誘導的人腎小管上皮細胞轉分化中的作用[J]. 中華腎臟病雜志,2009,25(10):771-775.
[10]Shikano T,Haneda M,Toqawa M,et al. Tyrosine phosphorylation of focal adhesion kinase (p125FAK)and paxillin in glomeruli from diabetic rats[J]. Nihon Jinzo Gakkai Shi,1996,38(2):57-64.
[11]Ding Q,Gladson CL,Wu H,et al. Focal adhesion kinase(FAK)-related non-kinase inhibitis myofibroblast differentiation through differential MAPK activation in a FAK-dependent manner[J]. J Biol Chem,2008,283(40):26839-26849.
[12]Walsh MF,Ampasala DR,Hatfield J,et al. Transforming growth factor-β stimulates intestinal epithelial focal adhesion kinase synthesis via Smad-and p38-dependent mechanisms[J]. Am J Pathol,2008,173(2):385-399.
[13]Parsons JT. Focal adhesion kinase:the first ten years[J].J Cell Sci,2003,116(Pt 8):1409-1416.
[14]Clark EA,Hynes RO. 1997 keystone symposium on signal transduction by cell adhesion receptors[J]. Biochim Biophys Acta,1997,1333(3):R9-R16.
[15]Fujita H,Omori S,Ishikura K,et al. ERK and p38 mediate high-glucose-induced hypertrophy and TGF-β expression in renal tubular cells[J]. Am J Physiol Renal Physiol,2004,286(1):F120-F126.
[16]常巨平,祝勝郎,余學清,等. ERK1/2 信號蛋白在糖尿病小鼠腎組織中的表達[J]. 中國病理生理雜志,2007,23(9):1804-1807.

