根癌農桿菌介導深紅蟲草菌株C033轉化體系的建立
郭維 王磊 吳宏清 白玲 章衛民
(1.廣東省微生物研究所 廣東省菌種保藏與應用重點實驗室 廣東省微生物應用新技術公共實驗室 廣東省華南應用微生物重點實驗室-省部共建國家重點實驗室培育基地,廣州 510070;2.江西農業大學理學院,南昌 330045)
蟲草(Cordyceps spp. s. l.)是一類重要的真菌資源,主要寄生于昆蟲、蜘蛛和某些大團囊菌屬地下種類的子實體上,它是一類復型真菌,在其生活史中存在以分生孢子形成為特征的無性型和以子座形成并產生子囊孢子為特征的有性型[1],其種類繁多,代謝產物豐富,且具有多種生物活性[2]。卵孢菌素(Oosporein)是布氏蟲草(C. brongniartii)無性型,即布氏白僵菌(Beauveria brongniartii)的一種天然真菌毒素[3]。研究表明,卵孢菌素是布氏白僵菌唯一的主要次級代謝產物,最大產量可達270 mg/L[4]。因此,卵孢菌素在害蟲的生物防治中起著重要的作用。迄今為止,卵孢菌素的相關功能基因及其在蟲草菌中的合成途徑尚不清楚。
深紅蟲草(C. cardinalis)是一種寄生于鱗翅目幼蟲的病原真菌[5]。本實驗室在前期研究中分離獲得了深紅蟲草的無性型(菌株C033),通過研究首次發現其發酵提取物具有良好的生物活性,進一步通過發酵產物的分離純化,獲得了紅褐色粉末狀活性物質——卵孢菌素,且產量較高,得率為120 mg/L[6,7]。此外,該菌株具有生長速度快、產孢量大的特點,是研究蟲草菌生物合成卵孢菌素的理想菌株。但是,根據該菌株現有的卵孢菌素產量,有必要通過遺傳改造提高該蟲草菌合成卵孢菌素的產量,為今后開發出新型高效的生防制劑奠定基礎。
為了研究蟲草菌的基因功能、基因表達調控和表達體系,建立一個高效的蟲草菌轉化體系非常關鍵。目前,對于絲狀真菌的轉化方法通常有原生質體轉化法、醋酸鋰轉化法、電穿孔轉化法和根癌農桿菌介導轉化法(Agrobacterium tumefaciens-mediated transformation,ATMT)等[8]。ATMT是一種最為有效的轉化方法,具有操作方法簡單、轉化受體多樣、轉化效率較高、遺傳穩定等優點。在蟲草的無性型及相關真菌中已報道了蛹蟲草菌、球孢白僵菌、金龜子綠僵菌等利用ATMT法成功地建立了相應的轉化體系[9-14]。
由于深紅蟲草是2004年才報道的一個蟲草新種[5],至今國內外還沒有關于該蟲草菌的轉化體系的研究報道。本研究以深紅蟲草菌株C033作為出發菌株,根癌農桿菌EHA105為基礎,構建含遺傳霉素抗性基因的雙元載體pCambia2301,建立高效的遺傳轉化系統,旨在為進一步研究其相關功能基因,高效利用深紅蟲草菌株防治蟲害奠定理論基礎,同時也為其它蟲草菌重要活性代謝產物相關功能基因的研究提供參考。
1 材料與方法
1.1 材料
1.1.1 菌株和質粒轉化受體 深紅蟲草(C. cardinalis)菌株C033由本實驗室保存;轉化供體:根癌農桿菌(A. tumefaciens)EHA105由華中農業大學提供;雙元載體pCambia2301購于北京鼎國生物技術有限責任公司,其包含β-葡萄糖苷酶報告基因(gus)和抗性篩選標記新霉素磷酸轉移酶基因(nptⅡ),這2個基因均受CaMV 35S啟動子調控,其中gus基因包含一個內含子,可消除殘余菌液中的gus基因表達行為,pCambia2301載體通過凍融法導入到農桿菌EHA105菌株。該載體T-DNA 區域的結構見圖1。
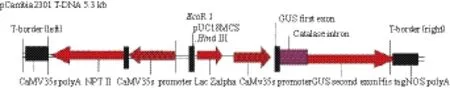
圖1 雙元載體pCambia 2301的T-DNA結構
1.1.2 試劑 遺傳霉素(G418)、頭孢霉素、乙酰丁香酮(AS)購自德國羅氏公司;卡那霉素購自Sigma公司;Ex Taq DNA聚合酶購于日本TaKaRa公司;gus檢測液:X-GluC溶液、50 mmol/L的磷酸鈉緩沖液、50 mmol/L的鐵氰化鉀溶液、50 mmol/L的亞鐵氰化鉀溶液、0.5 mol/L的EDTA溶液,pH8.0。
1.1.3 培養基 C8固體培養基(%):葡萄糖5,蛋白胨1,KNO30.2,MgSO40.2,(NH4)3PO4·3H2O 0.2,CaCl20.01,瓊脂1.5,蒸餾水定容,pH自然,用于蟲草菌的培養。
YEB固體培養基(g/L):蛋白胨5,蔗糖5,牛肉膏5,酵母提取物1,MgSO40.24,蒸餾水定容,pH7.2,用于農桿菌的活化培養。
MM液體培養基(g/L):K2HPO41.45,KH2PO42.5,NaCl 0.15,MgSO40.5,CaCl20.066,FeSO40.0008,(NH4)2SO40.5,葡萄糖1.8,0.5%甘油(W/V),蒸餾水定容,pH自然,用于農桿菌的擴大培養。
隨著電噴柴油機和電控系統相關技術不斷發展,電噴柴油機主機遙控系統的設計與實現提出的功能需求不斷演變。下面以MAIN的電噴主機的接口和配套的主機遙控系統實現的功能為例進行分析。
IM培養基的組成同MM,另加200 μmol乙酰丁香酮(AS),pH5.3,用于農桿菌的誘導培養。
1.2 方法
1.2.1 菌株C033對遺傳霉素(G418)的敏感性試驗 將無菌水配制的蟲草菌分生孢子懸浮液稀釋至106個/mL,取100 μL涂布于含不同濃度G418(0、100、200、400、600和800 μg/mL)的C8平板上,28℃培養4 d,重復3次,根據觀察結果,確定G418對深紅蟲草菌株的最小抑制濃度。
1.2.2 菌株C033分生孢子液的制備 用無菌蒸餾水從培養5-7 d 的C8平板洗下C033菌株的分生孢子,離心后用MM液體培養基重懸,血球計數板計數,再用MM液體培養基將孢子濃度調整為106個/mL。
1.2.3 根癌農桿菌EHA105的轉化及活化培養 采用凍融法[15]將質粒pCambia2301直接轉化到根癌農桿菌EHA105菌株中,轉入含50 μg/mL卡那霉素的YEB平板上培養,挑取單菌落PCR鑒定并測序,結果正常說明轉化成功,保存單菌落。從含50 μg/mL卡那霉素的YEB平板上挑取農桿菌單菌落,接種于3 mL YEB液體培養基(含50 μg/mL卡那霉素),28℃、220 r/min振蕩培養過夜。
1.2.4 農桿菌介導菌株C033的轉化 將培養好的農桿菌菌液250 μL接種于50 mL MM培養基中,28℃、220 r/min擴大培養2 d,檢測菌液OD600值,將IM培養基稀釋至OD600=0.15,繼續在相同條件下培養6-12 h,取100 μL菌株C033孢子懸液和活化的100 μL EHA105(含有pCambia2301)混勻后,均勻涂布到表面鋪有濾紙的IM固體培養基上,28℃避光培養2 d。將濾紙轉移到含G418和頭孢霉素平板上,28℃繼續培養2-4 d,挑取長出的單菌落在不含G418的C8平板上傳3代,再接種到含G418的C8平板上傳2代,若抗性穩定,則初步認定為蟲草菌株的轉化子,保存菌種。
1.2.5 gus基因組織化學檢測 轉化子單菌落形成后,接種到含G418和頭孢霉素抗性的C8液體培養基的96孔板上,保證每孔一個單菌落,培養3 d后,此時菌落顏色為正常的紅色,向每孔加入50 μL的gus檢測液,37℃保溫過夜,通過組織化學分析確定gus表達的穩定性。
1.2.6 轉化子的鑒定 隨機挑選10個單孢分離轉化子,按改良的CTAB法[16]分別取菌塊0.5 g提取基因組DNA。采用PCR擴增檢測目的片段,以pCambia2301載體上的gus和nptⅡ基因序列為參考,設計兩者的上下游引物,其中gus正向引物為5'-CGTCCTGTAGAAACCCCAAC-3',反向引物為5'-ATTGACCCACATTTGCCGT-3',nptⅡ正 向 引 物為5'-GAGGCTATTCGGCTATGACTG-3',反向引物為5'-ATCGGGAGCGGCGATACCGTA-3'。gus和nptⅡ基因的預期片段長度分別為300 bp和700 bp左右,引物由上海生工生物公司合成。PCR反應體系共20 μL,包括100 ng DNA,200 μmol/L dNTPs,1 μmol/L的上下游引物,1 U Ex Taq DNA 聚合酶,1.5 mmol/L MgCl2,5 μL 10×Taq DNA聚合酶緩沖液。反應程序為:95℃變性5 min;94℃變性45 s,58℃退火45 s,72℃延伸90 s,32個循環;72℃延伸10 min。取5 μL擴增產物于1%瓊脂糖凝膠中進行電泳檢測。
2 結果
2.1 菌株C033對遺傳霉素的敏感性檢測
表1顯示,當含有G418的C8固體平板的終濃度為400 μg/mL時,蟲草菌絲生長明顯受到抑制,而當G418濃度達到500 μg/mL時,菌絲完全不能生長。因此,選擇遺傳霉素G418的最佳篩選濃度為500 μg/mL。
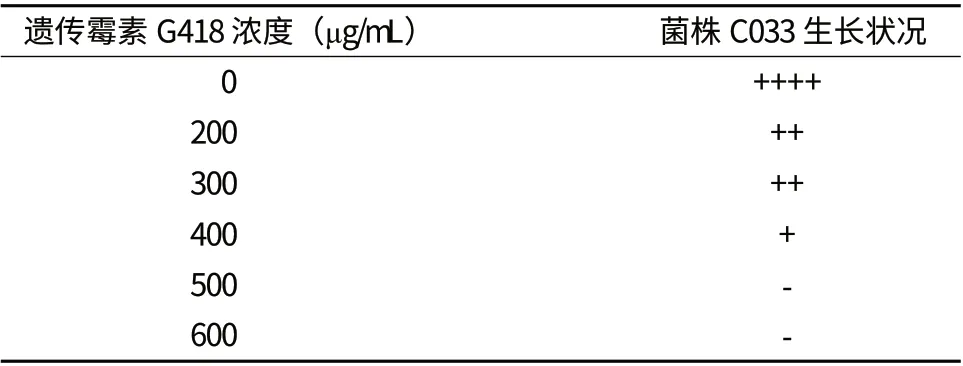
表1 深紅蟲草菌株C033對遺傳霉素G418的敏感性
2.2 轉化子gus基因表達的穩定性
從經檢測已導入gus基因的菌體上刮取適量菌絲進行組織化學染色檢測,發現均不同程度被染成藍色。轉化菌株重新培養20 d后,再挑選6個轉化菌株進行組織化學染色檢測,仍然被染成藍色,說明gus基因轉入蟲草菌株后能持續表達,證明本試驗所建立的轉化系統是穩定有效的。
2.3 轉化子的PCR鑒定
隨機選取10個經G418和頭孢霉素篩選的轉化子,以野生型菌株為陰性對照,質粒pCambia2301為陽性對照,采用CTAB法提取總DNA,用針對nptⅡ基因所設計的引物nptⅡ-F、nptⅡ-R和gus基因所設計的引物gus-F、gus-R進行PCR擴增。PCR產物的瓊脂糖凝膠電泳檢測結果如圖2和圖3所示。所挑取的轉化子的擴增產物在700 bp和300 bp處均呈現出與陽性對照相同的特異性片段,而陰性對照沒有出現特異性條帶,初步說明遺傳霉素抗性片段插入至蟲草菌株轉化子的基因組中。

圖2 轉化子nptⅡ基因的PCR擴增結果

圖3 轉化子gus基因的PCR擴增結果
2.4 轉化條件的優化
2.4.1 菌株C033的孢子濃度 用無菌水將菌株C033的孢子分別稀釋至103、104、105和106個/mL,進行轉化試驗。結果(圖4)顯示,當孢子濃度為105個/mL時,轉化子數目最多,約40個/平板。因此,選擇蟲草菌孢子的最佳濃度為105個/mL。
2.4.2 根癌農桿菌OD值 分別采用OD600值為0.1、0.2、0.4、0. 6和0.8等5個濃度梯度的農桿菌對孢子濃度為105個/mL的蟲草菌株進行轉化,結果(圖5)顯示,當農桿菌OD值為0.6時轉化效果最佳。
2.4.3 誘導劑乙酰丁香酮(AS)濃度 調整轉化過程中的AS濃度分別為100、150、200、250和300 μmol/L,結果(圖6)顯示,隨著共培養基中AS濃度增高,轉化子數目也相應增加,當AS濃度達200 μmol/L時轉化子數目達到最高,提高AS濃度至250和300 μmol/L時轉化效率逐漸降低,因此200 μmol/L為AS的最佳添加濃度。
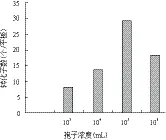
圖4 菌株C033孢子濃度對轉化效率的影響
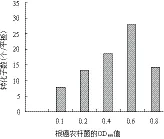
圖5 根癌農桿菌的OD值對轉化效率的影響
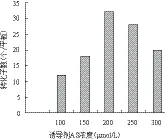
圖6 誘導劑AS濃度對轉化效率的影響
2.4.4 共培養時間 調整共培養時間為24、36、48、60和72 h,結果(圖7)顯示,當共培養為24 h時,轉化子數量稀少,隨共培養時間的延長,轉化子數目增多,當培養時間為48 h時,轉化子數達到最多,而繼續延長共培養時間,轉化子數目則逐漸減少。
3 討論
自1998年de Groot等[17]首次將根癌農桿菌介導轉化法應用于絲狀真菌的遺傳轉化以來,已有許多絲狀真菌通過ATMT法成功實現了遺傳轉化。本研究利用這一轉化系統成功實現了對深紅蟲草菌株的遺傳轉化,建立了該蟲草菌的轉化體系,并通過分析各轉化因素對轉化效率的影響優化了轉化條件。

圖7 共培養時間對轉化效率的影響
在蟲草菌的遺傳轉化過程中,首先必須尋找合適的抗生素作為遺傳改造的抗性標記。目前,用于真菌轉化篩選的抗生素抗性標記中主要有潮霉素(HygB)、遺傳霉素(G418)等,而以HygB最為常見。在蛹蟲草(C. militaris)的遺傳轉化中發現HygB對其具有明顯抑制效果,因此以它作為抗性標記,利用ATMT法成功獲得了轉化子,并篩選到蟲草突變株[9]。G418及其抗性基因npt II已在啤酒酵母(Saccharomyces cerevisiae)[18]、須癬毛癬菌(Trichophyton mentagrophytes)[19]等真菌的遺傳轉化中得到應用。本研究通過試驗證明,深紅蟲草菌株C033對HygB具有高度的抗性,因此HygB不宜用來篩選該菌株的轉化子。該菌株對新霉素類抗生素較為敏感,因此選擇G418用于轉化子的篩選。
蟲草菌孢子的濃度及農桿菌的菌液濃度、誘導劑AS濃度及共培養時間是實現蟲草菌遺傳轉化的關鍵因素,因此本研究主要對這些影響因素進行了優化。隨著蟲草菌孢子濃度的提高,轉化效率明顯提高,但過高的孢子濃度會造成菌絲的蔓延,不利于轉化子的生長。本研究通過對不同孢子濃度的蟲草菌進行轉化試驗,結果蟲草菌孢子濃度為105個/mL時轉化率最高。在一定的濃度范圍內,增加農桿菌的菌液濃度會提高蟲草菌的轉化效率,但過高的農桿菌濃度反而降低轉化效率,其原因可能是農桿菌濃度過高抑制了蟲草菌的生長。本試驗通過不同濃度的農桿菌對蟲草菌株進行轉化,結果農桿菌OD值為0.6時轉化效果最好。
共培養基中AS能起到誘導活化農桿菌vir基因的作用,濃度太低會導致農桿菌病毒蛋白表達量不夠,難以完成轉化,AS濃度過高可能會導致T-DNA插入的拷貝數目增加[20]。本試驗發現添加不同濃度的AS轉化效率不同,當AS濃度達200 μmol/L時轉化子數目達到最高。但也有研究發現,在對蛹蟲草菌株的轉化中添加AS與否并不影響轉化效率,說明AS并非是誘導蛹蟲草轉化所必須的[9],推測這與不同的轉化宿主有關。共培養時間關系到農桿菌vir基因的表達、蛋白的活化、T-DNA的剪切和復合物向孢子內的轉移,過短的共培養時間將導致轉化無法順利完成,共培養時間太長,非轉化子對轉化子生長的競爭作用將導致轉化效率降低,加大假陽性出現的概率[21]。在本試驗中,當共培養時間為48 h時蟲草菌的轉化子數量最多。
深紅蟲草菌是鱗翅目幼蟲的病原真菌,卵孢菌素為其主要的次級代謝產物[22],在蟲草菌侵染昆蟲,最終導致昆蟲死亡的過程中發揮著重要作用。盡管卵孢菌素的化學結構、理化性質及生物活性已有相關報道[23,24],但其相關功能基因及合成途徑尚未見報道。在本研究建立的蟲草菌遺傳轉化體系中,該菌株的生長速度快,產孢量大,轉化效率高,獲得的轉化子遺傳穩定性好,由此構建的蟲草菌T-DNA插入突變體庫將為蟲草菌株的選育、相關功能基因的克隆及功能分析,闡明卵孢菌素的合成途徑奠定技術基礎。
4 結論
遺傳霉素和頭孢霉素分別為深紅蟲草菌株C033的有效篩選劑和除菌劑,篩選劑的濃度為500 μg/mL。通過根癌農桿菌EHA105介導建立了深紅蟲草菌株的遺傳轉化體系。當根癌農桿菌菌液在600 nm處的吸光值為0.6左右,蟲草菌孢子的濃度為105個/mL,AS的濃度為200 μmol/L,根癌農桿菌與蟲草菌的共培養時間為48 h時,該體系的轉化效率最高,可獲得約100個轉化子。
[1] 梁宗琦.中國真菌志(第32卷):蟲草屬[M].北京:科學出版社, 2007:1-17.
[2] 胡豐林, 李增志.蟲草及相關真菌的次生代謝產物及其活性[J].菌物學報, 2004, 26(4):607-632.
[3] Eyal J, Mabud MDA, Fischbein KL, et al. Assessment of Beauveria bassiana nov. EO-1 strain, which produces a red pigment for microbial control [J]. Appl Biochem Biotechnol, 1994, 44(1):65-80.
[4] Strasser H, Abendstein D, Stuppner H, et al. Monitoring the distribution of secondary metabolites produced by the entomogenous fungus Beauveria brongniartii with particular reference to oosporein [J]. Mycol Res, 2000, 104(10):1227-1233.
[5] Sung GH, Joseph WS. Cordyceps cardinalis sp. nov., a new species of Cordyceps with an east Asian-eastern North American distribution [J]. Mycologia, 2004, 96(3):658.
[6] 李義勇, 陳玉嬋, 李冬利, 等.幾種蟲草菌發酵提取物的抗菌抗腫瘤活性研究[J].食品工業科技, 2010, 31(6):88-90, 93.
[7] 李冬利, 李義勇, 陳玉嬋, 等.一種深紅蟲草及利用其制備卵孢菌素的方法和其用途[P]. 中國專利:CN 102168108, 2011-08-31.
[8] 陳東亮, 李紀元, 范正琪, 等.根癌農桿菌介導真菌遺傳轉化的影響因素及應用[J].安徽農業科學, 2010, 38(7):3317-3320.
[9] Zheng ZL, Huang CH, Cao L, et al. Agrobacterium tumefaciensmediated transformation as a tool for insertional mutagenesis in medicinal fungus Cordyceps militaris [J]. Fungal Biol, 2011, 115(3):265-274.
[10] Fang W, Zhang Y, Yang X, et al. Agrobacterium tumefaciensmediated transformation of Beauveria bassiana using an herbicide resistance gene as a selection marker [J]. J Invertebr Pathol, 2004, 85(1):18-24.
[11] Fang W, Pei Y, Bidochka MJ. Transformation of Metarhizium anisopliae mediated by Agrobacterium tumefaciens [J]. Can J Microbiol, 2006, 52(7):623-626.
[12] Luo ZB, Zhang YJ, Zhang KJ, et al. Construction of Beauveria bassiana T-DNA insertion mutant collections and identification of thermosensitive and osmosensitive mutants [J]. Acta Microbiol Sin, 2009, 49(10):1301-1305.
[13] Kirkland BH, Westwood GS, Keyhani NO. Pathogenicity of entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae to Ixodidae tick species Dermacentor variabilis, Rhipicephalus sanguineus and Ixodes scapularis [J]. J Med Entomol, 2004, 41(4):705-711.
[14] Dos Reis MC, Pelegrinelli Fungaro MH, Delgado Duarte RT, et al. Agrobacterium tumefaciens-mediated genetic transformation of the entomopathogenic fungus Beauveria bassiana [J]. J Microbiol Methods, 2004, 58:197-200.
[15] 王學全, 沈曉, 任天年, 等.根癌農桿菌EHA105和LBA4404凍融法轉化條件的優化研究[J]. 藥物生物技術, 2011, 18(5):382-386.
[16] 孫立夫, 張艷華, 裴克全.一種高效提取真菌總DNA的方法[J].菌物學報, 2009, 28(2):299-302.
[17] de Groot MJ, Bundock P, Hooykaas PJ, et al. Agrobacterium tumefaciens-mediated transformation of filamentous fungi [J]. Nat Biotechnol, 1998, 16(9):839-842.
[18] Guerra OG, Rubio IGS, Filho CGDS, et al. A novel system of genetic transformation allows multiple integrations of a desired gene in Saccharomyces cerevisiae chromosomes [J]. J Microbiol Methods, 2006, 67(3):437-445.
[19] Yamada T, Makimura K, Hisajima T, et al. Genetic transformation of the dermatophyte, Trichophyton mentagrophytes, based on the use of G418 resistance as a dominant selectable marker [J]. J Dermatol Sci, 2008, 49(1):53-61.
[20] Covert SF, Kapoor P, Lee M, et al. Agrobacterium tumefaciensmediated transformation of Fusarium circinatum [J]. Mycol Res, 2001, 105(3):259-264.
[21] Huser A, Takahara H, Schmalenbach W, et al. Agrobacterium tumefaciens-mediated transformation as a tool for random mutagenesis of Colletotrichum trifolii [J]. J Gen Plant Pathol, 2004, 70(2):93-96.
[22] 李義勇.蟲草菌次級代謝產物及其生物活性研究[D].宜昌:三峽大學, 2010.
[23] Seger C, Erlebach D, et al. Physicochemical prorerties of oosporein, the major secreted metabolite of the entomopathogenic fungus beauveria Brongniartii [J]. Helv Chim Acta, 2005, 88(4):802-810.
[24] Toshinori N, Kengo N, Kenji K, et al. Antifungal activity of oosporein from an antagonistic fungus against Phytophthora infestans [J]. Verlag der Zeitschrift für Naturforschung, 2004, 59(3-4):302-304.

