染菌培養干辣椒揮發性風味化合物的分析及變化特征
丁筑紅,劉 海,鄭文宇,王知松
(貴州大學生命科學學院,貴州省農畜產品貯藏與加工重點實驗室,貴州 貴陽 550025)
我國辣椒產量居全球之首,產值在全國各類蔬菜中居于首位[1]。干辣椒是成熟紅辣椒經自然或人工干制后的產品,是日常餐桌食品、風味食品、調味品生產中的主要原料,目前生產主要采用自然干制和簡易烘房干制技術,包裝貯藏措施簡單粗放,極易染菌,導致在貯藏期出現大量變質椒和變色“花殼”椒[2],其中細菌主要以桿菌為主,真菌主要是曲霉屬和根霉屬,其中黑曲霉最易污染[3]。目前,國內外在辣椒及辣椒加工中進行風味品質研究報道不多[4],主要針對鮮椒揮發性風味物質提取方法、風味化合物組成、風味描述進行相關研究,而干制辣椒風味化合物分析報道則主要涉及不同處理干辣椒產品風味物質提取方法、風味物質構成及風味特征研究[5-11]。生產中干辣椒原料帶菌量大,而微生物對干辣椒風味品質影響方面缺乏關注和研究。電子鼻是根據仿生學原理,由傳感器陣列和自動化模式識別系統所組成。它是一種新穎的分析、識別和檢測復雜氣味和大多數揮發性成分的儀器。在食品生產中,可應用于乳品和肉制品品質監控[12-13]。然而,采用電子鼻檢測辣椒風味的相關報道甚少。本實驗采用頂空固相微萃取和氣質聯用(headspace solid phase microextraction combined with gas chromatography-mass spectrometry,HS-SPME-GC-MS)風味化合物分析技術,結合電子鼻檢測技術,探討主要污染菌對干辣椒接種培養后干椒揮發性風味化合物構成及風味品質的變化特征,全面把握干椒染菌前后以及各菌株染菌樣品間風味差異性,有利于全面評價干椒品質,并為辣椒生產加工中品質控制提供更多有價值的參考依據。
1 材料與方法
1.1 材料
1.1.1 原料
貴陽市花溪區黨武鄉新鮮成熟紅辣椒,清洗瀝干,60℃電熱烘干至質量恒定后,粉碎至1~2mm大小,得辣椒粉備用。
1.1.2 菌種
選用自然干制辣椒優勢易染菌,均由本實驗室提供,從自然干制辣椒樣品中分離純化,4~6℃冰箱保存試管菌種。I號:唾液乳桿菌(Lactobacillus salivarius),II號:反芻真桿菌(Eubacterium ruminantium);III號:黑曲霉(Aspergillus niger)。
1.2 儀器與設備
手動SPME進樣器、75μm CAR/PDMS萃取頭(100μm聚二甲基硅氧烷(PDMS)萃取頭) 美國Supelco公司;HP6890/5975C型GC/MS聯用儀 美國安捷倫公司;FOX4000型電子鼻、自動進樣器HS100、αSOFTV12軟件 法國Alpha MOS公司。
1.3 方法
1.3.1 樣品處理
取100g辣椒粉平鋪于白瓷盤上,料層厚度1.5cm,潤水30%,置于功率為7.7kW微波爐焙烤殺菌,時間4min[14]。將唾液乳桿菌和反芻真桿菌分別接種于50mL無菌營養肉湯液體培養基中擴大培養24h,并將黑曲霉接種于馬鈴薯葡萄糖水中擴大培養36h,制作菌懸液。將上述焙烤后辣椒粉稱取10g于培養皿中,以無菌操作接種5mL上述單一菌懸液,同時注入5mL滅菌蒸餾水,接種唾液乳桿菌和反芻真桿菌的培養皿放入37℃恒溫培養箱培養,接種黑曲霉的培養皿放入37℃恒溫培養箱培養,其間補充水分,培養15d。
1.3.2 揮發性物質的檢測
1.3.2.1 樣品風味物質提取
采用固相微萃取法,參照朱曉蘭的方法[15]將樣品于60℃條件下恒溫10min后,插入固相微萃取頭,保持60℃頂空吸附30min后,取出插入GC-MS進樣口,解吸5min。
1.3.2.2 GC-MS條件
色譜柱H P - 5 M S 5 % P h e n y l M e t h y l Siloxane(30m×0.25mm,0.25μm)彈性石英毛細管柱,柱溫45℃(保留0.5min),以5℃/min升溫至290℃,保持2min;汽化室溫度250℃;載氣為高純(99.999%)He;柱前壓7.62psi,載氣流量1.0mL/min;分流比20:1。質譜條件:離子源為電子電離(electron ionization,EI)源;離子源溫度230℃;四極桿溫度150℃。
1.3.3 辣椒粉品質電子鼻檢測
載氣:合成干燥空氣,流速:150mL/min;小瓶中樣品體積10mL,樣品質量0.4g;頂空產生時間900s,產生溫度60℃,攪動速度500r/min;頂空注射體積0.7mL,注射針總體積5.0mL,注射速度0.7mL/s,注射針溫度70℃;參數獲取時間120s;延滯時間360s。
2 結果與分析
2.1 染菌干辣椒揮發性物質GC-MS結果分析
干辣椒經接種菌種并培養后,比較其揮發性成分的變化情況,結果如圖1、表2所示。
由圖1可以看出,各樣品揮發性風味物質的出峰時間主要集中在30min之前,對照組與唾液乳桿菌、反芻真桿菌、黑曲霉組比較,分別于1.82、2.52、3.57、2.52min開始出峰,對照樣品出峰時間較處理組早,在10min以前分別檢出14、6、5、6種風味化合物,檢出物相對含量分別為27.090%、2.009%、1.230%、0.814%。10~20min出峰期分別檢出21、15、20、13種風味化合物,相對含量分別為35.664%、11.187%、15.738%、3.797%,可見對照組低分子揮發性物質種類較處理組多,相對含量較高。20min后各樣品檢出22、29、30、34種,相對含量分別為35.029%、86.803%、83.033%、95.370%。可見,經受試菌處理的樣品出峰時間基本向后遷移,出峰集中在20min后,其間大分子物質檢出較多。對辣椒呈味貢獻較少,因而使辣椒原有風味特征變化、風味品質改變明顯。
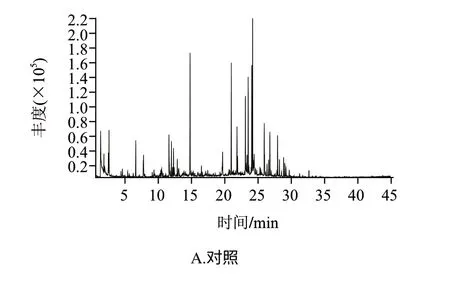
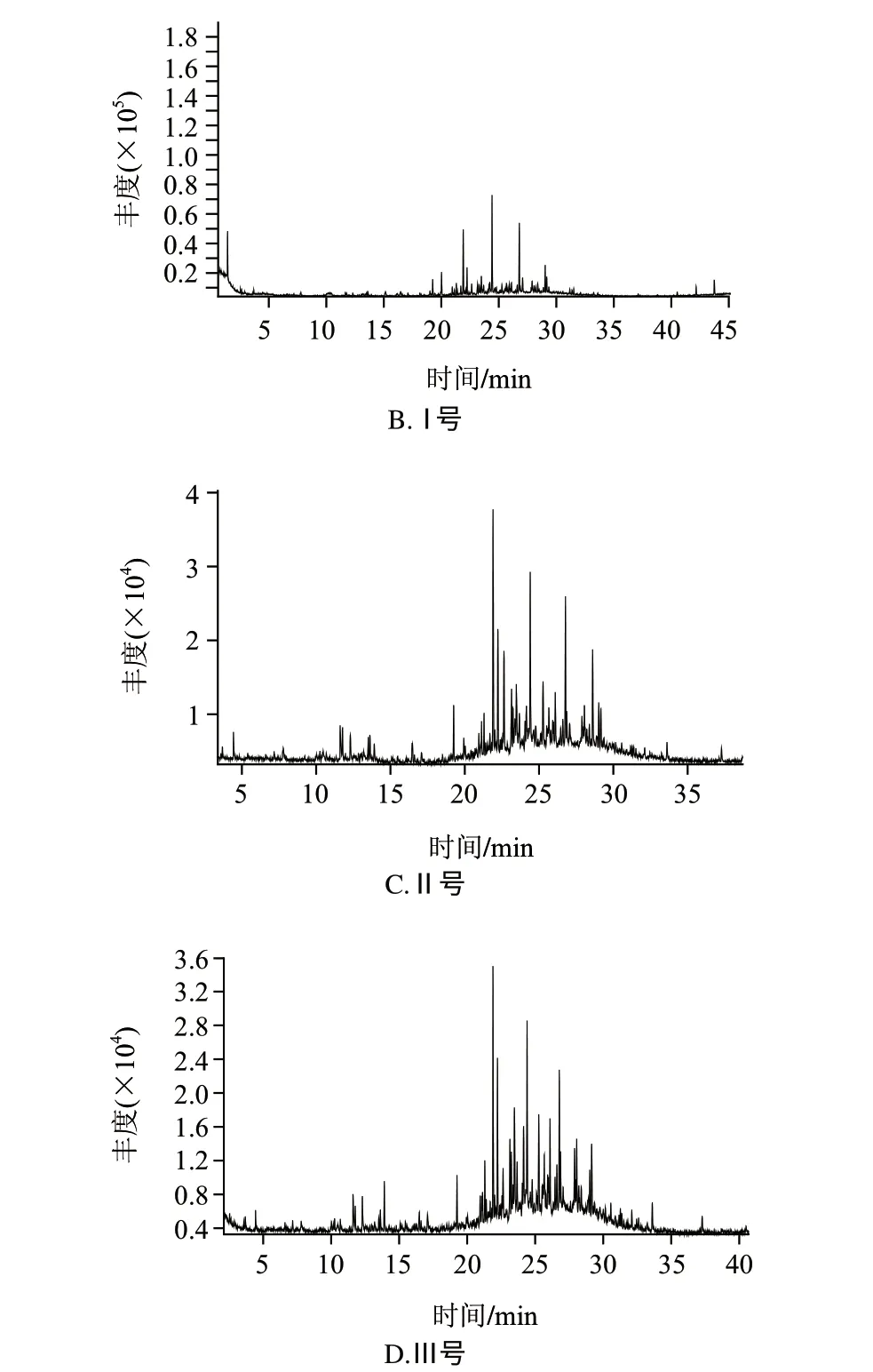
圖 1 染菌干辣椒揮發性物質總離子流圖Fig.1 Total ion chromatogram of volatile components in chili pepper samples
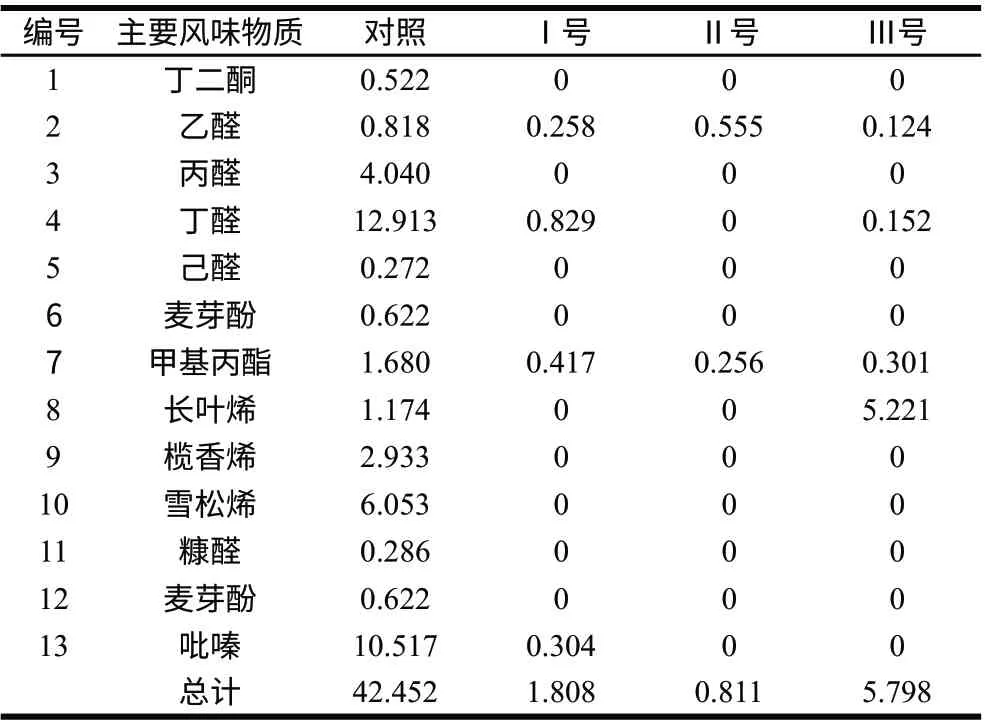
表 1 染菌干辣椒主要揮發性物質相對含量 Table 1 Relative contents of main volatile compounds in chili pepper samples%
通過比較干辣椒中對風味品質有積極貢獻的主要揮發性風味化合物[16],從表1可以發現,在對照組原料鑒定結果的主要13種類揮發性成分中,染菌組僅檢出2~4種,相對含量也由對照組42.452%降至染菌組的0.811%~5.798%,從而基本上喪失了原料風味特征,產生其他類型產物。
對各處理樣品質譜檢測解譜后干椒揮發性風味化合物種類統計結果比較,結果如表2所示。結果發現,對照組、以及經唾液乳桿菌、反芻真桿菌、黑曲霉接種培養干辣椒粉進行可揮發性風味物質分離檢測,分離定性的可揮發性風味物質分別為57、50、55、53種,染菌后干椒揮發性風味化合物較對照組有所減少。分離和定性的可揮發性風味物質中,處理組與對照組相比,烷烴類化合物組含量增加突出,檢出物由9種增加到17~21種,相對含量由17.862%上升到56.704~70.81%,從質譜圖譜結果看出,烷烴類化合物集中出現在20min后,主要為大分子烷烴,而大分子烷烴類有呈香特性較弱[16],從而對辣椒風味貢獻意義不大。
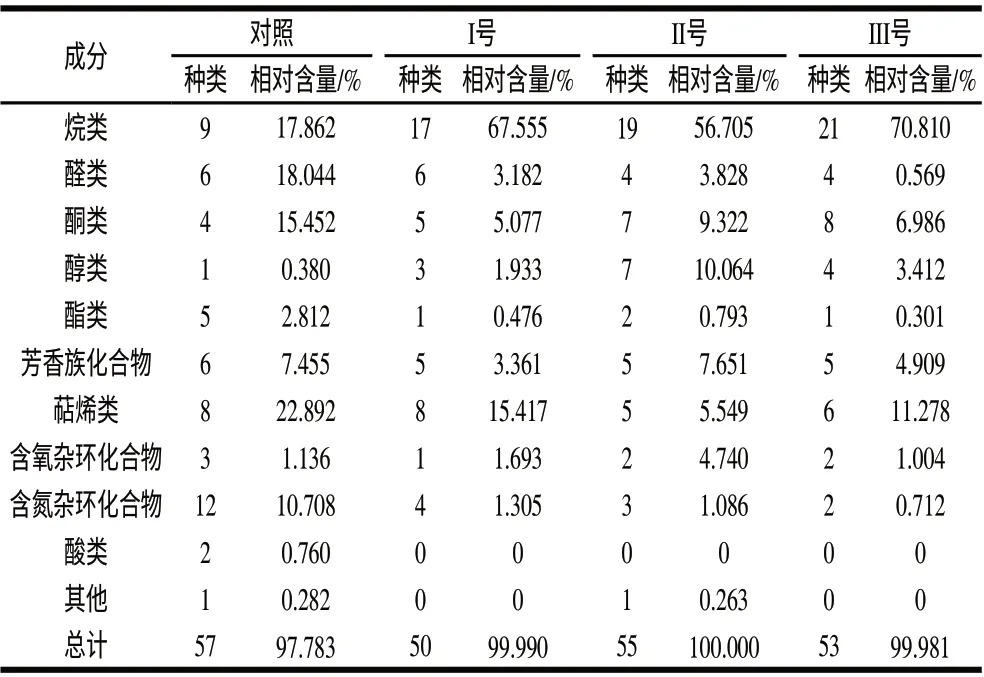
表 2 樣品揮發性風味成分種類及相對含量Table 2 Kind and contents of volatile flavor compounds in dried chili peppers
處理組與對照組相比,醛類、相對含量從18.044%、減少到0.569%~3.828%;酮類化合物由15.452%減少到5.077%~9.322%;脂類化合物由2.812%,減少到0.301%~0.793%;具有焙烤香氣特性的氮雜環化合物、吡嗪類以及萜烯類化合物[17]經染菌培養后均有所降低,含氮雜環化合物由原有的12種,減少到2~4種,相對含量由10.708%減少到0.712%~1.305%,萜烯類化合物由22.892%減少至5.549%~15.417%。結果發現,微生物染菌培養后,醇類含量有所增加,醇類化合物種類由對照的1種增加到3~7種,相對含量由對照組的0.380%增加到1.933%~10.064%,可能與微生物存在的發酵作用有關,醇類化合物中,C10以上的高碳飽和醇,從其呈味特征來看,氣味一般很弱或無嗅感[19],而具有良好風味的醇類相對含量不高,其中苯乙醇的相對含量占0.12%~0.95%,3-甲基-戊醇的相對含量占0.238%、2-乙基-1-己醇0.203%、沉香醇0.552%、葉綠醇2.552%~2.736%。可見,辣椒粉經微生物作用后多數具有芳香性化合物的相對含量都急劇減少,種類減少也比較明顯。醇類含量有所增加,可能與微生物發酵作用有關,但因在整體風味化合物中含量有限,其積極的作用難以體現。同時,對香味貢獻不大的烷烴類化合物種類相對含量急劇增加,削弱了辣椒的整體良好風味。Cremer等[18]采用頂HS-GS以及SPME提取,GC-MS檢測,分析加熱后辣椒風味形成動態變化規律,發現熱處理后辣椒烷烴類迅速增加,而本實驗則進一步發現,微生物污染導致辣椒烷烴類成分較單一熱處理的對照大幅度增加。
2.2 電子鼻傳感器對辣椒粉揮發性物質的響應結果
為驗證電子鼻傳感器對干辣椒樣品檢測的重復性,不同實驗樣品在優選傳感器的檢測值(峰高)的相對標準偏差(RSD)如表3所示,從表3可以看出,RSD范圍為-4.86%~2.87%,平均相對誤差為0.5025%,樣品在傳感器上具有良好的重現性,實驗用電子鼻選用的金屬傳感器對辣椒揮發性物質具有較好的響應值,適用于辣椒揮發性物質的檢測。
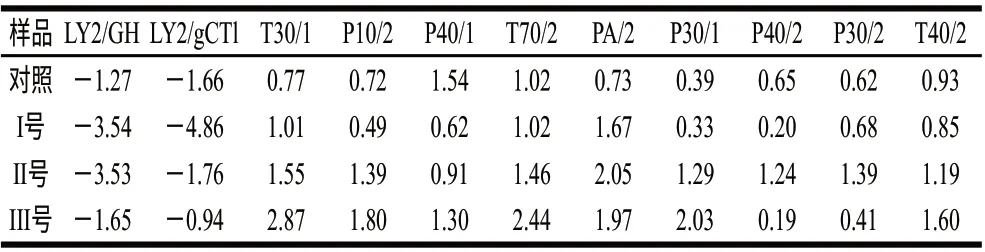
表 3 樣品在傳感器上的相對標準偏差(RSD)Table 3 Relative standard deviations for detection of dried chili peppers on different sensors%
2.3 電子鼻對干辣椒分析結果
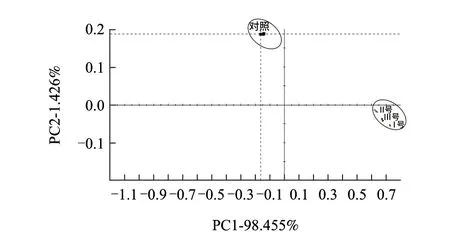
圖 2 辣椒樣品的電子鼻響應信號的主成分分析(PCA)Fig.2 PCA of electronic nose response signals for dried chili peppers
樣品電子鼻檢測結果主成分分析圖如圖2所示。選取2個主成分擬合原數據,PCA的結果可以看出,其中第1和第2主成分的方差貢獻率分別為98.455%和1.426%,累計達99%以上,說明PC1和PC2已經包含很大的信息量,能夠反映樣品的整體信息,貢獻率越大說明辣椒氣味變化主成分能較好地被區分,主成分PC1貢獻率達98.455%,說明主要是第1主成分對樣品起作用,在染菌處理組中貢獻大。由圖2發現,處理組風味改變十分明顯,從分布的區域來看,很有規律性,相對對照組來說處理組氣味主成分是沿著PC2軸向下分布,同時沿著PC1軸向右分布。其中對照組第二象限內,處理組分不在第四象限內。各樣品的差異主要表現在PC1上,PC2主成分也存在差異。對照與處理樣品的氣味分布距離較遠,處理組間氣味分布的區域較為接近,該電子鼻系統利用PCA能判定對照組與3種處理組風味特征有明顯差異,但處理組間的差異較小。
實驗將各樣品在18個傳感器上的最大響應信號進行了對比,如圖3所示,通過各傳感器信號的對比得樣品相似圖譜處理組樣品在傳感器上的響應值均較小,且響應值都低于對照樣品,電子鼻檢測唾液乳桿菌、反芻真桿菌、黑曲霉處理組辣椒粉與對照樣品相似程度分別為21.64%、31.17%、26.69%,說明微生物污染辣椒樣品中揮發性物質較對照樣品明顯不同,含量明顯降低,傳感器對風味物質響應值下降,而處理組間風味響應值差異性較小。
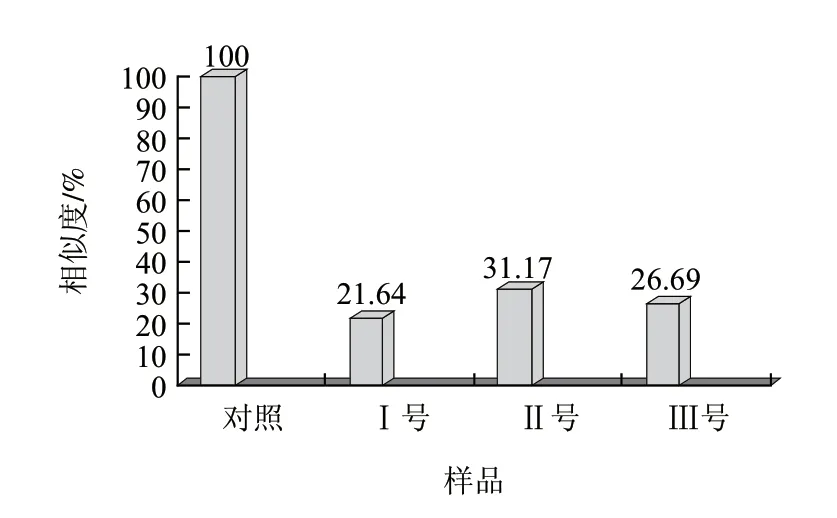
圖 3 對照組與處理組氣味相似度Fig.3 Odour similarity between control and experimental samples
3 結 論
通過SPME-GC-MS檢測,獲得干辣椒在染菌后風味化合物變化的基本特點,其出峰時間大多在20min后,明顯向后遷移,且為大分子揮發性成分,且占檢出物含量的83.033%~95.370%,對辣椒呈味貢獻較少,如烷烴類化合物種類相對含量急劇增加,削弱了辣椒的整體良好風味,使辣椒原有風味特征弱化。同時,多數具有芳香性化合物的相對含量都急劇減少,種類減少也比較明顯,具良好的風味特性的醛類、酮類、酯類、吡嗪類,萜烯類化合物經過微生物染菌培養后呈下降趨勢。醇類含量有所增加,可能與微生物發酵作用有關,但因在整體風味化合物中含量有限,其積極的作用難以體現。同時,在SPME-GC-MS檢測方法對樣品中風味物質的具體種類和含量進行檢測與比較基礎上,通過電子鼻分析風味物質總體特征及處理樣品間風味差異性大小,電子鼻的相似圖譜顯示,對照組與處理組風味特征相似度低,僅為21.64%~31.17%。
干辣椒作為傳統大宗調味品原料,風味品質是產品品質主要的評價指標,目前市場上干椒原料及相關低水分產品微生物染菌嚴重[3],微生物對干辣椒營養安全帶來隱患已成共識,但對干辣椒風味品質造成的影尚并未引起足夠重視。科學完善干辣椒及辣椒粉產品質量安全標準以及生產規范化管理具有重要意義。
[1] 李萌, 龍彭年, 肖四海. 世界辣椒產業經濟發展狀況與我國的對策思考[J]. 辣椒雜志, 2010(4): 1-5.
[2] 李明遠, 武東繁. 干辣椒“虎皮”原因的調查與研究[J]. 植物保護, 1994(2): 21-22.
[3] 張春燕, 蔡靜平, 潘峰. 低水分辣椒粉帶菌狀況及控制技術的研究[J]. 食品科學, 2007, 28(1): 131-134.
[4] 羅鳳蓮, 歐陽建勛, 夏延斌. 發酵辣椒中主要風味物質的研究進展[J]. 食品工業科技, 2009, 30(7): 346-348.
[5] JUNIOR S B, de MARCHI A, de MELO T , et al. Optimization of the extraction conditions of the volatile compounds from chili peppers by headspace solid phase micro-extraction[J]. Journal of Chromatography A, 2011, 1218(38): 3345-3350.
[6] MAZIDA M M, SALLEH M M, OSMAN H. Analysis of volatilearoma compounds of fresh chilli (Capsicum annuum L.) during stages of maturity using solid phase microextraction (SPME)[J]. Journal of Food Composition and Analysis, 2005, 18(5): 427-437.
[7] RONG Liu, KE Xiong, YANG Chaoluo. Changes in volatile compounds of a native Chinese chilli pepper (Capsicum frutescens var) during ripening[J]. International Journal of Food Science & Technology, 2009, 44(12): 2470-2475.
[8] GUADAYOL J M, CAIXACH J, RIBé J. Extraction, separation and identification of volatile organic compounds from paprika oleoresin (Spanish type)[J]. Agric Food Chem, 1997, 45(5): 1868-1872.
[9] ROTSATCHAKUL P, CHAISERI S, CADWALLADER K R. Identification of characteristic aroma components of thai fried chili paste[J]. Agric Food Chem, 2008, 56(2): 528-536.
[10] van RUTH S M, ROOZEN J P. Gas chromatography/sniffing port analysis and sensory evaluation of commercially dried bell peppers (Capsicum annuum) after rehydration[J]. Food Chemistry, 1994, 51(2): 165-170.
[11] COOPER T H, GUZINSKI J A, FISHER C. Improved highperformanse liquid chromatography method for the determiation of major capsaicinoids in capsicum oleoresins[J]. Agric Food Chem, 1991, 39(12): 2253-2256.
[12] YANG Yongjuan, DING Zhuhong. Clustering analysis of volatile aroma compounds in dried chilli (Capsicum annum L.)[J]. Food Science, 2010, 31(4): 187-189.
[13] 徐亞丹, 王俊, 趙國軍. 基于電子鼻的對摻假的“伊利”牛奶的檢測[J]. 中國食品學報, 2006, 6(5): 111-117.
[14] 李達. 辣椒粉調味品工藝技術與風味品質相關性研究[D]. 貴陽: 貴州大學, 2010.
[15] 朱曉蘭, 劉百戰, 宗若雯. 辣椒油化學成分的氣相色譜-質譜分析[J]. 分析測試學報, 2003, 23(1): 67-68.
[16] van RUTH S, BOSCAINI E, MAYR D, et al. 干辣椒風味物質氣相色譜及質譜方法的研究[J]. 辣椒雜志, 2007(1): 41-44.
[17] 李達, 王知松, 丁筑紅. 固相微萃取-氣-質聯用法對干椒烘焙前后風味化合物的分析評價[J]. 食品科學, 2009, 30(16): 269-271.
[18] CREMER D R, EICHNER K. Formation of volatile compounds during heating of spice paprika (Capsicum annuum) powder[J]. Agric Food Chem, 2000, 48(6): 2454-2460.

