凍融循環下雞肉品質變化的低場核磁共振研究
李 玫,李苗云*,趙改名,張秋會,柳艷霞,高曉平,周曉梅
(河南農業大學食品科學技術學院,河南省肉制品加工與質量安全控制重點實驗室,河南 鄭州 450002)
禽肉以其低脂、高營養等特性而越來越受到消費者的青睞。目前,我國雞肉大多是以凍藏方式進行流通和銷售。雖然冷凍運輸環節的溫度控制較為嚴格,但由于銷售和管理的不完善,冷鏈環節存在較大的溫度波動[1],冷凍雞肉常出現凍融循環現象。
國內外有關凍融對凍肉品質影響的研究主要集中在肌肉蛋白結構和蛋白功能特性方面[2-5],但這些方法費時費力且樣品破壞程度較大。LF-NMR作為一種快速、無損檢測技術,通過測定反映水分子存在狀態的橫向弛豫時間T2來分析水分子與肌肉組織的相互作用[6-7]等。大量研究已證實LF-NMR弛豫時間與傳統重力學方法,如Honikel袋法和離心法測定的WHC之間具有一定的相關性[8-12]。Bertram等[10]根據T2確定肌肉中含有3種水群。Li Chunbao等[13]和Bertram等[14]研究了豬肉NMR數據及其食用品質(肉色及剪切力)和煮制特性的相關性。
目前,反復凍融對雞肉食用品質影響的研究較少且鮮有從水分分布及流動性角度解釋其變化。因此應用LF-NMR技術研究凍融循環下雞肉中水分分布和流動特性,結合食用品質變化,解釋反復凍融對雞肉食用品質的影響,為冷凍雞肉品質的在線評價提供技術支撐。
1 材料與方法
1.1 材料與試劑
生鮮雞胸肉購置于焦作大用實業有限公司,產品始終處于低溫狀態(0~2℃)。取3塊大小一致的完整雞胸肉,用自封袋包裝置于-18℃冰柜中凍藏。每48h取出置于(5±1)℃條件下解凍,24h后重新置于-18℃冰柜中凍藏。如此反復,分別于貯藏0、3、9、15d,即凍融0、1、3、5次取解凍后肉樣進行指標分析。
1.2 儀器與設備
PQ001 MicroMR柜式核磁共振成像儀 上海紐邁電子科技有限公司;Minolta Color Miniscan CR400色差儀 日本美能達公司;EasyMix拍擊式均質機 法國AES集團;ALLEGRA-64A高速冷凍離心機 美國Beckman Coulter有限公司;MIR-254低溫恒溫培養箱 日本三洋科研醫療設備;雷磁PXSJ-216 pH計 上海精密科學儀器有限公司。
1.3 方法
1.3.1 LF-NMR實驗
沿肌纖維方向取2.0g左右,修整為2cm×1cm×1cm的肉樣,放入直徑為15mm核磁專用檢測管中測定。每凍融一次重復測定5次,分析其弛豫特征值。
選用PQ001核磁共振成像分析儀(射頻線圈直徑為15mm,磁場強度為0.55特斯拉,1H共振頻率為22.7MHz,測量溫度為32℃)。選用硬脈沖CPMG序列[15]測定肉樣橫向弛豫時間T2,其主要參數設置為:τ值(90°脈沖和180°脈沖間隔時間)為100s,重復采樣4次,重復采樣等待時間為3s,獲得4000個自旋回波。使用儀器自帶反演軟件(NIUMAG T1T2T2*Invert Ver 4.08),設置反演參數對自由誘導指數衰減曲線進行T2反演,獲得T2弛豫圖譜,主要包括各弛豫過程的弛豫幅值及其對應的時間常數。應用加權算術平均數法計算各個橫向弛豫過程的弛豫時間。
1.3.2 肌纖維持水力的測定
1.3.2.1 解凍損失
肉樣解凍前稱量,解凍后用吸水紙擦去表面滲出水分并記錄質量,按式(1)計算解凍損失率。每檢測點平行測定3次。
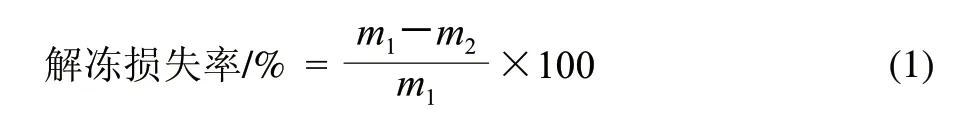
式中:m1為解凍前肉質量/g;m2為解凍后肉質量/g。
1.3.2.2 離心損失
取解凍后肉樣10.0g,稱取質量,4℃條件下5000r/min離心10min后吸水紙吸取肉表面水分,記錄質量,按式(2)計算離心損失率。每檢測點平行測定3次。
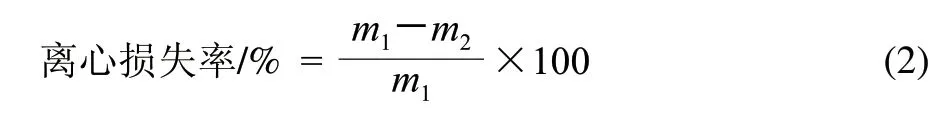
式中:m1為離心前肉質量/g;m2為離心后肉質量/g。
1.3.3 肉浸液pH值的測定
參照Ngapo等[16]的方法,稍作修改。稱取約10.0g絞碎肉樣于均質袋中,加100mL蒸餾水,置于拍打式均質機中均質100s后單層濾紙過濾取濾液備用。將校準后的pH計電極浸沒在肉浸液中,記錄樣液25℃時的讀數。每檢測點平行測定3次。
1.3.4 肉色的測定
應用CIE Lab色彩空間模型[17]定量描述肉樣的色澤變化情況。解凍后肉樣置于空氣中曝光10min。使用CR400便攜式色差儀(白板校準,D65光源,2°標準觀測角)在肉樣表面選取9個檢測點,每檢測點平行測定3次。
1.4 數據分析
應用SAS 9.2統計軟件對實驗數據進行方差分析和相關性分析,多重比較采用Duncan法。
2 結果與分析
2.1 凍融循環對自旋-自旋弛豫過程的影響
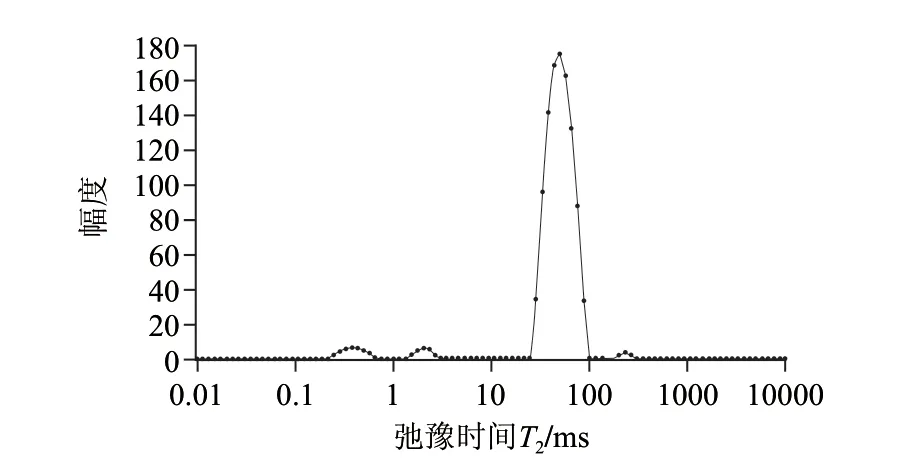
圖 1 雞肉橫向弛豫時間T2分布Fig.1 Distribution of transverse relaxation time in chicken
由圖1可知,弛豫圖譜上顯示4個峰,其中0~10ms(T2b)間有兩個小峰,代表與肌肉蛋白分子表面極性基團緊密結合的化合水;10~100ms(T21)的峰為主峰,其信號達到總信號的90%以上,該峰代表肌原纖維內截留的不易流動水,為肌肉中水分的主要存在形式;100~1000ms(T22)間組分代表肌原纖維晶格內的自由水[18]。這與大多數相關研究結果不同,其原因可能與原料肉品種、核磁共振分析測試條件[19]、反演算法以及弛豫結果分析方法等不同有關。
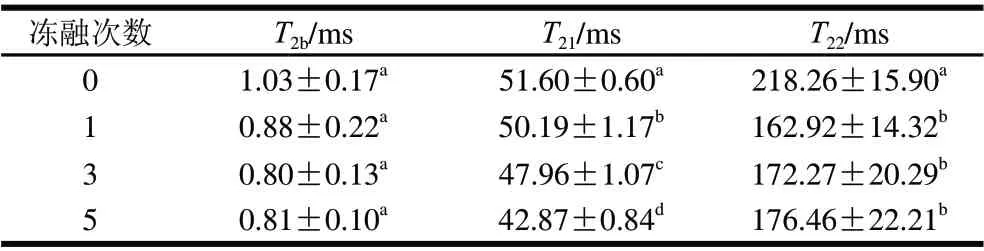
表 1 凍融次數對雞肉橫向弛豫時間的影響Table 1 Effect of freezing-thawing frequency on transverse relaxation time
由表1可知,凍融后T2b無顯著變化(P>0.05)。隨凍融次數增加,T21顯著降低(P<0.05),由新鮮雞肉的51.60ms依次下降為凍融1次的50.19ms,凍融3次的47.96ms和凍融5次的42.87ms,這表明不易流動水群的移動性變差,其不易流動性增強,原因可能是凍融引起肌原纖維蛋白空間構象發生變化而造成蛋白質持水能力的下降。T22代表肌肉中的自由水群,凍融1次后下降為162.92ms,與新鮮雞肉的218.26ms相比差異顯著,但是凍融1、3、5次之間無顯著差異,其變化趨勢可能與肌漿蛋白的冷凍變性有關[20]。
2.2 雞肉持水性能的變化

表 2 凍融次數對雞肉持水性的影響Table 2 Effect of freezing-thawing frequency on WHC
肉品貯藏及加工過程中的WHC是衡量其加工特性及經濟價值的重要指標之一,該指標還會對感官特性產生影響,如水分損失高表明肉樣多汁性較差。由表2可知,雞肉凍融3次的解凍損失率和離心損失率較凍融1次均變化不顯著,但凍融5次與凍融3次相比均顯著增大(P<0.05),分別由6.29%和15.00%增大為15.08%和19.16%,這可能與肌細胞膜完整性隨凍融次數的增加發生嚴重破壞,肌束間隙增大有關。
2.3 雞肉pH值的變化

表 3 凍融次數對雞肉pH值的影響Table 3 Effect of freezing-thawing frequency on pH
由表3可知,隨凍融次數的增加,雞肉的pH值從6.043下降為5.773且變化顯著(P<0.05)。由于肉汁中部分水分凍結為冰晶,肌細胞脫水,胞液的濃縮效應會增加離子強度,導致微環境緩沖能力降低從而造成pH值變化。pH值主要會對肌原纖維蛋白凈電荷產生影響[7,21],其變化會誘導肌絲橫向收縮,肌原纖維內持留的水分流出。pH值下降程度越大,肌原纖維蛋白質變性越嚴重[22-23],據此可推斷隨凍融次數的增加,雞肉肌原纖維變性程度加深。
2.4 雞肉肉色的變化
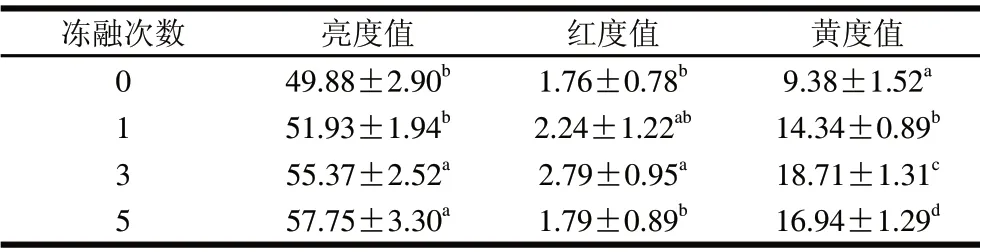
表 4 凍融次數對雞肉肉色的影響Table 4 Effect of freezing-thawing frequency on color
由表4可知,凍融至第3次時,解凍后雞肉亮度值、紅度值和黃度值均比鮮肉顯著增大(P<0.05),而凍融5次時,紅度值和黃度值均下降顯著(P<0.05)。凍融循環過程中,汁液流失到達肌肉表面,使肌肉的亮度顯著增加[14]。凍藏過程中因脂質氧化和肌紅蛋白冷凍變性或長期低溫貯藏,高鐵肌紅蛋白還原酶活性受到抑制,高鐵肌紅蛋白積累而引起紅度值下降。黃度值的增加可能與脂肪氧化程度的加深有關。
2.5 相關性分析
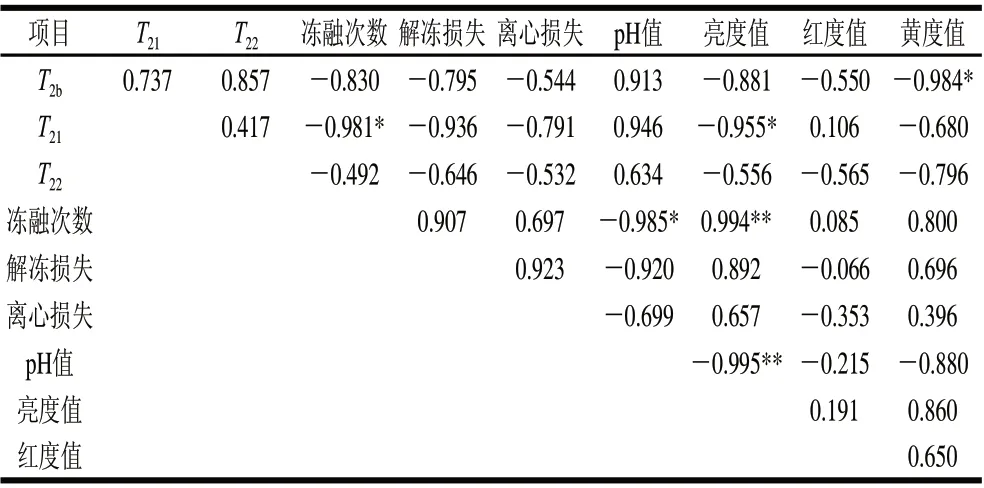
表 5 橫向弛豫時間與品質指標間的相關性分析Table 5 Correlational analysis between transverse relaxation time and quality indexes
由表5可知,T21與凍融次數和亮度值顯著相關(P<0.05),與解凍損失和離心損失高度負相關,相關系數分別是-0.936和-0.791,與pH值的相關系數為0.946;T2b與黃度值顯著負相關(P<0.05);3個水群的橫向弛豫時間彼此相關。肌肉蛋白的微環境是NMR T2弛豫特性的決定性因素[18],可以根據該指標分析蛋白質的變性程度,即蛋白質-水相互作用的變化。T21與肌原纖維橫截面面積[9]及肌節長度[23]呈正相關,該值下降表明不易流動水的移動性下降。Li Chunbao等[13]研究認為不易流動水與肌肉保水性間的關系較為重要。
3 結 論
凍融循環及凍藏時間的延長會顯著影響雞胸肉色澤及持水力等食用品質,因此雞肉在流通過程中,應盡可能避免出現凍融現象。根據凍融過程中肌肉3個水群的橫向弛豫時間的變化可知,借助肌纖維水分分布與流動情況判斷凍肉品質變化具有一定的可行性。通過分析該指標與品質指標間的相關性發現,T21與亮度值及凍融次數間顯著相關(P<0.05)且與解凍損失、離心損失等持水性指標高度負相關。由此,選擇T21作為在線評價凍融后雞肉持水性能及其食用品質變化的一個重要指標。
[1] 李苗云, 樊靜, 趙改名, 等. 凍融變化對速凍肉餡品質的影響[C]//第八屆中國肉類科技大會論文集. 2008: 183-187.
[2] 余小領, 李學斌, 閆利萍, 等. 不同凍結和解凍速率對豬肉保水性和超微結構的影響[J]. 農業工程學報, 2007, 23(8): 261-266.
[3] MORTENSEN M, ANDERSEN H J, ENGELSEN S B, et al. Effect of freezing temperature, thawing and cooking rate on water distribution in two pork qualities[J]. Meat Science, 2006, 72(1): 34-42.
[4] 李金平, 李春保, 徐幸蓮, 等. 反復凍融對牛外脊肉品質的影響[J]. 江蘇農業學報, 2010, 26(2): 406-410.
[5] 李金平, 周光宏, 徐幸蓮, 等. 反復凍融對牛肉解凍溫度變化和持水能力的影響[J]. 食品科學, 2009, 30(增刊1): 46-48.
[6] HAIDUC A M, DUYNHOVEN J V. Correlation of porous and functional properties of food materials by NMR relaxometry and multivariate analysis[J]. Magnetic Resonance Imaging, 2005, 23(2): 343-345.
[7] BERTRAM H C, ENGELSEN S B, BUSK H, et al. Water properties during cooking of pork studied by low-field NMR relaxation: effect of curing and the RN--gene[J]. Meat Science, 2004, 66(2): 437-446.
[8] HONIKEL K O, KIM C J, HAMM R, et al. Sarcomere shortening of prerigor muscle and its influence on drip loss[J]. Meat Science, 1986, 16(4): 267-282.
[9] BERTRAM H C, ANDERSEN H J, KARLSSON A H. Comparative study of low-field NMR relaxation measurements and two traditional methods in the determination of water holding capacity of pork[J]. Meat Science, 2001, 57(2): 125-132.
[10] BR?NDUM J, MUNCK L, HENCKEL P, et al. Prediction of waterholding capacity and compression of porcine meat with comparative spectroscopy[J]. Meat Science, 2000, 55(2): 177-185.
[11] BERTRAM H C, D?NSRUP S, KARLSSON A H, et al. Continuous distribution analysis of T2relaxation in meat: an approach in the determination of water holding capacity[J]. Meat Science, 2002, 60(3), 279-285.
[12] BROWN R J S, CAPOZZI F, CAVANI C, et al. Relationship between1H NMR relaxation data and some technological parameters of meat: a chemometric approach[J]. Journal of Magnetic Resonance, 2000, 147(1): 89-94.
[13] LI Chunbao, LIU Dengyong, ZHOU Guanghong, et al. Meat quality and cooking attributes of thawed pork with different low field NMR T21[J]. Meat Science, 2011, 92(2): 79-83.
[14] BERTRAM H C, AASLYNG M D, ANDERSEN H J. Elucidation of the relationship between cooking temperature, water distribution and sensory attributes of pork: a combined NMR and sensory study[J]. Meat Science, 2005, 70(1): 75-81.
[15] BERTRAM H C. Field gradient CPMG applied on postmortem muscles[J]. Magnetic Resonance Imaging, 2004, 22(4): 557-563.
[16] NGAPO T M, BABARE I H, REYNOLDS J, et al. Freezing and thawing rate effects on drip loss from samples of pork[J]. Meat Science, 1999, 53(3): 149-158.
[17] PAKULA C, STAMMINGER R. Measuring changes in internal meat colour, colour lightness and colour opacity as predictors of cooking time[J]. Meat Science, 2012, 90(3): 721-727.
[18] 戚軍, 高菲菲, 李春保, 等. 低場NMR研究凍融過程中羊肉持水力的變化[J]. 江蘇農業學報, 2010, 26(3): 617-622.
[19] BERTRAM H C, ANDERSEN R H, ANDERSEN H J. Development in myofibrillar water distribution of two pork qualities during 10-month freezer storage[J]. Meat Science, 2007, 75(1): 128-133
[20] STRAADT I K, RASMUSSEN M, ANDERSEN H J, et al. Aging induced changes in microstructure and water distribution in fresh and cooked pork in relation to water holding capacity and cooking loss A combined confocal laser scanning microscopy (CLSM) and low-field nuclear magnetic resonance relaxation study[J]. Meat Science, 2007, 75(4): 687-695.
[21] OFFER G, TRINICK J. On the mechanism of water holding in meat: the swelling and shrinking of myofibrils[J]. Meat Science, 1983, 8(4): 245-281.
[22] SCH?FER A, ROSENVOLD K, PURSLOW P P, et al. Physiological and structural events post mortem of importance for drip loss in pork[J]. Meat Science, 2002, 61(4): 355-366.
[23] LINDON J C, TRANTER G E, KOPPENAAL D. Encyclopedia of spectroscopy and spectrometry[M]. UK: Academic Press, 2010: 2272-2279.

