Ezrin多克隆抗體制作及應用
張宏玲 萬駿 嚴飛 張新勝 曹威 陶偉 黃來強
(1.清華大學生命科學學院,北京 100084;2.清華大學深圳研究生院生命與健康學部 生物醫藥研究中心和基因與抗體治療重點實驗室,深圳 518055)
埃茲蛋白(Ezrin)是一種重要的膜-細胞骨架連接分子,屬于ERM家族(Ezrin,Radixin,Moesin)中的一員。ERM家族蛋白的同源性主要體現在他們都在N-末端有一個同源性很高的FERM 功能域(FERM domain),以及在C-末端的不同氨基酸位置上有一個關鍵的、與其激活有關的蘇氨酸磷酸化位點,FERM功能域在介導細胞表面黏附分子與細胞骨架連接的生理功能中起著關鍵作用。通過Ezrin的橋接作用,可將肌動蛋白細胞微絲與細胞膜相連,從而產生一系列細胞功能,如細胞形態的改變、細胞運動、黏附、有絲分裂、細胞極性等[1-3]。研究發現Ezrin在多種腫瘤中表達異常,并且在腫瘤細胞轉移過程中扮重要角色[4,5]。Ezrin通過調節黏附分子和信號轉導以及細胞骨架及其相關蛋白的功能,參與細胞與細胞、細胞與基質之間的相互作用,從而在腫瘤發展、浸潤和轉移過程中起著重要作用[6,7]。
研究腫瘤相關蛋白功能機理的一個重要方法是通過找出其相互作用的蛋白,進而闡述它在整個網絡狀信號通路中所起的作用。本研究通過原核誘導表達,純化出Ezrin全長蛋白,便于后續驗證與其相互作用蛋白的體外直接結合,并通過蛋白免疫動物,獲得針對Ezrin的多克隆抗體,為研究其在真核細胞以及在腫瘤發生發展過程的相關功能奠定基礎。
1 材料與方法
1.1 材料
質粒pET-28a(+)-ezrin,重組大腸桿菌E. coli BL21(DE3)[攜帶質粒LpET-28a(+)-ezrin]為本實驗室構建和保存;HeLa,HepG2,HEK 293,CNE,NIH3T3細胞為本實驗室儲存; 用于飼養哺乳動物細胞的DMEM培養基購自Gibico公司;新西蘭大耳兔、昆明鼠,購買自廣州實驗動物中心;蛋白質Marker購自Fermentas;HRP酶標二抗(抗鼠和抗兔)及羅丹明標記的二抗購自KPL公司。
1.2 方法
1.2.1 Ezrin蛋白原核誘導表達及純化 隨機挑取單克隆接種于5 mL含適量抗生素LB液體培養基中,于37℃、200 r/min條件下過夜培養。然后按2%接種量接種于200 mL含抗生素新鮮的LB液體培養基中,于37℃、200 r/min條件下繼續培養。當菌液濃度達到OD600=0.6時加入終濃度1 mmol/L IPTG,37℃、200 r/min條件下培養。IPTG誘導5 h,5 000 r/min 離心5 min,收集菌體,用40 mL 20 mmol/L Tris-HCl(pH8.0)緩沖液混合重懸,冰上進行超聲處理。5 000 r/min離心,根據蛋白表達情況分別收集上清,沉淀。結果顯示Ezrin蛋白主要在上清中。
純化方法:Ni-NTA His Binding@Resin 2 mL柱預處理:用5 mL去離子水洗滌;加0.5-1 mL NiSO4;再用5 mL去離子水洗滌。用10 mL 20 mmol/L Tris-HCl(pH8.0)+8 mol/L尿素平衡柱。上樣準備好的蛋白上清溶液,收集流出液。用30 mL 20 mmol/L Tris-HCl、100 mmol/L咪 唑、1 mmol/L β-巰 基 乙 醇(pH8.0),收集流出液。用10 mL 20 mmol/L Tris-HCl,300 mmol/L imidazole,1 mmol/L β-巰基乙醇,pH8.0洗脫蛋白,收集1 mL/管,蛋白在此步收集。最后用10 mL 20 mmol/L Tris-HCl,5 mmol/L imidazole,1 mmol/L β-巰基乙醇,pH8.0洗滌,收集流出液。用10 mL去離子水洗滌柱子,充滿20%乙醇,放在4℃冰箱保存。純化的蛋白用SDS-PAGE電泳檢測。
1.2.2 Ezrin兔抗血清的制備 取2 mL 蛋白(1.6 mg/mL)制品與等體積的弗氏完全佐劑混合,在新西蘭大耳兔背部選取4-6個點,進行皮下多點接種,共接種4次,每次間隔14 d,第4次加強免疫后7 d耳緣靜脈采血,分離血清,進行效價檢測,獲陽性結果后,進行心臟取血,將血液收集到無菌的試管中,室溫靜置1-2 h,待血液凝固后,轉移到4℃冰箱中,放置過夜,至血清析出,將血清轉移到無菌的離心管中,10 000 r/min、4℃離心30 min,取上清,保存于-70℃備用。
1.2.3 Ezrin鼠抗血清制備 5只3-4周齡昆明小鼠,將200 μg抗原蛋白溶于250 μL生理鹽水并與等體積弗氏完全佐劑充分乳化,對小鼠進行皮下注射。首次免疫2周后進行第2次免疫,免疫原劑量減半,并用弗氏不完全佐劑乳化。第2 次免疫后每隔7 d按照2次免疫的方法繼續免疫,第4次免疫后第3天,分離血清,進行效價檢測,獲陽性結果后進行心臟取血,將血液收集到無菌試管中,室溫靜置1-2 h,待血液凝固后轉移到4℃冰箱中,放置過夜,至血清析出,將血清轉移到無菌離心管中,10 000 r/min、4℃離心30 min,取上清,保存于-70℃備用。
1.2.4 ELISA檢測抗血清效價 抗原包被:將抗原用包被液14 000稀釋(10 μg/mL終濃度),100 μg/孔加入聚苯乙烯96孔反應板中,4℃放置過夜。洗滌:次日傾去凹孔內的液體,PBST洗3次。封閉:加100 μL/孔3% BSA,室溫放置0.5 h。洗滌:用PBST洗3次。加待測樣品(一抗):將抗體血清在另一塊板上用PBS連續稀釋,100 μL/孔加到已包被的板上,每個樣品平行做兩份,免疫前的血清作為陰性對照。加蓋37℃恒溫箱溫育1 h。洗滌:用洗滌液洗3次。加HRP酶標二抗:用封閉液1∶8 000稀釋,100 μL/孔,加蓋37℃恒溫箱溫育1 h。洗滌:用PBST洗5次,蒸餾水洗2次。顯色:加新鮮配制的底物溶液100 μL/孔暗處放置5-30 min,顯示藍色。終止反應,比色:加50 μL/孔終止液,顏色變黃;用酶標儀測定450 nm處各孔的吸光值,陽性反應的最大稀釋度為待測樣品的效價。
1.2.5 Western blotting 檢測 將收集的細胞加入SDS加樣緩沖液,煮沸10 min,離心后取上清液進行SDS-PAGE后電轉移至PVDF膜上,以5%的脫脂牛奶封閉2 h,與自制兔抗人,鼠抗人TRIP-1的多克隆抗體4℃過夜,之后用TBST每10 min洗1次,共3次;加入相應二抗室溫1 h后用TBST洗膜3次,每次10 min,曝光。
1.2.6 細胞免疫熒光 固定在蓋玻片上的細胞用PBS漂洗3次,每次5 min;用3.7%的甲醛固定細胞,37℃ 10 min;0.1% TritonX-100透化10 min;PBS漂洗3次,每次5 min;5%山羊血清(PBS配制)室溫封閉1 h;去除山羊血清封閉液之后,直接加入5% BSA稀釋的一抗,4℃雜交過夜。PBS漂洗5次,每次5 min;加入5% BSA稀釋的二抗,室溫避光雜交1 h;PBS漂洗5次,每次5 min;抗催滅封片劑封片,激光共聚焦熒光顯微鏡上觀察。
1.2.7 Protein G親和層析柱純化抗體 配制緩沖液:起始緩沖液為TBS緩沖液,洗脫緩沖液為pH2.7 0.1 mmol/L甘氨酸鹽酸。
準備收集管:取1.5 mL離心管,每支離心管加70 μL pH9.0 1 mol/L Tris-HCl。
樣品準備:抗血清經TBS進行透析過夜,并經0.22 μm微孔濾膜濾過。
透析過的待純化的樣品15-25 mL上柱,流速為0.5 mL/min,將留出的樣品反復過柱。然后以同樣的流速用10-20倍體積的TBS緩沖液洗滌,去除未結合和非特異性結合的蛋白,洗滌是否完全可以通過測定OD280的吸光度進行。洗脫緩沖液(pH2.7,0.1 mmol/L甘氨酸鹽酸)6-7 mL每管1 mL收集洗脫液,測每管OD280吸收值。收集第2洗脫峰,BCA法測蛋白含量,4℃保存備用。
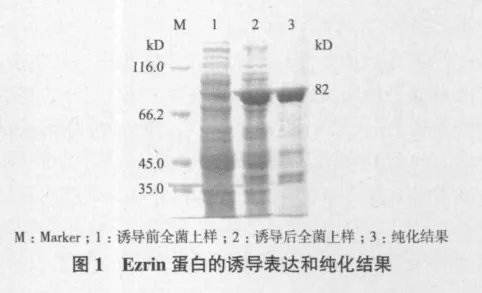
純化的抗體用SDS-PAGE電泳鑒定其純度:用12%分離膠、5%濃縮膠,恒流下電泳2 h,考馬斯亮藍R250(Pharmacia)染色。
2 結果
2.1 Ezrin蛋白的表達與純化
利用構建好的pET-28a(+)-ezrin載體分別轉化E. coli BL21(DE3),成功地原核誘導表達Ezrin全長蛋白于上清,并且用經鎳柱純化好的蛋白進行下一步試驗,即免疫小鼠和新西蘭大耳兔。
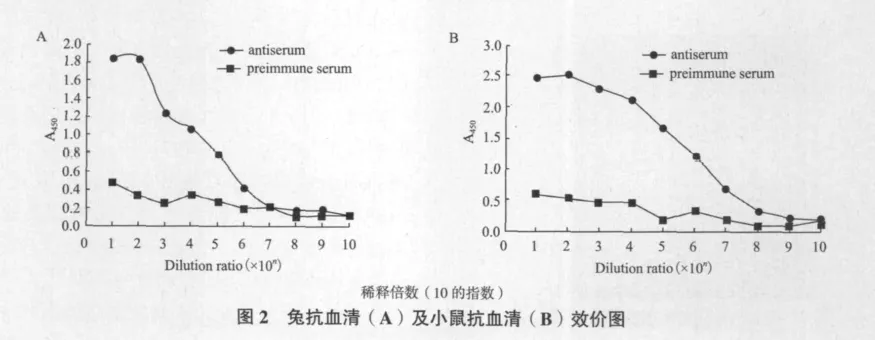
2.2 Ezrin抗血清效價檢測
將用Ezrin蛋白抗原免疫4次之后的新西蘭大耳兔以及昆明鼠抽取血清樣本通過ELISA法測量抗體效價,計算陽性血清和陰性血清A450值之比(antiserum/preimmune serum,a/p),當a/p≥2.1時為陽性,當1.5≤a/p<2.1時為可疑,當a/p<1.5時為陰性。抗血清效價測定,經過免疫過的兔和鼠的血清,通過ELISA法測定其效價,如圖2所示,兩種抗血清稀釋倍數為106時,和陰性血清相比,仍呈現陽性反應,表明免疫后的兩種抗血清的效價均達到106。
2.3 利用抗體檢測真核細胞及組織蛋白表達情況
利用抗體檢測真核細胞及組織蛋白表達情況,各細胞及組織蛋白,12%蛋白膠PAGE電泳,將制作好的Ezrin鼠源及兔源抗體用于Western blotting試驗,檢測多種細胞和組織當中的Ezrin表達情況。將所制備抗體3 000倍稀釋用來檢測真核細胞內源性Ezrin蛋白表達情況,如圖3所示,兔抗和鼠抗均能夠很好的檢測真核細胞內源性的蛋白表達,包括293、HeLa、CNE及NIH3T3細胞株。在HepG2細胞中,沒有檢測到Ezrin蛋白的表達。以上結果說明制備的抗血清具有較高的特異性和靈敏性。

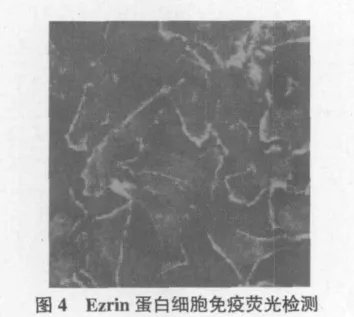
2.4 細胞免疫熒光法檢Ezrin蛋白細胞內定位
取HeLa細胞進行免疫熒光,用Ezrin鼠抗來檢測其在細胞內的定位情況,二抗rhodamine標記的羊抗鼠抗體。熒光顯微鏡下拍照。將制備的Ezrin鼠抗人多克隆抗體100倍稀釋進行細胞免疫熒光化學染色試驗分析,發現制備的抗體能夠進行細胞免疫熒光化學染色,且染色效果十分良好,同時發現,Ezrin蛋白在細胞質內質網位置定位明顯,此定位與發表的相關文獻吻合(圖4)。
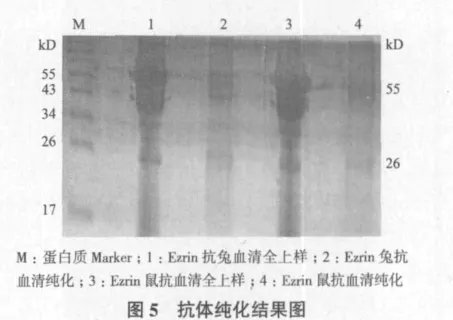
2.5 Ezrin抗體純化
取免疫過的兔和鼠的抗血清,利用protein G純化方法,將2種抗體進行了初步純化,從純化結果(圖5)可清楚的看到抗體重鏈(55 kD)和輕鏈(26 kD),但是純化得率較低,且有雜帶。其原因可能是抗血清中的抗體亞型與protein G柱子結合能力較低,或者洗脫緩沖液的pH值需要改進和調整。
3 討論
Ezrin是屬于ERM家族蛋白中與腫瘤密切相關的蛋白,它在多種癌癥組織中高表達且對腫瘤細胞的遷移起著重要的調控作用。對其功能的研究將進一步揭示癌癥發生發展的機理并有望找到治療癌癥的新靶點。本試驗中原核表達純化出的Ezrin蛋白也可以直接用于驗證相互作用和體外蛋白活性的試驗,為揭示與Ezrin相互作用的蛋白創造條件。抗體是研究基因功能的重要工具[8-11]。制備一種效價高、特異性好的抗體是研究疾病相關基因的表達、定位和生物學功能非常重要的一步。抗體包括多克隆抗體,單克隆抗體等。單克隆抗體的特異性較好,但制作過程比較繁瑣。多克隆抗體則制作較為容易。本研究通過原核誘導表達與純化[12],得到較為純凈的Ezrin蛋白,采用直接免疫兔子和小鼠的方法獲得抗血清。兔抗和鼠抗均能夠很好的檢測真核細胞內源性的蛋白表達,包括293、HeLa、CNE及NIH3T3細胞株。在HepG2細胞中,沒有檢測到Ezrin蛋白的表達,這與文獻報道相符。曾有文獻報道在HepG2細胞株當中,Ezrin的表達量很少[13]。ELISA是檢測抗體質量相關系數的重要手段[14,15],本研究制備的抗血清經過ELISA測定具有較高的效價。未經純化的抗血清效價非常高,稀釋很高的倍數仍可用于Western blotting和免疫熒光等試驗,表明制備的抗血清可用于多種免疫學試驗,且有較高的特異性和靈敏度。
抗血清純化可使用幾種不同的方法,常用的是蛋白A/G結合法和抗原親和純化法[16,17]。為了進一步提高抗體的純度,采用protein G方法對抗體進行了純化,但純化效率有待提高。分析原因可能是抗血清中的種屬亞型與protein G的結合能力較弱,或者洗脫緩沖液的pH值需要進一步調整和優化。
綜上所述,本研究制備的Ezrin多克隆抗體具有與其抗原特異性結合的特征,并成功應用于ELISA,免疫印跡和免疫熒光試驗,其純化方法仍需進一步改進。這為繼續深入研究此蛋白的病理、生理學功能及其調控打下了基礎。
4 結論
通過將原核表達純化,獲得了較為純凈的Ezrin全長蛋白。通過免疫新西蘭大耳兔和昆明小鼠,獲得了抗血清。通過ELISA,Western blotting和免疫熒光試驗驗證了抗體的效價和特異性,證明用該方法可制備具有較高特異性和靈敏度的多克隆抗體。
[1] Bretscher A, Edwards K, Fehon RG. ERM proteins and merlin:integrators at the cell cortex[J]. Nat Rev Mol Cell Biol, 2002, 3:586-599.
[2] Gautreau A, Louvard D, Arpin M. Morphogenic effects of Ezrin require a phosphorylation-induced transition from oligomers to monomers at the plasma membrane[J]. J Cell Biol, 2000, 150(1):193-203.
[3] Algrain M, Turunen O, Vaheri A, et al. Ezrin contains cytoskeleton and membrane binding domains accounting for its proposed role as a membrane-cytoskeletal linker[J]. J Cell Biol, 1993, 120(1):129-139.
[4] 盧航青, 鄭杰.埃茲蛋白:生物學特征及其在腫瘤轉移中的作用[J].細胞生物學雜志, 2005, 27:257-262.
[5] 王友元, 李勁松, 陳偉良.埃茲蛋白相關信號通路與腫瘤侵襲轉移[J].國際腫瘤學雜志, 2011, 38(3):166-169.
[6] Yu Y, Khan J, Khanna C. Expression profiling identifies the cytoskeletal organizer Ezrin and the developmental homeoprotein Six-1as key metastatic regulators[J]. Nat Med, 2004, 10:175-181.
[7] Makitie T, Carpen O, Vaheri A. Ezrin as a prognostic indicator and its relationship to tumor characteristics in uveal malignant melanoma[J]. Invest Ophthalmol Vis Sci, 2001, 42(11):2442-2449.
[8] 王俊茹, 覃文新, 李錦軍, 等.肝癌相關蛋白HCAP1的表達、抗體制備及其亞細胞定位[J].中國免疫學雜志, 2003, 19(1):26-28.
[9] 王仁, 楊向東, 屈順林, 等.新的人突觸相關蛋白(FRG4)抗原表位分析及抗體制備[J].中國免疫學雜志, 2005, 21(7):531-534.
[10] 劉雨飛, 丁麗華, 郝春芳, 等.轉錄因子XBP21的融合表達、純化及多克隆抗體的制備[J].中國生物化學與分子生物學報, 2004, 20(6):762-767.
[11] 韓克軍, 楊美香, 李燕, 等.腫瘤相關抗原基因HCA520重組蛋白的表達純化及其肝癌患者血清中相應抗體的分析[J].中國生物化學與分子生物學報, 2003, 19(1):31235.
[12] 郭艷榮, 常曉月, 崔曉君, 等. eEFIAl基因克隆、原核分泌表達及融合蛋白純化[J].生物技術通報, 2011(6):127-133.
[13] Zhang Y, Hu M, Wu W, et al. The membrane-cytoskeleton or ganizer ezrin is necessary for hepatocellular carcinoma cell growth and invasiveness[J]. J Cancer Res Clin Oncol, 2006, 132:685-697.
[14] 張小兵, 邸祿芹, 吳萌, 等.單克隆抗體與多克隆抗體配對ELISA方法比較[J].生物技術通報, 2009(11):125-129.
[15] 陳卓, 劉家駒, 畢亮, 等. NPR1多肽抗體的制備和應用[J].生物技術通報, 2012(1):145-150.
[16] 張圓, 莊然, 金伯泉, 等.兔抗mLAIR21胞外區抗體的制備、純化和鑒定[J].細胞與分子免疫學雜志, 2005, 21(5):595-597.
[17] 王京, 汪立, 范慧, 等. CMTM12v17/CKLFSF12v17多克隆抗體的制備、親合純化與鑒定[J].中國免疫學雜志, 2006, 22:1132-1136.

