干旱脅迫及復水對玉簪生長和光合作用的影響
張金政,張起源,孫國峰,何卿,李曉東* ,劉洪章*
(1.中國科學院植物研究所,北京100093;2.吉林農(nóng)業(yè)大學生命科學學院,吉林長春130118;3.國家知識產(chǎn)權(quán)局專利局專利審查協(xié)作北京中心,北京100190)
近年來,在全球氣候變化背景下干旱頻繁發(fā)生且日趨嚴重,大部分國家和地區(qū)都不同程度地受到干旱威脅[1],合理利用水資源成為一個世界性的課題。而水資源短缺已成為干旱地區(qū)限制植物正常生長發(fā)育的關(guān)鍵因素。
玉簪屬(Hosta)植物作為重要的耐陰地被觀賞植物,被世界各地廣泛栽培應用。玉簪為淺根性地被植物,根系分布不超過40 cm,其耐旱能力與木本植物相比是有限的。大多數(shù)玉簪喜潮濕環(huán)境,生長季節(jié)每周平均的降雨量25~30 mm利于玉簪生長[2]。在園林綠化過程中,經(jīng)常會因降雨過少而導致干旱脅迫從而使玉簪的生長受到抑制。由于玉簪屬植物應用量較大,需要進行節(jié)水栽培。目前園林應用的玉簪主要有兩類,有走莖的玉簪和無明顯走莖的玉簪;二者對肥料的需求和利用效率不同[3];而二者對水分的需求和利用效率有無差異尚不清楚。
干旱脅迫能夠?qū)χ参锏耐獠啃螒B(tài)、內(nèi)源激素、光合作用等產(chǎn)生多方面的影響[4-5]。短期或輕度干旱脅迫下植物葉片水勢降低、氣孔關(guān)閉,降低了CO2的攝取與光合作用;長期而嚴重的干旱脅迫可抑制植株生長,并引起外觀形態(tài)和生物量的變化,甚至會致使植物死亡[6-10]。而短期干旱脅迫后復水,部分生理指標能得到不同程度的恢復[11],既保證了植物的生長發(fā)育需要又做到了節(jié)水,成為近年研究的一個熱點。然而有關(guān)干旱脅迫及復水對玉簪生長和光合作用的影響方面的研究尚未見報道。本文以中國原產(chǎn)玉簪屬原種東北玉簪(H.clausa var.ensata)(有走莖小型玉簪)和紫萼玉簪(H.ventricosa)(無走莖大型玉簪)為材料,通過研究干旱脅迫及脅迫后復水對2種玉簪干物質(zhì)量、部分形態(tài)指標、葉綠素含量、氣體交換和葉綠素熒光參數(shù)的影響,旨在揭示干旱脅迫及復水對玉簪屬植物生長和光合作用的影響機制,為提高玉簪屬植物水分利用效率和實行節(jié)水栽培提供理論依據(jù)。
1 材料與方法
1.1 試驗材料與處理
試驗在中國科學院植物研究所植物園引種馴化組試驗地進行。2010年4月選擇田間生長一致的3年生東北玉簪(有走莖小型玉簪)和紫萼玉簪(無走莖大型玉簪)大苗移栽到花盆中(規(guī)格為29 cm×24 cm,每盆裝栽培土6 kg,栽植1株,每株留1芽),進行正常的栽培管理。光照強度為自然光照的50%(黑色遮陽網(wǎng)遮蔭)。栽培基質(zhì)為園土∶黃沙土∶草炭 =3∶1∶1,其營養(yǎng)狀況為:全氮0.012%、水解性氮11.3 mg/kg、全磷12.2 mg/kg、全鉀 1.68%、有機質(zhì) 0.312%、pH 8.2。
于2010年6月開始進行干旱脅迫處理。根據(jù)張起源[12]的研究結(jié)果,試驗設3個水分梯度:對照(CK,土壤相對含水量為90% ~95%)、中度干旱脅迫(moderate drought stress,簡寫為MD,土壤相對含水量為50% ~55%)和重度干旱脅迫(severe drought stress,簡寫為SD,土壤相對含水量為30% ~35%)。脅迫時間:15,30和45 d。開始控水后每天18:00采用稱重法測量土壤含水量,補充當天的水分消耗,使土壤含水量保持在設定范圍內(nèi)。對不同脅迫處理到達設定脅迫時間后的相關(guān)指標(形態(tài)指標、生物量、葉綠素含量、氣體交換參數(shù)和葉綠素熒光參數(shù))進行測定,作為復水前的基準值;測定完立即復水(rewatering,簡寫為RW,恢復至土壤相對含水量為80% ~85%),復水后15 d再次分別對CK、MD、SD、中度干旱脅迫處理15 d后復水15 d(MD15+RW15)和重度干旱脅迫處理15 d后復水15 d(SD15+RW15)、中度干旱脅迫處理30 d后復水15 d(MD30+RW15)和重度干旱脅迫處理30 d后復水15 d(SD30+RW15)的相關(guān)指標進行測定。3次重復。
1.2 測定項目及方法
干物質(zhì)量測定:干旱脅迫處理后15,30,45 d,以及脅迫后復水15 d,每個處理取3盆植株分別測定地上部、地下部干物質(zhì)量。取3盆植株清除根系周圍的泥土并清洗全株后,用吸水紙吸去多余的水分,在105℃下殺青20 min,85℃烘干至恒重,用電子天平(精確度0.001 g)稱其干物質(zhì)量。
形態(tài)指標測定:分別于干旱處理后15,30,45 d,以及脅迫后復水15 d測定側(cè)芽數(shù)、葉片數(shù)、總?cè)~面積、須根數(shù)量、株高等。其中總?cè)~面積采用數(shù)碼相機和Photoshop軟件非破壞性測定[13]。
葉綠素含量測定:參考Arnon[14]的方法,分別于干旱處理后15,30,45 d,以及脅迫后復水15 d,選取5片成熟功能葉片,用直徑6 mm的打孔器分別打20個葉圓片,用25 mL 80%丙酮于暗處浸提48 h,其間每隔2 h振蕩1次,使葉綠素均勻分布于丙酮溶液中,至葉圓片完全泡白。用UV-4802型分光光度計(USA)分別在663,646及470 nm波長下測定 OD值,根據(jù)修正的Arnon公式計算出葉綠素a(Chla)、葉綠素b(Chlb)和總?cè)~綠素[Chl(a+b)]含量。修正的Arnon公式如下:
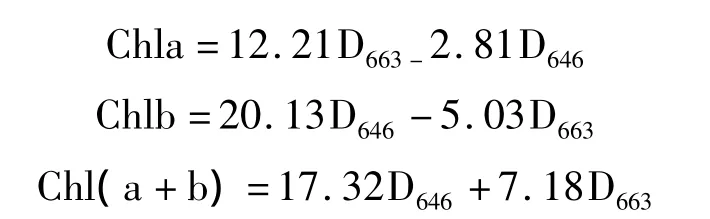
氣體交換參數(shù)測定:采用LI-6400便攜式光合儀(LICOR Inc,USA),分別于干旱處理后15,30,45 d,以及脅迫后復水15 d的上午8:00-11:00選取玉簪中部成熟功能葉片進行測定。儀器采用開放式氣路,內(nèi)置光源,光強為600 μmol/(m2·s)(2 種玉簪飽和光強[15]),主要測定葉片凈光合速率(Pn,μmol/m2·s)、氣孔導度(Gs,mmol/m2·s)、胞間 CO2濃度(Ci,μmol/m2·s)、蒸騰速率(Tr,mmol/m2·s)等參數(shù),5 次重復。
葉綠素熒光參數(shù)測定:采用LI-6400便攜式光合儀(LICOR Inc,USA),分別于干旱處理后15,30,45 d,以及脅迫后復水15 d的上午8:00-11:00選取玉簪中部成熟功能葉片于光合速率測定過程中,施加作用光(600 μmol/m2·s),測定光適應下的最大熒光(Fm')、光適應下最小熒光(Fo')、穩(wěn)態(tài)熒光產(chǎn)量(Fs);于22:00-24:00選取中部功能葉片測定暗適應下的初始熒光(Fo)和最大熒光(Fm),5次重復。根據(jù)以下公式計算出以下熒光參數(shù):1)光系統(tǒng)II(PSII)最大光能轉(zhuǎn)化效率,F(xiàn)v/Fm=(Fm-Fo)/Fm;2)光適應下PSII最大光能轉(zhuǎn)化效率,F(xiàn)v'/Fm'=(Fm'-Fo')/Fm';3)PSII電子傳遞量子效率,ФPSII=(Fm'-Fs)/Fm';4)光化學猝滅系數(shù),qP=(Fm'-Fs)/(Fm'-Fo');5)非光化學猝滅系數(shù),NPQ=(Fm-Fm')-1。
1.3 數(shù)據(jù)處理與分析
采用Excel進行數(shù)據(jù)處理,SPSS 11.0軟件(SPSS Inc.,USA)進行方差分析和Duncan多重比較,并用Sigma Plot 10.0(SPSS Inc.,USA)進行作圖。
2 結(jié)果與分析
2.1 干旱脅迫及復水對2種玉簪干物質(zhì)量的影響
與對照相比,隨干旱脅迫時間的延長東北玉簪MD和SD 處理地上部干物質(zhì)量逐漸減少。處理后15 d,MD和SD處理與對照無顯著差異;處理后30 d,SD處理顯著低于對照;處理后45 d,SD處理顯著低于MD處理,MD處理顯著低于對照(圖1A)。重度干旱脅迫處理15 d后復水15 d(SD15+RW15),干物質(zhì)量恢復到對照水平;而無論中度干旱脅迫處理30 d后復水15 d(MD30+RW15),還是重度干旱脅迫處理30 d后復水15 d(SD30+RW15),干物質(zhì)量均顯著低于對照和干旱脅迫處理(圖1A)。干旱脅迫處理后短期內(nèi)(處理后15 d)MD和SD處理地下部干物質(zhì)量顯著高于對照(即所謂的旱長根);而隨干旱脅迫時間的延長MD和SD處理對地下部干物質(zhì)量增長的抑制作用逐漸顯現(xiàn):處理后30 d,SD處理顯著低于對照;處理后45 d,SD處理顯著低于MD處理,MD處理顯著低于對照(圖1B)。無論中度干旱脅迫處理還是重度干旱脅迫處理后復水,地下部干物質(zhì)量均能得到不同程度的恢復;尤其是中度干旱脅迫處理15 d后復水15 d(MD15+RW15)地下部干物質(zhì)量還顯著高于對照(圖1B)。
干旱脅迫對紫萼玉簪干物質(zhì)量的影響與對東北玉簪的影響相似(圖1C、圖1D)。與東北玉簪最大不同之處在于,無論中度干旱脅迫處理還是重度干旱脅迫處理30 d后復水15 d,地下部干物質(zhì)量均無法得到有效恢復(圖1D)。
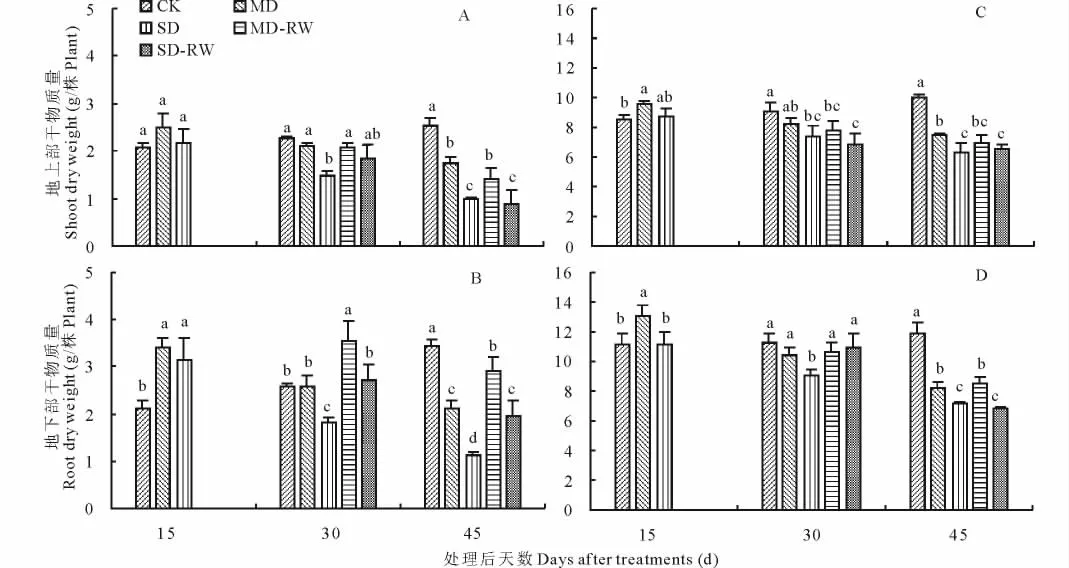
圖1 干旱脅迫及復水后東北玉簪(A、B)和紫萼玉簪(C、D)干物質(zhì)量的變化Fig.1 The changes of dry weights of H.clausa var.ensata(A,B)and H.ventricosa(C,D)after drought stress and rewatering
2.2 干旱脅迫及復水對2種玉簪形態(tài)指標的影響
對于東北玉簪,干旱脅迫處理后15 d,僅MD和SD處理(MD15和SD15)的根數(shù)顯著低于對照,SD處理顯著低于MD處理。隨著干旱脅迫時間的延長,干旱處理對玉簪不同形態(tài)指標的抑制作用開始逐漸顯現(xiàn):干旱脅迫處理后30 d,MD處理(MD30)的葉片數(shù),SD處理(SD30)的側(cè)芽數(shù)、葉片數(shù)、總?cè)~面積、根數(shù)和株高均顯著低于對照;干旱脅迫處理后45 d,MD處理(MD45)的除根數(shù)外的所有形態(tài)指標,SD處理(SD45)的所有形態(tài)指標均顯著低于對照(表1)。中度和重度干旱脅迫處理15 d后復水15 d(MD15+RW15和SD15+RW15),側(cè)芽數(shù)和總?cè)~面積指標能夠恢復到對照水平;而僅中度干旱脅迫處理30 d后復水15 d(MD30+RW15),側(cè)芽數(shù)指標能夠恢復到對照水平(表1)。
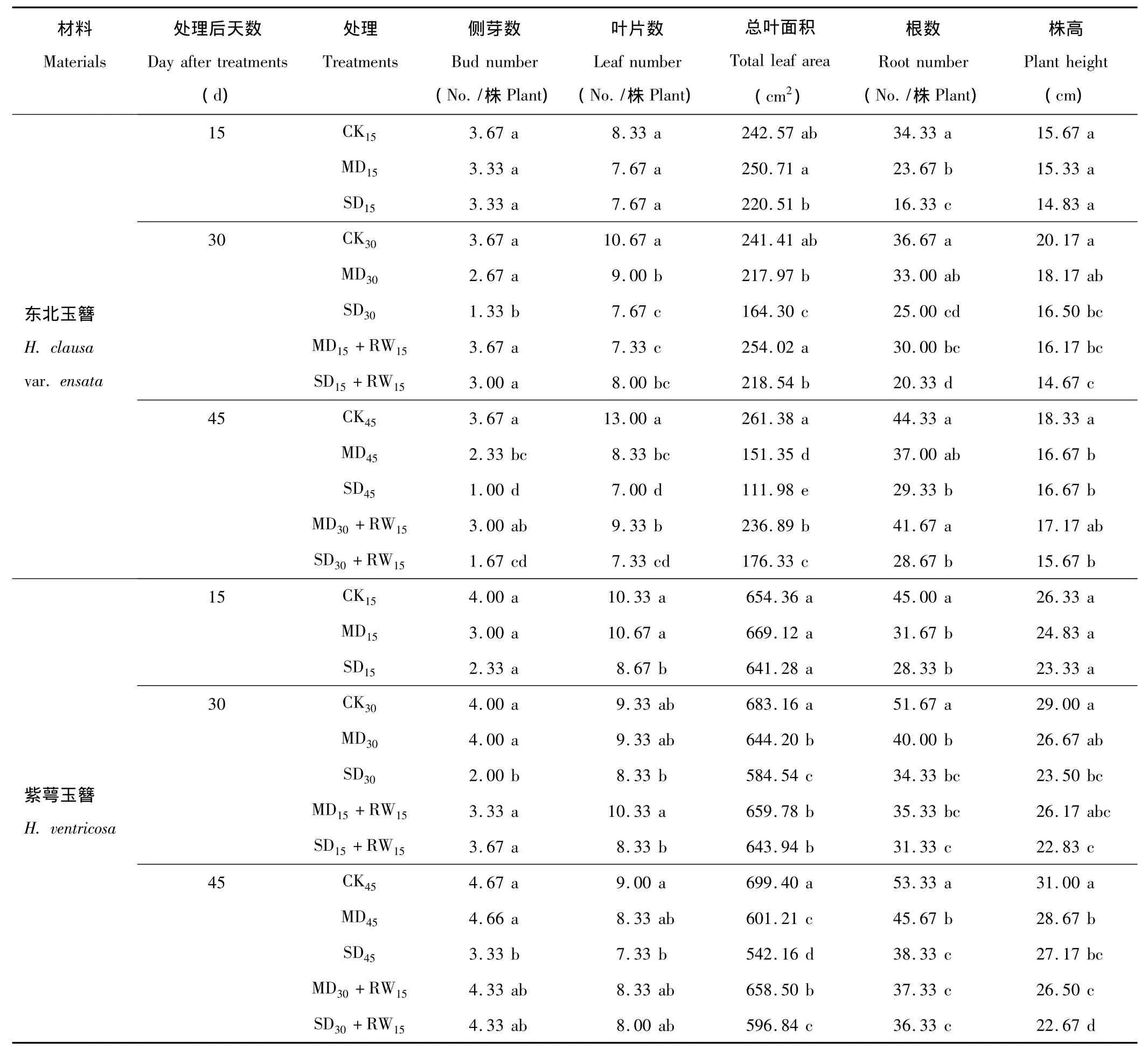
表1 干旱脅迫及復水后東北玉簪和紫萼玉簪形態(tài)指標的變化Table 1 The changes of morphologic index of H.clausa var.ensata and H.ventricosa after drought stress and rewatering
干旱脅迫對紫萼玉簪形態(tài)指標的影響與對東北玉簪的影響相似,亦表現(xiàn)出隨干旱脅迫時間的延長,干旱處理對不同形態(tài)指標的抑制作用增大的現(xiàn)象。干旱脅迫處理后15 d,MD處理(MD15)的根數(shù),SD處理(SD15)的葉片數(shù)和根數(shù)顯著低于對照;干旱脅迫處理后30 d,MD處理(MD30)的總?cè)~面積和根數(shù),SD處理(SD30)的側(cè)芽數(shù)、總?cè)~面積、根數(shù)和株高均顯著低于對照;干旱脅迫處理后45 d,MD處理(MD45)的總?cè)~面積、根數(shù)和株高,SD處理(SD45)的所有形態(tài)指標均顯著低于對照(表1)。重度干旱脅迫處理15 d后復水15 d(SD15+RW15),側(cè)芽數(shù)和總?cè)~面積指標能夠得到不同程度的恢復;中度干旱脅迫處理30 d后復水15 d(MD30+RW15),總?cè)~面積指標能夠得到部分恢復,重度干旱脅迫處理30 d后復水15 d(SD30+RW15),側(cè)芽數(shù)和總?cè)~面積指標能夠得到部分恢復(表1)。
2.3 干旱脅迫及復水對2種玉簪葉綠素含量的影響
對于東北玉簪,干旱脅迫處理后15和30 d,僅SD處理(SD15和SD30)的總?cè)~綠素[Chl(a+b)]含量顯著低于對照,隨著干旱脅迫時間的延長,即干旱脅迫處理后45 d,MD處理(MD45)和SD處理(SD45)的Chl(a+b)含量均顯著低于對照(圖2A)。中度和重度干旱脅迫處理30 d后復水15 d(MD30+RW15和SD30+RW15),Chl(a+b)含量指標能夠得到一定程度的恢復(圖2A)。干旱脅迫處理后的各個時期Chla含量的變化規(guī)律與Chl(a+b)含量一致,表明干旱脅迫及脅迫后復水對東北玉簪Chl(a+b)含量的影響主要是對Chla含量的影響。
對于紫萼玉簪,從干旱脅迫處理后15 d,MD和SD處理的Chl(a+b)含量即顯著低于對照;但干旱脅迫處理后45 d,僅SD處理(SD45)的Chl(a+b)含量顯著低于對照(圖2B)。且重度干旱脅迫處理30 d后復水15 d(SD30+RW15),Chl(a+b)指標能夠恢復到對照水平(圖2B)。干旱脅迫及脅迫后復水對紫萼玉簪Chl(a+b)含量的影響亦主要是對Chla含量的影響。
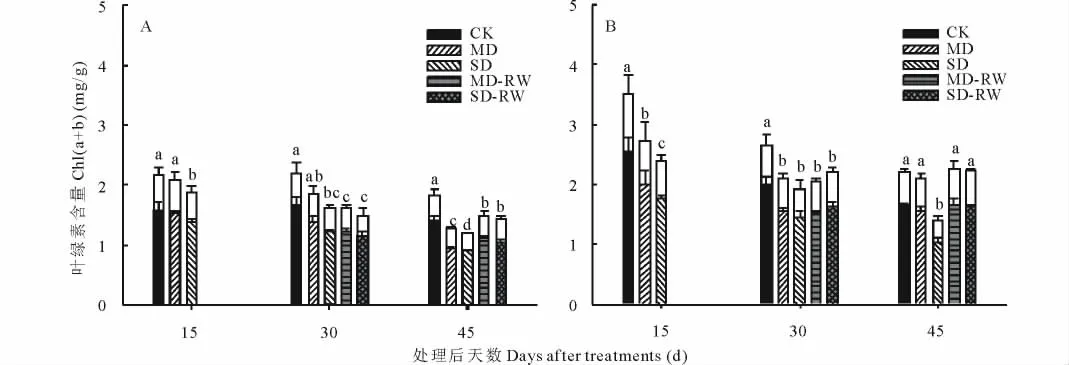
圖2 干旱脅迫及復水后東北玉簪(A)和紫萼玉簪(B)葉綠素含量的變化F ig.2 The changes of chlorophyll contents of H.clausa var.ensata(A)and H.ventricosa(B)after drought stress and rewatering
2.4 干旱脅迫及復水對2種玉簪氣體交換參數(shù)的影響
對于東北玉簪,MD和SD處理的凈光合速率(Pn)隨干旱脅迫時間的延長急劇下降,且從干旱脅迫處理后15 d開始顯著低于對照;干旱脅迫處理后30和45 d,SD處理顯著低于MD處理。中度和重度干旱脅迫處理15 d后復水15 d(MD15+RW15和SD15+RW15),Pn恢復到對照水平;中度和重度干旱脅迫處理30 d后復水15 d(MD30+RW15和SD30+RW15),Pn亦能夠得到部分恢復,且MD30+RW15能夠恢復到與對照相同的水平(圖3A)。
干旱脅迫及脅迫后復水對東北玉簪氣孔導度(Gs)的影響與對Pn的影響基本一致(圖3B)。
MD處理的蒸騰速率(Tr)從干旱脅迫處理后30 d開始顯著低于對照,SD處理的Tr從干旱脅迫處理后15 d開始顯著低于對照;且在干旱脅迫處理后30和45 d,SD處理顯著低于MD處理。中度和重度干旱脅迫處理15 d后復水15 d(MD15+RW15和SD15+RW15),Tr能夠得到有效恢復而且均顯著高于對照;中度和重度干旱脅迫處理30 d后復水15 d(MD30+RW15和SD30+RW15),Tr均能夠恢復到與對照相同的水平(圖3C)。
MD和SD處理的胞間CO2濃度(Ci)在所測試期間無顯著差異,且從干旱脅迫處理后30 d開始顯著低于對照。中度和重度干旱脅迫處理15 d后復水15 d(MD15+RW15和SD15+RW15)和干旱脅迫處理30 d后復水15 d(MD30+RW15和SD30+RW15),Ci均能夠恢復到與對照相同的水平(圖3D)。
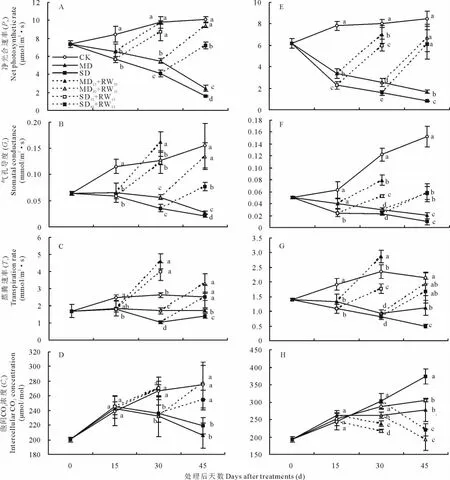
圖3 干旱脅迫及復水后東北玉簪(A~D)和紫萼玉簪(E~H)氣體交換參數(shù)的變化Fig.3 The changes of gas exchange parameters of H.clausa var.ensata(A -D)and H.ventricosa(E-H)after drought stress and rewatering
干旱脅迫及脅迫后復水對紫萼玉簪Pn、Gs和Tr的影響與對東北玉簪的影響一致,只是脅迫后復水15 d恢復的程度比東北玉簪小一些(圖3D~圖3G)。干旱脅迫及脅迫后復水對紫萼玉簪Ci的影響與對東北玉簪的影響不同。MD處理的Ci僅在干旱脅迫處理后30 d顯著低于對照;而SD處理的Ci卻在干旱脅迫處理后45 d顯著高于對照。中度和重度干旱脅迫處理15 d后復水15 d(MD15+RW15和SD15+RW15)和干旱脅迫處理30 d后復水15 d(MD30+RW15和SD30+RW15)均顯著降低了Ci(圖3H)。
2.5 干旱脅迫及復水對2種玉簪葉綠素熒光參數(shù)的影響
對于東北玉簪,MD和SD處理能夠顯著降低干旱脅迫處理后15 d的Fv/Fm、ΦPSII,干旱脅迫處理后30 d的Fv/Fm、ΦPSII和qP,以及干旱脅迫處理后45 d的Fv/Fm、Fv'/Fm'和ΦPSII;顯著提高干旱脅迫處理后30和45 d的NPQ。其中SD處理在干旱脅迫處理后45 d的Fv/Fm顯著低于MD處理。中度和重度干旱脅迫處理15或30 d后復水 15 d(MD15+RW15、SD15+RW15、MD30+RW15和 SD30+RW15),F(xiàn)v/Fm、Fv'/Fm'、ΦPSII、qP 和 NPQ 指標均能夠得到不同程度的恢復。其中重度干旱脅迫處理15或30 d后復水15 d(SD15+RW15和SD30+RW15),不能夠?qū)⒏珊邓斐傻腇v/Fm降低恢復到與對照相同的水平(圖4A~圖4E)。
干旱脅迫及脅迫后復水對紫萼玉簪Fv/Fm、Fv'/Fm'、ΦPSII、qP和NPQ的影響與對東北玉簪的影響一致(圖4F~圖4J)。
3 討論與結(jié)論
本研究結(jié)果表明,短期(15 d)中度干旱脅迫(MD:土壤相對含水量為50% ~55%)和重度干旱脅迫(SD:土壤相對含水量為30%~35%)能夠促進東北玉簪的生物量分配向地下部生長和干物質(zhì)量的積累。而隨干旱脅迫時間的延長MD和SD處理對地上部和地下部干物質(zhì)量增長的抑制作用逐漸顯現(xiàn):處理后30 d,SD處理顯著低于對照;處理后45 d,SD處理顯著低于MD處理,MD處理顯著低于對照。干旱脅迫處理15 d后復水15 d(MD15+RW15和SD15+RW15),地上部和地下部干物質(zhì)量能夠得到有效恢復。而延長干旱脅迫處理30 d后再復水15 d(MD30+RW15和SD30+RW15),地上部干物質(zhì)量無法得到有效恢復,僅地下部干物質(zhì)量得到部分恢復(圖1A和圖1B)。干旱脅迫對紫萼玉簪干物質(zhì)量的影響與對東北玉簪的影響相似,但無論MD處理還是SD處理30 d后復水15 d,地上部和地下部干物質(zhì)量均無法得到有效恢復(圖1C和圖1D)。上述結(jié)果表明,東北玉簪和紫萼玉簪都具有一定的抗短期干旱的能力;短期干旱脅迫后復水能夠部分或全部恢復干旱所造成的干物質(zhì)量的損失;具有走莖的小型玉簪(東北玉簪)抗旱能力強于無走莖大型玉簪(紫萼玉簪)。
干旱脅迫45 d未對2種玉簪造成致死性傷害,但隨著干旱程度的加重(脅迫時間延長或由中度干旱脅迫到重度干旱脅迫),干旱處理對玉簪不同形態(tài)指標的抑制作用逐漸加大。干旱脅迫處理后15 d,2種玉簪主要表現(xiàn)為根數(shù)的減少;干旱脅迫處理后30 d,MD處理的部分指標(東北玉簪的葉片數(shù)、紫萼玉簪的總?cè)~面積和根數(shù))顯著低于對照,而SD處理的所測指標均顯著低于對照;干旱脅迫處理后45 d,MD處理和SD處理的所測形態(tài)指標均低于或顯著低于對照。此外,中度和重度干旱脅迫處理15或30 d后復水15 d主要表現(xiàn)為側(cè)芽數(shù)、葉片數(shù)和總?cè)~面積的部分或全部恢復(表1)。
干旱脅迫導致植物葉片失水,進而影響葉綠素的生物合成,并促進已合成的葉綠素分解。本研究結(jié)果表明:中度和重度干旱脅迫處理能夠降低或顯著降低2種玉簪的總?cè)~綠素[Chl(a+b)]含量;而中度和重度干旱脅迫處理30 d后復水15 d(MD30+RW15和SD30+RW15),Chl(a+b)含量能夠得到部分或全部恢復(圖2A和圖2B)。且干旱脅迫及脅迫后復水對2種玉簪Chl(a+b)含量的影響主要是通過對Chla含量的影響實現(xiàn)。
干旱脅迫下植物葉片的光合速率降低是所有植物的共同現(xiàn)象[16]。2種玉簪均表現(xiàn)出,MD和SD處理的凈光合速率(Pn)隨干旱脅迫時間的延長急劇下降,且從干旱脅迫處理后15 d開始顯著低于對照的結(jié)果(圖3A和圖3E)。干旱脅迫導致Pn下降的主要原因即可能是氣孔限制(stomatal limitations),也可能是非氣孔限制(non-stomatal limitations)。Farquhar和Sharkey[17]提出檢查氣孔限制是否為Pn下降原因的判斷方法:看Gs和Ci的變化趨勢是否一致,Gs降低而Ci升高或不變?yōu)榉菤饪紫拗?Gs降低伴隨著Ci降低為氣孔限制。本研究結(jié)果表明,干旱脅迫對2種玉簪Gs與對Pn的影響基本一致(圖3B和圖3F)。而對2種玉簪Ci的影響不同,對于東北玉簪MD和SD處理Ci在所測試期間無顯著差異,且從干旱脅迫處理后30 d開始顯著低于對照;而對于紫萼玉簪MD處理的Ci僅在干旱脅迫處理后30 d顯著低于對照;而SD處理的Ci卻在干旱脅迫處理后45 d顯著高于對照。上述結(jié)果表明,中度和重度干旱脅迫處理致東北玉簪Pn的降低主要是由氣孔限制引起;中度干旱脅迫處理致紫萼玉簪Pn的降低主要是由氣孔限制引起,而重度干旱脅迫處理致紫萼玉簪Pn的降低主要是由非氣孔限制引起。此外,中度和重度干旱脅迫處理15或30 d后復水15 d(MD15+RW15、SD15+RW15、MD30+RW15和SD30+RW15),2種玉簪Pn、Gs和Tr能夠得到恢復或部分恢復(圖3A~圖3C和圖3E~圖3G)。而對于東北玉簪復水處理能夠顯著提高Ci,使Ci恢復到與對照相同的水平(圖3D);對于紫萼玉簪復水處理卻顯著降低了Ci(圖3H)。
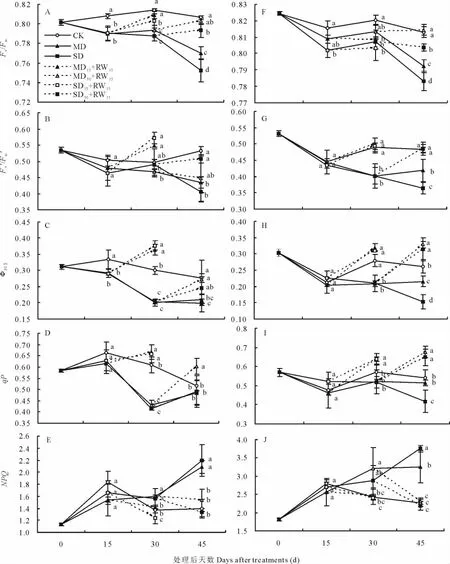
圖4 干旱脅迫及復水后東北玉簪(A~E)和紫萼玉簪(F~J)葉綠素熒光參數(shù)的變化Fig.4 The changes of chlorophyll fluorescence parameters of H.clausa var.ensata(A -E)and H.ventricosa(F-J)after drought stress and rewatering
對于植物的光合作用機理及植物對環(huán)境響應機理的研究,葉綠素熒光參數(shù)分析是一種反應靈敏、操作簡便且對植物無侵擾的方法[18]。Fv/Fm反映PSII原初光能轉(zhuǎn)化效率及PSII潛在活性,非逆境條件下植物的Fv/Fm一般為0.75~0.85[19-20],在逆境條件下或受到傷害時Fv/Fm會顯著降低[21],F(xiàn)v/Fm的變化可以用來鑒別植物對干旱的耐受能力。Fv'/Fm'反映光下開放的(open)PSII反應中心的激發(fā)能捕獲效率,ΦPSII反映光下PSII實際的光化學量子效率,與凈光合速率顯著正相關(guān),在一定程度上能夠代表凈光合速率的變化[22]。qP代表光系統(tǒng)Ⅱ反應中心開放部分的比例[23],較高的qP有利于光系統(tǒng)Ⅱ反應中心的電荷分離和電子傳遞[24]。NPQ反映出了光合器官的一種自我保護機制,通過重新構(gòu)建跨類囊體的質(zhì)子濃度梯度來防止過度激發(fā)PSII反應中心[25]。MD和SD處理能夠顯著降低2種玉簪干旱脅迫處理后30~45 d的Fv/Fm、Fv'/Fm'、ΦPSII和qP;而且顯著提高同時期的NPQ,表明干旱脅迫使2種玉簪的光合作用原初反應過程受到部分破壞,并造成了PSII的結(jié)構(gòu)性傷害。此外,中度和重度干旱脅迫處理15或30 d后復水15 d,F(xiàn)v/Fm、Fv'/Fm'、ΦPSII、qP和NPQ均能夠得到有效恢復(圖4A~圖4J),表明30 d的干旱脅迫未造成光合細胞器的不可逆損傷。而干旱脅迫及復水對玉簪屬植物生長和光合作用的影響機制尚需進一步補充分子證據(jù)來揭示。
[1]田其云,曹艷英.我國干旱半干旱地區(qū)治理環(huán)境資源問題的技術(shù)規(guī)范探討[J].干旱區(qū)資源與環(huán)境,2005,19(3):98-103.
[2]Sam J C.In Hosta heaven[J].American Nurseryman,1990,10:121-135.
[3]Zhang J Z,Wang W,Sun G F,et al.Photosynthesis of Hosta under light and controlled release nitrogen fertilizer[J].Russian Journal of Plant Physiology,2011,58(2):261-270.
[4]Liu F.Biomass partitioning,specific leaf area,and water use efficiency of vegetable amaranth(Amaranthus spp.)in response to drought stress[J].Scientia Horticulturae,2004,102(1):15-27.
[5]任慶成,楊鐵釗,劉培玉,等.植物抗旱性研究進展[J].中國農(nóng)學通報,2009,25(15):76-79.
[6]崔秀妹,劉信寶,李志華,等.不同水分脅迫下水楊酸對分枝期扁蓿豆生長及光合生理的影響[J].草業(yè)學報,2012,21(6):82-93.
[7]溫翠平,李威,漆智平,等.水分脅迫對王草生長的影響[J].草業(yè)學報,2012,21(4):72-78.
[8]Dai Y J,Shen Z G,Liu Y,et al.Effects of shade treatments on the photosynthetic capacity,chlorophyll fluorescence,and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg[J].Environmental and Experimental Botany,2009,65(2-3):177-182.
[9]關(guān)義新,戴俊英,林艷.水分脅迫下植物葉片光合的氣孔和非氣孔限制[J].植物生理學通訊,1995,31(4):293-297.
[10]姚慶群,謝貴水.干旱脅迫下光合作用的氣孔與非氣孔限制[J].熱帶農(nóng)業(yè)科學,2005,25(4):80-85.
[11]宋家壯,李萍萍,付為國.水分脅迫及復水對虉草生理生化特性的影響[J].草業(yè)學報,2012,21(2):62-69.
[12]張起源.水分脅迫對2種玉簪生長及光合特性的影響[D].長春:吉林農(nóng)業(yè)大學,2011.
[13]肖強,葉文景,朱珠,等.利用數(shù)碼相機和Photoshop軟件非破壞性測定葉面積的簡便方法[J].生態(tài)學雜志,2005,24(6):711-714.
[14]Arnon D I.Copper enzymes in isolated chloroplasts:Polyphenooxidase in Beta vulgaris[J].Plant Physiology,1949,24:1-15.
[15]王巍,董然,李曉東,等.控釋氮肥對紫萼玉簪生長和光合特性的影響植物研究[J].植物研究,2009,29(5):544-548.
[16]Zhang J Z,Shi L,Shi A P.Photosynthetic responses of four Hosta cultivars to shade treatment[J].Photosynthetica,2004,42(2):213-218.
[17]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(3):317-345.
[18]Schreiber U,Bilger W,Neubauer C.Chlorophyll florescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[J].Ecological Studies,1995,100:49-70.
[19]Csintalan Z,Proctor M C F,Tuba Z.Chlorophyll fluorescence during drying and rehydration in the mosses Rhytidiadelphus loreus(Hedw.)Warnst.,Anomodon viticulosus(Hedw.)Hook.& Tayl.and Grimmia pulvinata(Hedw.)Sm[J].Annals of Botany,1999,84:235-244.
[20]何炎紅,郭連生,田有亮.白刺葉不同水分狀況下光合速率及其葉綠素熒光特性的研究[J].西北植物學報,2005,25(11):2226-2233.
[21]許大全,張玉忠,張榮銑.植物光合作用的光抑制[J].植物生理學通訊,1992,28(4):237-243.
[22]Fryer M J,Andrews J R,Oxborough K,et al.Relationship between CO2assimilation,photosynthetic electron transport,and active O2metabolism in leaves of maize in the field during periods of low temperature[J].Plant Physiology,1998,116:571-580.
[23]Maxwell K,Johnson G N.Chlorophyll fluorescence-a practical guide[J].Journal of Experimental Botany,2000,51(345):659-668.
[24]Dias P C,Araujo W L,Moraes G A B K,et al.Morphological and physiological responses of two coffee progenies to soilwater availability[J].Journal of Plant Physiology,2007,164(12):1639-1647.
[25]Ivanov B,Edwards G.Influence of ascorbate and the Mehler peroxidase reaction on non-photochemical quenching of chlorophyll fluorescence in maize mesophyll chloroplasts[J].Planta,2000,210(5):765-774.

