黃河口潮灘濕地土壤CH4氧化潛力及其對有機物輸入的響應
孫萬龍,孫志高,孫文廣,翁虹,呂迎春,姜歡歡,王玲玲
(1.中國科學院海岸帶環境過程重點實驗室 山東省海岸帶環境過程重點實驗室 中國科學院煙臺海岸帶研究所,山東 煙臺264003; 2.中國科學院大學,北京 100049;3.山東省農業可持續發展研究所,山東 濟南 250100;4.山東省黃河三角洲生態環境重點實驗室 濱州學院,山東 濱州 256603)
全球氣候變化是當今人類面臨的重大環境問題。CH4是引起全球變暖的重要溫室效應氣體之一,其對溫室效應的貢獻僅次于CO2和N2O,達25%[1]。盡管CH4在大氣中的濃度低于CO2,但其熱吸收效應卻是CO2的15~30倍[2]。CH4還能與大氣污染物(如氟利昂)發生反應,產生其他溫室氣體,如O3、CO和CO2等。全球大氣CH4濃度已經由1750年的715×10-9增加到2005年的1774×10-9,并在2007和2008年分別增加了(8.3±0.6)×10-9和(4.4±0.6)×10-9[3-4]。據2011年世界氣象組織發布的最新數據,2010年全球大氣CH4濃度已高達1808×10-9,且正在以每年約1%的速度增加[5]。
濕地CH4排放是一個復雜的生物地球化學過程,它是濕地CH4產生、傳輸和氧化過程綜合作用的結果。其中CH4氧化是控制CH4通量的重要因子,土壤中好氧微生物消耗大氣中的CH4是濕地重要的CH4匯[6]。因此,探討CH4氧化及其對不同因子的響應對于揭示濕地系統CH4排放的關鍵機制具有重要意義。目前,國外已在濕地土壤CH4氧化及其影響因子方面進行了較多研究,且這些研究主要涉及水稻田[7-9]、泥炭地[10-11]、淡水沼澤[12-13]和紅樹林[14]等濕地類型。與之相比,國內對濕地土壤CH4氧化的研究主要集中在人工濕地——水稻田的探討上[15-18],對天然濕地的研究主要集中于三江平原沼澤[19-22]、森林濕地[23-25]、長江口濱岸濕地[26-27]、閩江口濕地[28-29]以及若爾蓋濕地[30-31]等。作為我國溫暖帶保存最完整、最廣闊和最年輕的黃河三角洲濱海濕地生態系統,近年來已成為自然濕地研究的熱點區域之一[32],但關于溫室氣體排放特征的研究還很少[33-34],而關于CH4氧化潛力的探討還未見報道。黃河口潮灘濕地是黃河入海河段與渤海相互作用形成的重要生態類型,承接著來自黃河中上游帶來的大量營養鹽和有機物[35]。據統計,黃河2011年排放入海的營養鹽和CODcr分別高達1.80萬t和18.09萬t[36]。大量營養鹽和有機物的輸入不僅對黃河入海口近岸水體的營養狀況產生重要影響,而且其對于黃河口潮灘濕地營養水平的影響也非常深刻。可見,黃河口潮灘濕地充當著陸源碳氮的一個重要“匯”,但這一“匯”的形成究竟對CH4產生與氧化過程有何影響,目前尚不清楚。為此,本文以黃河口潮灘濕地土壤為研究對象,通過室內培養實驗,初步探討了CH4氧化潛力對有機物輸入的響應。研究結果可為評價有機物輸入對黃河口潮灘濕地CH4釋放規律的影響提供重要科學依據。
1 材料與方法
1.1 研究區域概況
供試土壤采自山東省黃河三角洲國家級自然保護區今黃河入海口北部典型潮灘濕地。黃河三角洲國家級自然保護區(37°40′~38°10′ N, 118°41′~119°16′ E)位于東營市境內,總面積為15.3萬hm2,是中國最大的河口三角洲保護區,主要保護新生濕地系統和珍稀瀕危鳥類。保護區屬暖溫帶季風氣候區,具有明顯的大陸性季風氣候特點,雨熱同期,四季分明,冷熱干濕界限極為明顯。該區年平均氣溫12.1℃,無霜期196 d,≥10℃的年積溫約4300℃,年均蒸發量1962 mm,年均降水量為551.6 mm,70%的降水集中于7和8月。區域內的土壤類型主要為隱域性潮土和鹽土,主要植被類型包括蘆葦(Phragmitesaustralis)、檉柳(Tamarixchinensis)、堿蓬(Suaedasalsa)和獐茅(Aeluropuslittoralis)。作為潮灘濕地演替先鋒階段的堿蓬鹽沼是黃河口丹頂鶴、白鷺以及鵒形目鳥類等的主要棲息地,同時還起著維持濕地系統正常演替,防風固堤,調節氣候等重要功能[37]。
1.2 樣地選擇與樣品采集
1.2.1樣品采集 2010年11月初,在今黃河入海口北部濱岸高潮灘、中潮灘、低潮灘和光灘的典型試驗區內進行0~10 cm深度土壤樣品的采集,每個采樣區設置3個重復。樣品采集后立刻裝入自封袋,封口后帶回實驗室風干備用。土壤基本理化性質測定方法分別為:電導率采用Field Scout土壤&溶液EC計測定;容重采用環刀法測定;總碳(TC)和總氮(TN)含量采用元素分析儀(Elementar Vario Macro)測定;NH4+-N 和NO3--N 含量在用2 mol/L的KCl溶液浸提后通過連續流動分析儀(Bran-Lubee AAA3)測定[33]。采樣點表層土壤的基本理化性質見表1。

表1 采樣點表層土壤基本理化性質
1.2.2CH4好氧培養試驗 取風干后過60目篩(0.3 mm)的土樣40 g放入到250 mL培養瓶中(設3個重復),加入蒸餾水使培養瓶內土壤水分含量為田間持水量的70%(加水12.2 mL),用玻璃棒攪拌使樣品混合均勻成泥漿狀。用硅橡膠塞塞住瓶口,瓶塞周圍以704膠密封。在塞住瓶口的硅橡膠塞中間打2個孔,插入玻璃管,1根以適當長度插入泥漿中,作為CH4進口;另1根較短,稍稍插入培養瓶即可,作為CH4出口和氣體取樣口。通過取樣口從培養瓶中抽取2.5 mL氣體,然后再向培養瓶注入2.5 mL純CH4,使瓶內CH4濃度為10000 μL/L左右(準確的初始濃度待確定)。將培養瓶放入 25℃培養箱振蕩30 min(黑暗,120 r/min),立即測定CH4濃度作為其初始濃度。然后繼續放到此培養箱中恒溫25℃培養,每隔12 h(或24 h)測定1次瓶中CH4濃度。每次測定CH4濃度時,先從培養瓶中抽取1 mL氣樣以N2稀釋至10 mL,然后用Agilent 7890A氣相色譜測定。實驗連續培養6 d,共測定了9次CH4濃度。土壤CH4氧化潛力通過分析密閉培養一定時間后培養瓶內CH4濃度的變化來計算。為了比較不同有機物輸入對CH4氧化潛力的影響,有機物輸入實驗組中分別加入提前配好的酵母膏溶液(2 mg)和甲醇溶液(2 mg),對照組中則加入等質量的蒸餾水。
1.3 CH4氧化潛力計算
CH4濃度采用Agilent 7890A氣相色譜儀進行測定。CH4檢測器為FID(氫火焰離子化檢測器),載氣為N2,流速為30 mL/min,燃氣為H2,流速為45 mL/min,檢測器溫度為250℃,分離柱溫度為55℃。CH4氧化潛力由下式進行計算:
式中,P為CH4氧化率(μg/g·d);dc/dt為培養瓶內CH4濃度單位時間的變化(μL/L·d);V為培養瓶內氣體體積(L);W為干土重(g);MW為CH4的分子量(g);MV為標準狀態下1 mol氣體的體積(L);T為培養溫度(K)。本研究采用25℃條件下CH4的氧化率來表征此狀態下的CH4氧化潛力。
1.4 數據處理與分析
利用Origin 7.5軟件進行計算和繪圖,利用SPSS 20.0軟件進行統計分析。
2 結果與分析
2.1 不同潮灘濕地土壤的CH4氧化潛力

圖1 不同潮灘濕地表層土壤的CH4氧化潛力
由圖1可知,盡管不同潮灘濕地表層土壤的CH4氧化潛力存在一定差異(P>0.05),但均具有相似的變化特征。12~60 h,CH4氧化潛力均呈先增加后降低變化,其中高潮灘、中潮灘和光灘土壤的CH4氧化潛力峰值均出現在第48 h(6.66,5.47和8.90 μg/g·d),而低潮灘土壤則出現在第36 h(6.97 μg/g·d)。4種濕地土壤的CH4氧化潛力均在第60 h取得最小值(均為負值),分別為-3.98,-2.72,-4.19和-4.62 μg/(g·d),表明好氧培養期間仍可能有相當數量的CH4產生。60~132 h,4種濕地土壤的CH4氧化潛力均呈迅速增加趨勢,其中中潮灘在第108 h出現CH4氧化潛力最大值(5.69 μg/g·d),高潮灘、低潮灘和光灘則均在第132 h出現最大值(8.13,10.82和10.38 μg/g·d)。整體而言,4種濕地土壤的CH4平均氧化潛力表現為光灘(2.37 μg/g·d)>低潮灘(2.29 μg/g·d)>中潮灘(1.70 μg/g·d)>高潮灘(1.47 μg/g·d),變異系數分別為145.80%,111.60%,166.23%和176.37%(表2)。
2.2 外源有機物輸入對潮灘濕地土壤CH4氧化潛力的影響
由圖2可知,無論有機質輸入與否,不同潮灘濕地表層土壤的CH4氧化潛力均隨時間呈不規則波動變化。0~48 h,甲醇輸入對4種濕地土壤CH4氧化潛力的影響均不明顯。就高潮灘土壤而言,甲醇對其CH4氧化潛力的影響在第12 h表現為抑制作用,在第24 h表現為促進作用。36~48 h,甲醇對其CH4氧化潛力的影響又表現為抑制作用;與高潮灘不同,甲醇對中潮灘和低潮灘土壤CH4氧化潛力的影響在第12 h表現為促進作用,在第24 h表現為抑制作用,第36 h出現短暫促進作用,第48 h則又表現為較強抑制作用。對光灘而言,甲醇對其土壤CH4氧化潛力的影響在0~24 h內表現為抑制作用,在第36 h表現為促進作用,在第48 h再次表現為抑制趨勢。4種濕地土壤CH4氧化潛力對甲醇輸入的響應在60~132 h內較為一致。60~84 h,甲醇輸入對CH4氧化潛力均產生弱抑制作用,在108~132 h則產生較強抑制作用。整體而言,甲醇輸入抑制了4種濕地土壤的CH4氧化潛力,抑制程度表現為光灘>中潮灘>低潮灘>高潮灘(表2)。4種濕地土壤的CH4平均氧化潛力分別為1.27,0.49,0.67和0.38 μg/(g·d),分別較對照組低13.56%,70.98%,70.65%和83.83%(表2)。
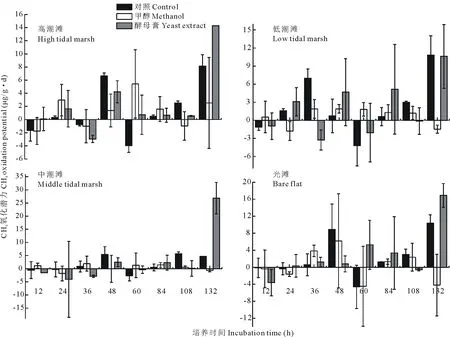
圖2 不同潮灘濕地表層土壤的CH4氧化潛力對有機物輸入的響應
不同潮灘濕地表層土壤對酵母膏輸入的響應在48 h培養期內亦無明顯規律。酵母膏輸入對高潮灘和低潮灘土壤CH4氧化潛力的影響在12~24 h內均表現為促進作用,在36~48 h內則表現為抑制作用。與之不同,酵母膏輸入對中潮灘土壤CH4氧化潛力的影響在0~48 h內均表現為抑制作用,而對光灘土壤CH4氧化潛力的影響在0~12 h內表現為抑制作用,24~36 h內表現為促進作用,在第48 h又表現為抑制作用。4種濕地土壤CH4氧化潛力對酵母膏輸入的響應在60~132 h內較為一致。60~84 h,酵母膏輸入對CH4氧化潛力均表現為促進作用,在第108 h產生抑制作用后又表現為較強促進作用。整體而言,酵母膏輸入促進了高潮灘、中潮灘和光灘土壤的CH4氧化潛力,促進程度表現為中潮灘>高潮灘>光灘。三者的CH4平均氧化潛力分別為2.41,2.89和2.96 μg/(g·d),較對照增加64.01%,69.38%和24.76%(表2)。與之相比,酵母膏輸入對低潮灘土壤的CH4氧化潛力產生弱抑制作用,其平均氧化潛力為2.14 μg/(g·d),較對照降低6.67%(表2)。
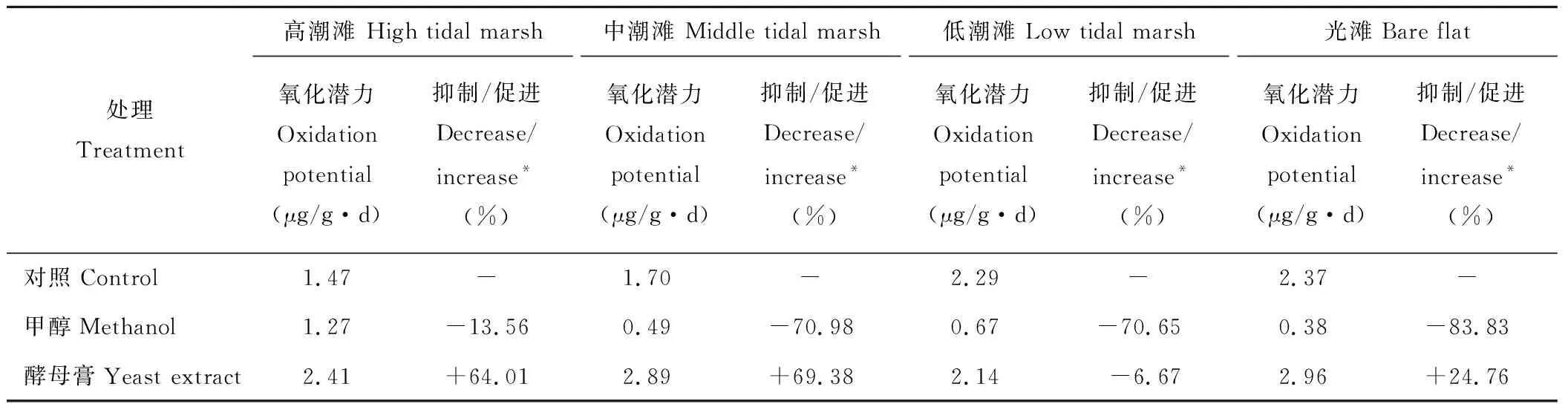
表2 有機質輸入對潮灘濕地土壤的CH4氧化潛力的影響
*,“-” 代表對CH4氧化潛力存在抑制作用;“+” 代表對CH4氧化潛力存在促進作用。*,“-” means decreasing CH4oxidation potential, while “+” means increasing CH4oxidation potential.
3 討論
3.1 不同潮灘濕地土壤的CH4氧化潛力
本研究發現,4種潮灘濕地土壤在培養期內均表現出較強的CH4氧化潛力且變化規律較一致,其CH4平均氧化潛力表現為光灘>低潮灘>中潮灘>高潮灘,原因可能與4種濕地土壤的質地、有機質以及CH4氧化菌生物量等的差異有關。土壤質地是由不同大小土壤微粒的相對比例決定,主要影響土壤大孔隙和微孔隙的分布,從而決定了氣體在土壤中的擴散速率。Drr等[38]和Kruse等[39]認為, 氣體擴散率是影響CH4氧化最重要的因素之一。作為土壤中CH4氧化發生的底物和氧化性物質,CH4和O2的可獲得性是土壤氧化CH4的重要限制因子。本研究中,4種潮灘濕地土壤的質地較為粘重(表1)且表層土壤粘粒和粉粒含量差異較大并表現出自高潮灘到光灘呈增加趨勢[34]。這與前述4種潮灘濕地土壤CH4平均氧化潛力的大小順序正好相反,說明土壤質地的差異可能使得CH4和O2在土壤中的擴散量存在差異,進而導致4種潮灘濕地土壤CH4氧化潛力的差異。相關研究也得到類似結果。王長科等[40]對不同土地利用方式下白漿土氧化CH4的研究發現,土地利用類型改變導致的土壤質地及理化性質的變化對CH4氧化具有顯著影響,土壤結構改變,CH4和O2擴散發生困難從而降低了土壤的CH4氧化潛力。Boeckx等[41]對比利時10種不同土壤質地和土地利用類型土壤CH4氧化潛力的研究表明,不同質地土壤的CH4吸收率存在較大差異。Hütsch[42]曾發現免耕土壤氧化CH4速率是連續翻耕土壤的4.5~11倍(耕作可降低土壤容重)。土壤質地和理化性質的差異同樣也會影響到土壤環境中的CH4氧化菌的生物量[43]。較高的土壤含鹽量可降低土壤水勢,導致CH4氧化菌出現生理性缺水,從而可降低土壤CH4氧化潛力[44]。這與研究區域土壤電導率越高CH4氧化潛力越低的研究結果一致。土壤有機質含量也是影響土壤CH4氧化潛力的重要因素之一[28]。Schnell和King[45]對林地土壤的研究發現,CH4氧化最強的為2~20 cm有機質層。王長科等[40]發現,在溫度和水分一定的條件下,決定白漿土氧化大氣CH4速率的最主要因素是土壤有機碳含量,土壤有機碳含量越大,土壤氧化大氣CH4的潛力越大。王維奇等[28]的研究表明,土壤有機碳含量的差異是導致蘆葦濕地土壤和光地土壤CH4氧化能力差異的重要控制因子。由于研究區域受外源有機質輸入影響較大,所以土壤有機碳除來源于濕地植物外還在很大程度上取決于外源有機質的輸入。由于潮間帶高程自高潮灘到光灘呈降低趨勢且光灘和低潮灘更易受到海水攜帶外源輸入有機質的影響,所以在潮汐作用的影響下光灘和低潮灘易發生有機質的積累[46],進而導致其土壤的CH4氧化潛力整體較高。
值得注意的是,培養期內某些時刻的CH4氧化潛力為負值,表明好氧培養期間仍可能有相當數量的CH4產生。由于CH4是在嚴格厭氧條件下由產CH4菌作用于產CH4底物的結果,所以理論上CH4應在極端還原條件下才能產生[47]。本研究中CH4氧化潛力負值的出現可能與主要土壤質地有關。盡管培養在好氧條件下進行,但由于供試土壤質地較為粘重,內部可能仍然存在厭氧微環境。有研究表明,顆粒很小的粘土能使得產CH4菌在有氧條件下存活[48]。在本研究溫度、土壤含水量恒定且有機物質添加等量的情況下,土壤CH4產生主要應受供試土壤中產CH4菌數量和活性的影響,而產CH4菌的數量和活性則決定于是否存在適合的厭氧微環境。由于培養土壤內部可能仍然存在適合產CH4菌活動的厭氧微環境,所以當產CH4菌的數量和活性到達一定程度時,就會使得CH4的產生量超過氧化量,從而可能導致CH4氧化潛力負值的出現。好氧條件下CH4的產生或CH4氧化潛力為負值已為諸多研究所證實。徐華等[49]研究了好氧和厭氧狀態下中國不同地區水稻土的CH4產生情況,發現水稻土在好氧條件下仍有相當數量的CH4產生。Boeckx等[41]對比利時10種不同土壤質地和土地利用類型土壤CH4氧化潛力的研究發現,草地重粘質土和粘質土出現CH4排放現象(即CH4氧化潛力為負值)。王長科等[40]研究表明,好氧培養條件下,旱田土壤底層土壤(23~37 cm)沒有表現出吸收大氣CH4的潛力,反而表現為排放CH4。另外,王長科等[21]在三江平原土壤氧化CH4的研究中亦發現,所選取的沼澤土和水稻土樣品在培養期內均出現CH4氧化潛力為負值的現象。
3.2 土壤CH4氧化潛力對有機物輸入的響應
本研究發現,甲醇輸入對4種潮灘濕地表層土壤的CH4氧化潛力整體均起一定抑制作用,且其對中潮灘、低潮灘和光灘土壤的抑制程度更強,原因可能與甲醇在CH4氧化細菌的代謝過程中抑制了其新陳代謝有關。甲醇是CH4氧化代謝途徑的中間產物,對甲烷單加氧酶產生反饋抑制,從而抑制CH4的氧化。閔航等[44]對水稻土的CH4氧化潛力進行了研究,發現1 g供試土中甲醇濃度達到0.05 mg可抑制土壤氧化外源CH4活性50%左右。張光亞等[50]探討了不同碳源物質對土壤CH4氧化活性的影響,結果發現甲醇輸入后CH4氧化潛力與對照相差較大,9 d后CH4消耗量僅為對照的28%。姜歡歡[51]探討了甲酸(同為CH4氧化代謝途徑的中間產物)輸入對黃河口潮灘濕地土壤(與本研究相同樣點)CH4氧化潛力的影響,結果發現甲酸輸入明顯抑制了土壤CH4的氧化潛力,且其產生的抑制程度要大于本研究甲醇輸入產生的抑制。原因可能在于,甲醇不但是CH4氧化代謝途徑的中間產物,而且也是甲基營養型微生物的主要碳源物質,其影響強度較甲酸相對要弱[44]。本研究還發現,培養期間亦出現甲醇促進CH4氧化的情況,其原因可能是存在于土壤中少量的CH4氧化菌首先利用比較容易利用的碳源(甲醇)進行生長和繁殖,以達到較高的菌體數量;之后這些數量較多的CH4氧化菌就可以繼續利用CH4為碳源繼續生長和繁殖,從而表現出較強的CH4氧化潛力。這與Jensen和Priemé[52]發現在CH4濃度較低的條件下,甲醇的輸入有利于土壤氧化CH4進行的研究結果相似。另外,由于甲醇是產CH4細菌所需的碳源物質且供試土壤中可能存在厭氧條件(可產生CH4),所以培養過程中甲醇對CH4氧化的抑制作用往往受土壤產CH4的影響而表現稍弱[29]。
本研究發現,酵母膏輸入對高潮灘、中潮灘和光灘表層土壤的CH4氧化潛力整體均起到促進作用,而對低潮灘土壤則起到弱抑制作用,原因可能與酵母膏對濕地土壤CH4氧化細菌繁殖影響的差異有關。酵母膏是促進產CH4菌產CH4活性的碳源物質,其在低濃度情況下就可促進土壤氧化外源CH4的活性。同時,酵母膏還可補充氮源和提供微生物生長的各種維生素、氨基酸及生長因子,可大大提高菌種的生存率和繁殖率。在土壤存在適合于CH4氧化微生物生長的微域環境時,酵母膏的輸入保證了CH4氧化菌生長基質的充足,從而促進了CH4氧化菌的繁殖與生長[53];當加入CH4后,這些甲烷氧化菌經過一段時間的適應后,可表現出較強的CH4氧化能力[54]。閔航等[44]對水稻土CH4氧化潛力的研究表明,1 g供試土中加入0.05 mg的酵母膏可提高25%左右的氧化外源CH4的活性。這與本研究中高潮灘、中潮灘和光灘土壤的研究結論相似。但姜歡歡[51]對黃河口潮灘濕地土壤(與本研究相同樣點)CH4氧化潛力影響的研究發現,加入葡萄糖和乙酸鈉(促進CH4菌產CH4活性的碳源物質,與酵母膏相似)在一定程度上抑制了土壤CH4氧化潛力,這與本研究中酵母膏輸入對中潮灘土壤的CH4氧化潛力產生弱抑制的結論相近。原因可能在于,酵母膏作為產CH4底物,加入后在促進CH4氧化菌活性的同時也促進了產CH4細菌的繁殖[29],從而導致可觀的CH4在微厭氧環境下產生,但其具體機制仍需要進一步研究。
4 結論
1)潮灘濕地表層土壤的CH4氧化潛力在培養期內變化規律相似,其值表現為光灘>低潮灘>中潮灘>高潮灘;不同潮灘濕地土壤CH4氧化潛力的差異可能主要與土壤質地的差異有關。
2)甲醇輸入對潮灘濕地表層土壤的CH4氧化潛力整體表現為抑制作用,且抑制程度表現為光灘>中潮灘>低潮灘>高潮灘。
3)酵母膏輸入對高潮灘、中潮灘和光灘表層土壤的CH4氧化潛力整體表現為促進作用,且促進程度表現為中潮灘>高潮灘>光灘;與之相比,酵母膏輸入對低潮灘土壤的CH4氧化潛力表現為弱抑制作用。
4)在當前外源有機物為黃河入海主要污染物情況下,潮灘濕地的CH4源/匯功能將發生明顯變化,這就使得在估算潮灘CH4排放清單時應特別關注不同有機物輸入對CH4釋放的影響。

