高寒草甸魏斯氏乳酸菌的分離鑒定及理化特性研究
楊楊,石超,郭旭生,3*
(1.蘭州大學(xué)草地農(nóng)業(yè)科技學(xué)院草地農(nóng)業(yè)生態(tài)系統(tǒng)國(guó)家重點(diǎn)實(shí)驗(yàn)室,甘肅蘭州730020;2.蘭州大學(xué)生命科學(xué)學(xué)院草地農(nóng)業(yè)生態(tài)系統(tǒng)國(guó)家重點(diǎn)實(shí)驗(yàn)室,甘肅蘭州730000;3.蘭州大學(xué)青藏高原生態(tài)系統(tǒng)管理國(guó)際中心,甘肅蘭州730000)
草地畜牧業(yè)作為青藏高原傳統(tǒng)的基礎(chǔ)產(chǎn)業(yè)在其經(jīng)濟(jì)發(fā)展中具有重要的地位,也是青藏高原今后經(jīng)濟(jì)發(fā)展的支柱產(chǎn)業(yè)之一。但是,長(zhǎng)期以來天然草地飼草料供給的季節(jié)性不平衡,嚴(yán)重制約著青藏高原草地畜牧業(yè)的高效發(fā)展,加之長(zhǎng)期的超載過牧,草地退化,使草畜矛盾日益突出[1-3]。通過人工種草和天然草地打草來制作青貯飼料,將是解決高寒草地畜牧業(yè)冬春季節(jié)飼草料嚴(yán)重不足的有效措施之一。乳酸菌在飼料工業(yè)中,尤其在青貯飼料的制備領(lǐng)域中有著重要的作用。在很多國(guó)家特別是歐美等發(fā)達(dá)國(guó)家已經(jīng)對(duì)乳酸菌在青貯飼料制備中的應(yīng)用進(jìn)行了大量而深入的研究。其研究?jī)?nèi)容主要包括性狀優(yōu)良乳酸菌的篩選,乳酸菌對(duì)青貯飼料發(fā)酵品質(zhì)的影響,添加乳酸菌的青貯飼料對(duì)奶牛采食量的影響以及乳酸菌對(duì)青貯飼料二次發(fā)酵的抑制作用等[4]。而在用于飼料青貯的乳酸菌的篩選及其對(duì)青貯飼料發(fā)酵品質(zhì)影響的基礎(chǔ)應(yīng)用研究、產(chǎn)品開發(fā)等方面日本和歐美國(guó)家處于領(lǐng)先地位,但我國(guó)乳酸菌在青貯飼料中的研究主要是利用國(guó)外商品化的乳酸菌制劑進(jìn)行試驗(yàn)[5-6],對(duì)具有自主知識(shí)產(chǎn)權(quán)的乳酸菌制劑的研究與開發(fā)很少。然而,我國(guó)青藏高原地區(qū)的極端氣候環(huán)境,使得傳統(tǒng)商品化乳酸菌在該地區(qū)的應(yīng)用受到了限制,因?yàn)樯唐坊樗峋苿┑倪m宜生長(zhǎng)溫度通常為20~25℃。因此,發(fā)掘利用高寒地區(qū)鄉(xiāng)土乳酸菌種質(zhì)資源,對(duì)于在該地區(qū)制作青貯飼料具有重要的意義。
近幾年,有關(guān)青藏高原乳酸菌的多樣性與種質(zhì)資源的研究,逐漸引起了國(guó)內(nèi)外學(xué)者的關(guān)注,這方面的研究主要涉及食品學(xué)科并集中于高原傳統(tǒng)發(fā)酵乳制品中乳酸菌的分離與鑒定[7-13]。國(guó)內(nèi)有關(guān)牧草中天然附著乳酸菌分離鑒定及其在青貯飼料中的篩選研究與應(yīng)用方面起步較晚,最近幾年才開始有報(bào)道[4,14-16],而且關(guān)于青藏高原高寒地區(qū)牧草中附著乳酸菌的研究還無人涉及,只有相關(guān)研究表明,在我國(guó)高寒地區(qū)高海拔、低溫和缺氧的極端環(huán)境中進(jìn)行牧草青貯時(shí)能夠得到優(yōu)質(zhì)的青貯飼料。青貯飼料色綠,酸香味濃,適口性好,幾乎沒有二次發(fā)酵的現(xiàn)象[17-18]。這說明在我國(guó)青藏高原高寒地區(qū)依然存在著能夠在極端環(huán)境中發(fā)酵飼料的特殊乳酸菌菌群。在西藏高寒地區(qū),以藏北嵩草(Kobresia littledalei)為優(yōu)勢(shì)種的草地型是全區(qū)高寒沼澤化草甸亞類草地中分布范圍廣、面積大、牧草飼用價(jià)值較高的草地型[19-20]。因此,本試驗(yàn)以藏北嵩草為原料,對(duì)其附著乳酸菌進(jìn)行分離、鑒定和生物學(xué)特性研究,為篩選青藏高原青貯飼料用優(yōu)良乳酸菌種質(zhì)資源提供科學(xué)依據(jù)。
1 材料與方法
1.1 樣品采集
用于分離乳酸菌的試驗(yàn)樣品藏北嵩草于2010年7月初分別采自西藏納木錯(cuò)高寒草甸草地(海拔5100 m;東經(jīng)90°42',北緯 29°58');那曲古露鎮(zhèn)高寒草甸(海拔 4582 m;東經(jīng) 91°37',北緯 30°50');堆龍德慶的高寒草甸(海拔3980 m;東經(jīng)90°49',北緯29°57')。樣品采集地點(diǎn)的氣候?qū)儆诟呱絹喓畮О敫珊导撅L(fēng)氣候。試驗(yàn)地堆龍德慶鄉(xiāng)年均降雨量為444 mm,年均氣溫7℃,年平均日照時(shí)數(shù)3000 h;納木錯(cuò)采樣區(qū)年平均溫度-0.6℃,年降雨量456.8 mm,年最高溫在7月份,為14.6℃,該地區(qū)日照時(shí)數(shù)2880 h;樣品采集點(diǎn)古露鎮(zhèn)年平均氣溫-1.3℃,年內(nèi)最高溫度在7月份,為9.1℃,年平均降雨量為421.9 mm,該地區(qū)年平均日照時(shí)數(shù)為2846 h。樣品采集地點(diǎn)牧草生長(zhǎng)期為5月中旬至9月底,土壤類型均為高山草甸土。每個(gè)采樣點(diǎn)設(shè)置10個(gè)1 m×1 m樣本框分別進(jìn)行采樣。
牧草樣品剪取后,裝入塑料袋,冰盒中冷藏,帶回實(shí)驗(yàn)室,-20℃保存,以備附著微生物檢測(cè)。
1.2 培養(yǎng)基
試驗(yàn)用培養(yǎng)基參考凌代文[21]的方法配制。
葡萄糖酵母蛋白胨(GYP)培養(yǎng)基:蛋白胨2 g,酵母提取物5 g,葡萄糖10 g,吐溫-80 0.25 g,MgSO4·7H2O 0.1 g,MnSO40.1 g,F(xiàn)eSO40.1 g,NaCl 5 g,CaCO35 g,加蒸餾水至 1000 mL,調(diào) pH 6.8,121℃滅菌 15 min。
MRS培養(yǎng)基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,葡萄糖20 g,K2HPO45 g,檸檬酸銨2 g,乙酸鈉5 g,MgSO4·7H2O 0.58 g,吐溫 -80 1 mL,MnSO40.25 g,CaCO320 g,瓊脂粉20 g,加蒸餾水至1000 mL,調(diào) pH 6.2 ~6.4,121℃滅菌15 min。不加瓊脂粉即可得到MRS培養(yǎng)液。
PYG培養(yǎng)基:PY基礎(chǔ)培養(yǎng)液內(nèi)加入1.0 g葡萄糖。PY基礎(chǔ)培養(yǎng)基為蛋白胨0.5 g,胰酶解酪朊0.5 g,酵母提取物 1.0 g,鹽溶液 4.0 mL,蒸餾水 100 mL。其中鹽溶液為無水氯化鈣 0.2 g,MgSO4·7H2O 0.48 g,磷酸氫二鉀 1.0 g,磷酸二氫鉀 1.0 g,碳酸氫鈉 10.0 g,氯化鈉 2.0 g,蒸餾水 1000 mL。
1.3 乳酸菌的分離與純化
在無菌室中,將嵩草樣品剪成1 cm左右的短段,并稱取10 g分別置裝有90 mL滅菌生理鹽水的三角瓶中,常溫?fù)u床4~6 h。用已滅菌的生理鹽水適當(dāng)稀釋,選2個(gè)稀釋度,每個(gè)稀釋度取0.1 mL菌種稀釋液滴到GYP(含有碳酸鈣)平板上,用涂布棒將其涂布均勻后,將平板在37℃厭氧培養(yǎng)48 h。之后,根據(jù)菌落的顏色、大小、光澤、透明程度等,挑取有透明圈的單菌落,進(jìn)行革蘭氏染色、油鏡鏡檢和過氧化氫酶試驗(yàn),凡是革蘭氏染色陽(yáng)性、過氧化氫酶陰性的菌株疑似其為乳酸菌并以劃線的方式在MRS培養(yǎng)基上繼續(xù)分離純化培養(yǎng)2次。將純化后的菌株接種到MRS斜面培養(yǎng)基上培養(yǎng)后,在4℃條件下保存?zhèn)溆谩?/p>
1.4 菌種鑒定
1.4.1 屬的鑒定 按照凌代文[21]、楊潔彬等[22]、東秀珠和蔡妙英[23]介紹的方法,將所有革蘭氏陽(yáng)性,過氧化氫酶試驗(yàn)陰性的分離菌株初步鑒定為乳酸菌。之后根據(jù)菌種的形態(tài)學(xué)特征將其分為桿菌和球菌,并根據(jù)凌代文[21]的方法進(jìn)行乳酸菌屬的初步鑒定試驗(yàn)。
1.4.2 種的鑒定 乳酸菌種的鑒定參考凌代文[21]的方法。通過糖發(fā)酵試驗(yàn)進(jìn)行乳酸菌種的鑒定,采用杭州天和生化有限公司提供的糖發(fā)酵試劑盒。具體方法按照試劑盒的說明進(jìn)行。
1.4.3 乳酸菌的16S rRNA序列測(cè)定 分離的乳酸菌在MRS培養(yǎng)基中培養(yǎng)8 h后進(jìn)一步純化并進(jìn)行菌株DNA的提取。DNA提取試劑盒由天根生化試劑(北京)有限公司提供。DNA的提取及純化按照試劑盒使用方法進(jìn)行。分離單菌DNA做模板,采用引物57 F:5'-AGTTTGATCCTGGCTCAG-3'和205 R:5'-CTTGTTACGACTTCACCC-3'進(jìn)行 PCR 擴(kuò)增;反應(yīng)系為(50 μL):DNA 模板2 μL,57 F 1 μL,205 R 1 μL,2×Master Mix 25 μL,ddH2O 21 μL。反應(yīng)程序?yàn)?94℃ 30 min;94℃ 30 s,60 ~50℃,30 s(每個(gè)循環(huán)降 1℃),72℃ 1.5 min,10 個(gè)循環(huán);94℃30 s,50℃30 s,72℃1.5 min,30個(gè)循環(huán);72℃5 min。PCR純化產(chǎn)物進(jìn)行測(cè)序(北京博邁德科技發(fā)展有限公司)。
1.5 生長(zhǎng)特性檢測(cè)
1.5.1 乳酸菌生長(zhǎng)速率的測(cè)定 用待測(cè)菌株的培養(yǎng)液,以相同的接種量(0.1 mL)接入MRS液體培養(yǎng)基中,于30℃厭氧培養(yǎng)箱中培養(yǎng)24 h,每隔2 h取樣品,用紫外可見分光光度計(jì)(日立,U-2910)以培養(yǎng)基為空白,在波長(zhǎng)620 nm下立即測(cè)定樣品的吸光度值,并按照下列公式計(jì)算菌株的生長(zhǎng)速率。
菌株的生長(zhǎng)速率=液體培養(yǎng)基各時(shí)間點(diǎn)的OD值-液體培養(yǎng)基的起始OD值。
1.5.2 乳酸菌產(chǎn)酸速率測(cè)定 將待測(cè)菌液分別接種于MRS液體培養(yǎng)基中,于30℃厭氧培養(yǎng)箱中培養(yǎng)24 h,每隔2 h取樣品,用pH計(jì)(上海精科,PHS-3C)檢測(cè)培養(yǎng)液pH值,并按照下列公式計(jì)算菌株的產(chǎn)酸速率。
產(chǎn)酸速率=培養(yǎng)基中起始pH-各時(shí)間點(diǎn)pH。
1.5.3 不同溫度條件下生長(zhǎng)特性 將配制好的MRS培養(yǎng)液以5 mL量分裝試管,121℃高壓滅菌15 min,將試驗(yàn)菌株以相同的接種量(0.1 mL)接入培養(yǎng)液中,搖勻,塞子封口,各設(shè)2個(gè)重復(fù),溫度為4℃放在冰箱中,10,15,25,30℃放在恒溫培養(yǎng)箱中,40,50,60℃的放在水浴鍋中分別培養(yǎng),其中4℃培養(yǎng)14 d,40,50和60℃培養(yǎng)7 d,其余培養(yǎng)2 d,觀察菌株的生長(zhǎng)情況。
本節(jié)將驗(yàn)證PUs與SUs同時(shí)存在于CRN時(shí),幾種頻譜資源分配算法性能對(duì)比.在網(wǎng)絡(luò)中部署4個(gè)PUs,分別位于(30,30)(30,70)(70,30)和(75,30)處,干擾半徑均為30m,以概率θ分別對(duì)信道1、2、3和1獨(dú)占使用,則信道空閑概率為μ=1-θ.
1.5.4 不同pH條件下生長(zhǎng)特性 所用培養(yǎng)基是將MRS培養(yǎng)液用鹽酸或氫氧化鈉調(diào)pH至所需酸堿度,即pH分別為3,4,4.5,5,6,7,8,9,9.5 的 9 種 MRS 液體培養(yǎng)基,同上步驟,將試驗(yàn)菌株的培養(yǎng)液,以相同的接種量(0.1 mL)接入裝有已滅菌培養(yǎng)基中,各設(shè)2個(gè)重復(fù),置于37℃恒溫培養(yǎng)箱培養(yǎng)2 d后,觀察菌株的耐酸堿能力。
1.6 數(shù)據(jù)統(tǒng)計(jì)分析
不同乳酸菌菌株生長(zhǎng)速率及產(chǎn)酸速率利用SPSS 19.0進(jìn)行單因素方差分析和多重比較。根據(jù)乳酸菌的16S rDNA序列,在Genbank中進(jìn)行比對(duì),分析相似性。乳酸菌16S rRNA序列用MEGA 5.0中的Clustal W對(duì)最近類群的序列進(jìn)行多重比較分析,并通過該軟件的鄰近法(Neighbor-Joining)構(gòu)建系統(tǒng)發(fā)育樹,分支聚類的穩(wěn)定性用Bootstrap方法進(jìn)行100次隨機(jī)重復(fù)取樣評(píng)價(jià)[13]。
2 結(jié)果與分析
2.1 藏北嵩草分離魏斯氏乳酸菌的16S rRNA基因序列分析
采用16S rRNA測(cè)序結(jié)果表明(表1),從西藏德慶、那曲古露和納木錯(cuò)高寒草甸藏北嵩草中共分離出17株魏斯氏乳酸菌。其中從德慶、那曲古露及納木錯(cuò)藏北嵩草中各分離出9,3及5株菌。這些菌種屬于魏斯氏乳酸菌的2個(gè)種,即食竇魏斯氏乳酸菌(Weissella cibaria)和融合魏斯氏乳酸菌(Weissella confusa);而且有10個(gè)菌株與Genbank中的標(biāo)準(zhǔn)菌株食竇魏斯氏菌II-I-59(W.cibaria II-I-59)和融合魏斯氏菌JCM 1093(W.confusa JCM 1093)的相似率均為99%。通過進(jìn)一步對(duì)2種魏斯氏乳酸菌菌種相似菌株的16S rRNA基因序列進(jìn)行多重比較分析和系統(tǒng)發(fā)育樹的構(gòu)建(圖1),鑒定出所分離的17株魏斯氏乳酸菌菌株有6株為食竇魏斯氏乳酸菌,11株為融合魏斯氏乳酸菌菌株。
2.2 藏北嵩草分離魏斯氏乳酸菌的生長(zhǎng)特性
不同海拔地區(qū)藏北嵩草附著魏斯氏乳酸菌的生長(zhǎng)特征見表2。從分離菌株在不同溫度的生長(zhǎng)情況來看,這些菌株均能夠在4和10℃生長(zhǎng)。在不同pH值條件下的生長(zhǎng)情況表明,菌株D7,D9和N2,N3,N4能在pH值為3的條件下生長(zhǎng),而且大多數(shù)菌株能在pH值為4~9.5的范圍內(nèi)生長(zhǎng)。
分離乳酸菌的糖發(fā)酵試驗(yàn)結(jié)果見表3。從表3看出,除了菌株N2外,所有的菌株都發(fā)酵阿拉伯糖。發(fā)酵半乳糖的結(jié)果表明,有15個(gè)魏斯氏菌株可發(fā)酵利用半乳糖,而菌株D2和D7為可變的反應(yīng)。所有的菌株均能利用纖維二糖,麥芽糖,果糖,蜜二糖和蔗糖。菌株D4,G3,以及N2~N5均能發(fā)酵核糖,而菌株D1,D2和D9不利用核糖,其余菌株為可變的反應(yīng);從利用棉籽糖的情況來看,菌株D6,N1,N2,N3不發(fā)酵棉籽糖。根據(jù)魏斯氏乳酸菌的糖發(fā)酵鑒定方法,食竇魏斯氏乳酸菌發(fā)酵阿拉伯糖,不發(fā)酵半乳糖和木糖。但本試驗(yàn)中所分離菌株的糖發(fā)酵試驗(yàn)結(jié)果表明,只有菌株D7利用半乳糖為可變反應(yīng),其余5株食竇魏斯氏乳酸菌(D3,D8,D9,N1,N3,N4)均能發(fā)酵利用半乳糖。而16S rRNA序列分析結(jié)果表明,菌株D2,D4,D5,D6及G1,G2和N2,N3與融合魏斯氏乳酸菌的相似性均為100%,并結(jié)合系統(tǒng)發(fā)育分析結(jié)果(圖1),菌株D1,D8和G2均為融合魏斯氏乳酸菌。

表1 藏北嵩草附著魏斯氏乳酸菌菌株的16S rRNA基因序列分析結(jié)果Table 1 Results of 16S rRNA gene sequences of strain isolated from K.littledalei
2.3 藏北嵩草分離魏斯氏乳酸菌的產(chǎn)酸及生長(zhǎng)特性
藏北嵩草附著魏斯氏乳酸菌的產(chǎn)酸速率見表4。17株魏斯氏乳酸菌培養(yǎng)6 h后,菌株D4的產(chǎn)酸速率最快,其培養(yǎng)基中pH比起始培養(yǎng)基的pH下降了1.38,且顯著高于其他菌株的產(chǎn)酸速率(P<0.05)。培養(yǎng)12 h后,菌株G1培養(yǎng)基中的pH最低,比起始pH降低了2.09,且顯著高于其他菌株的產(chǎn)酸速率(P<0.05)。培養(yǎng)18 h后,菌株N1培養(yǎng)基中的pH最低,顯著高于其他菌株的產(chǎn)酸速率(P<0.05),且比起始pH降低2.46。同時(shí),該菌株在培養(yǎng)24 h后,其產(chǎn)酸速率也最大。
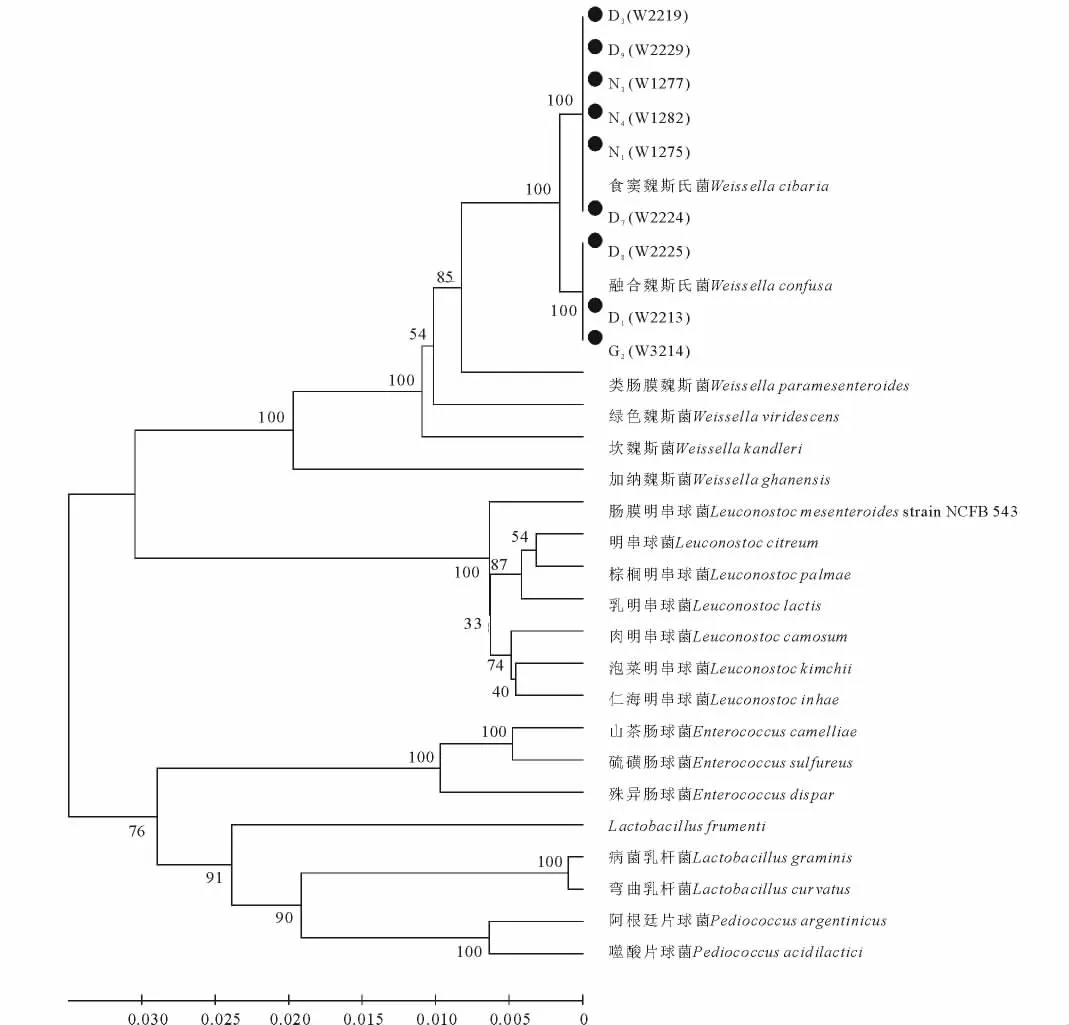
圖1 藏北嵩草分離魏斯氏乳酸菌的系統(tǒng)發(fā)育分析Fig.1 The phylogenetic analysis of the Weissella lactic acid bacteria isolated from K.littledalei
3 討論
魏斯菌屬(Weissella)是1993年Collins等提議建立的一個(gè)新菌屬,目前至少由12個(gè)菌種組成[24]。該乳酸菌不形成芽孢,無動(dòng)力的革蘭陽(yáng)性球菌或球桿菌,呈單個(gè)、成雙或短鏈狀排列。這類乳酸菌廣泛分布于發(fā)酵食物(如臘腸、泡菜)、土壤等,多數(shù)菌種在植物發(fā)酵中起重要作用[24]。在青貯飼料中報(bào)道的魏斯氏菌主要為類腸膜魏斯菌(W.paramesenteroides),并在青貯飼料發(fā)酵初期起重要作用,但研究表明這類乳酸菌在提高青貯飼料品質(zhì)方面作用較小[25]。

表2 藏北嵩草附著魏斯氏乳酸菌在不同溫度和pH條件下的生長(zhǎng)特性Table 2 G row th profiles of Weissella strains isolated from K.littledalei at different tem perature and pH

表3 藏北嵩草附著魏斯氏乳酸菌的糖發(fā)酵特性Table 3 Sugar fermentation profiles of Weissella strains isolated from K.littledalei
魏斯菌屬細(xì)菌可分離于多種來源。但在高寒極端環(huán)境中分離的魏斯氏乳酸菌還未見報(bào)道。本研究從高寒地區(qū)藏嵩草中分離的魏斯氏乳酸菌,通過16S rRNA序列分析表明,主要為食竇魏斯氏乳酸菌和融合魏斯氏乳酸菌。從目前的研究資料來看,僅見這2種菌分離于人類或其他動(dòng)物的報(bào)道[26-27]。研究表明,這2種菌很難從形態(tài)特征及菌落特征方面區(qū)別;食竇魏斯氏菌發(fā)酵阿拉伯糖,不發(fā)酵半乳糖和木糖,可區(qū)別于融合魏斯氏菌[24],因?yàn)槿诤衔核故暇话l(fā)酵阿拉伯糖、蜜二糖和棉籽糖,但發(fā)酵半乳糖、纖維二糖、麥芽糖、核糖等[21]。但本試驗(yàn)的研究結(jié)果表明,從藏嵩草中分離的融合魏斯氏菌除了菌株N2外,其他菌株菌發(fā)酵阿拉伯糖,而且分離鑒定的食竇魏斯氏乳酸菌均能利用半乳糖。這可能是高寒環(huán)境中魏斯氏乳酸菌對(duì)碳源的利用比其他環(huán)境中分離出的菌種更具有廣泛性。
由于青藏高原高寒環(huán)境的特殊性,從藏嵩草中分離的乳酸菌能夠在4℃的條件下生長(zhǎng),而且在10℃時(shí)生長(zhǎng)活力旺盛,體現(xiàn)出高寒環(huán)境中分離出的乳酸菌對(duì)低溫的適應(yīng)特性。這對(duì)高寒低溫條件下,應(yīng)用分離出的耐低溫乳酸菌進(jìn)行青貯飼料的發(fā)酵提供了保障和科學(xué)依據(jù),對(duì)于低溫環(huán)境中青貯飼料的調(diào)制具有重要的意義。另外,本試驗(yàn)結(jié)果表明,菌株D7,D9和N2,N3,N4能在pH為3的條件下生長(zhǎng),體現(xiàn)出這些菌株具有強(qiáng)的耐酸性能力。從本試驗(yàn)分離出的17株融合魏斯氏乳酸菌的生長(zhǎng)特性及產(chǎn)酸能力來看,菌株D4和G1分別在培養(yǎng)6和12 h時(shí),產(chǎn)酸
速率顯著高于其他菌株,可作為飼料青貯時(shí),青貯飼料發(fā)酵啟動(dòng)菌株的備選菌株。而菌株N1在培養(yǎng)18至24 h后,其產(chǎn)酸速率均顯著高于其他菌株。這一特性將對(duì)青貯飼料后續(xù)發(fā)酵起到重要的作用。上述菌株的產(chǎn)酸速率特性,可為青貯飼料發(fā)酵菌株的科學(xué)合理配伍提供依據(jù)。而從生長(zhǎng)速率來看,所分離的菌株與其產(chǎn)酸能力并不對(duì)應(yīng)。說明生長(zhǎng)速率快的菌株,其產(chǎn)酸能力不一定強(qiáng)。為此,在篩選飼料青貯用乳酸菌菌株時(shí),應(yīng)以產(chǎn)酸速率為依據(jù)。

表4 藏北嵩草附著魏斯氏乳酸菌的產(chǎn)酸速率Table 4 Acid production rate of Weissella strains isolated from K.littledalei

表5 藏北嵩草附著魏斯氏乳酸菌的生長(zhǎng)速率Table 5 Grow th rate of Weissella strains isolated from K.littledalei
4 結(jié)論
本試驗(yàn)首次報(bào)道了從牧草(高寒藏北嵩草)中分離出魏斯氏乳酸菌。分離出的融合魏斯氏乳酸菌菌株具有耐低溫,耐酸性強(qiáng),發(fā)酵碳源廣泛的特征。這一結(jié)果對(duì)于今后在我國(guó)青藏高原高寒環(huán)境中分離具有特殊發(fā)酵性能的乳酸菌以及利用這些乳酸菌菌株進(jìn)行低溫環(huán)境中青貯飼料的調(diào)制提供了重要的科學(xué)依據(jù)。本試驗(yàn)分離魏斯氏乳酸菌菌株對(duì)青貯飼料發(fā)酵模式及品質(zhì)的影響將做進(jìn)一步研究。
[1]尚占環(huán),姬秋梅,多吉頓珠,等.西藏“一江兩河地”農(nóng)區(qū)草業(yè)發(fā)展探討[J].草業(yè)科學(xué),2009,26(8):141-146.
[2]趙景學(xué),祁彪,多吉頓珠,等.短期圍欄封育對(duì)藏北3類退化高寒草地群落特征的影響[J].草業(yè)科學(xué),2011,28(1):59-62.
[3]李以康,冉飛,包蘇科,等.高寒草甸矮嵩草對(duì)氮肥的生理響應(yīng)[J].草業(yè)學(xué)報(bào),2010,19(3):240-244.
[4]劉飛,楊麗杰,侯俊財(cái),等.青貯飼料中的分離鑒定優(yōu)良乳酸菌[J].江西飼料,2007,1:22-25.
[5]陳明霞,劉秦華,張建國(guó).飼料稻新材料的特性及添加物對(duì)其青貯品質(zhì)的影響[J].草業(yè)學(xué)報(bào),2011,20(5):201-206.
[6]洪梅,刁其玉,姜成鋼,等.布氏乳桿菌對(duì)青貯發(fā)酵及其效果的研究進(jìn)展[J].草業(yè)學(xué)報(bào),2011,20(5):266-271.
[7]陳芝蘭,程池,馬凱,等.西藏地區(qū)牦牛發(fā)酵乳制品中乳酸菌的分離與鑒定[J].食品科學(xué),2008,29(12):408-412.
[8]Duan Y H,Tan Z F,Wang Y P,et al.Identification and characterization of lactic acid bacteria isolated from Tibetan Qula cheese[J].Journal of General and Applied Microbiology,2008,54(1):51-60.
[9]Yu J,Sun ZH,Liu W J.Rapid identification of lactic acid bacteria isolated from home-made fermentedmilk in Tibet[J].Journal of General and Applied Microbiology,2009,55(3):181-190.
[10]Wu X H,Luo Z,Yu L,etal.A survey on composition andmicrobiota of fresh and fermented yakmilk at different Tibetan altitudes[J].Dairy Science& Technology,2009,89(2):201-209.
[11]Chen Y F,Sun TS,Wang JC,etal.Comparison ofnutrition andmicrobiological compositions between two types of fermentedmilk from Tibet in China[J].International Journal of Food Sciences and Nutrition,2009,60:243-250.
[12]Airidengcaicike,Chen X,Du X H.Isolation and identification of cultivable lactic acid bacteria in traditional fermentedmilk of Tibet in China[J].International Journal of Dairy Technology,2010,63(3):437-444.
[13]Tan Z F,Pang H L,Duan Y H,etal.16S ribosomal DNA analysis and characterization of lactic acid bacteria associated with traditional Tibetan Qula cheesemade from yak milk[J].Animal Science Journal,2010,81(6):706-713.
[14]張大偉.乳酸菌的分離鑒定及其在玉米秸稈青貯中的應(yīng)用[D].鄭州:鄭州大學(xué),2007.
[15]劉晗璐.禾本科牧草乳酸菌發(fā)現(xiàn)及發(fā)酵制品檢測(cè)與動(dòng)物生產(chǎn)性能影響研究[D].呼和浩特:內(nèi)蒙古農(nóng)業(yè)大學(xué),2008.
[16]趙子夫.乳酸菌的分離篩選及其對(duì)玉米青貯品質(zhì)和有氧穩(wěn)定性的影響[D].呼和浩特:內(nèi)蒙古農(nóng)業(yè)大學(xué),2009.
[17]張琳,德科加.青藏高原特種青貯牧草的品質(zhì)評(píng)定試驗(yàn)[J].青海畜牧獸醫(yī),2007,1:15-16.
[18]李夢(mèng)寒.藏東南乳酸菌青貯添加劑的研究與應(yīng)用[D].拉薩:西藏大學(xué),2009.
[19]陳全功,張普金,王春喜.西藏那曲地區(qū)草地畜牧業(yè)資源[M].蘭州:甘肅科學(xué)技術(shù)出版社,1991:26-38.
[20]吳海艷,馬玉壽,董全民.黃河源區(qū)藏嵩草沼澤化草甸地上生物量及營(yíng)養(yǎng)季節(jié)動(dòng)態(tài)研究[J].草業(yè)科學(xué),2009,26(1):8-12.
[21]凌代文.乳酸菌分類鑒定及實(shí)驗(yàn)方法[M].北京:中國(guó)輕工業(yè)出版社,1999:1-25.
[22]楊潔彬,郭興華,凌代文.乳酸菌—生物學(xué)基礎(chǔ)及應(yīng)用[M].北京:中國(guó)輕工業(yè)出版社,1991:1-3.
[23]東秀珠,蔡妙英.常見細(xì)菌系統(tǒng)鑒定手冊(cè)[M].北京:科學(xué)出版社,2001.
[24]李中華,段雄波.魏斯菌屬細(xì)菌的分類與鑒定新進(jìn)展[J].國(guó)際檢驗(yàn)醫(yī)學(xué)雜志,2006,27(8):721-723.
[25]Cai Y M,Yoshimi B,Masuhiro O,et al.Influence of Lactobacillus spp.from an inoculant and of Weissella and Leuconostoc spp.from forage crops on silage fermentation[J].Applied and Environmental Microbiology,1998,64:2982-2987.
[26]Olano A,Chua J,Schroeder S,et al.Weissella confusa(basonym:Lactobacillus confusus)bacteremia:a case report[J].Journal of Clinical Microbiol,2001,39(4):1604-1607.
[27]Flaherty JD,Levett PN,Dewhirst FE,etal.Fatal case of endocarditis due to Weissella confusa[J].Journal of ClinicalMicrobiology,2003,41(5):2237-2239.

