三例輸入性卵形瘧的實驗室診斷
田 斌,段績輝,徐明忠,張 兵,廖 瑜,申曉君,文 嵐
(長沙市疾病預防控制中心,湖南長沙410001)
卵形瘧原蟲(plasmodium ovale)是感染人類的瘧原蟲,首次發現最有可能是在1900年[1]。因其感染患者具有間日發熱等特點,一直被認為是間日瘧原蟲(plasmodium vivax)的變種,直到1922年Stephens[2]才對該種瘧原蟲進行了完整的形態描述和命名。目前其地理分布局限在熱帶非洲、中東、巴布亞新幾內亞、印度尼西亞的西伊里安查亞省和東南亞地區[3]。我國對卵形瘧的報道極為鮮見。隨著國際間交流的不斷擴大與加深,輸入性瘧疾病例的數量也呈逐年增加的態勢[4],給國內大部分瘧疾消除地區的實驗室診斷工作提出了新的挑戰。我們分析了3例輸入性卵形瘧的實驗室診斷,以提示檢測人員應警惕卵形瘧的誤診與漏診。
材料和方法
一、標本來源
標本為3例輸入性卵形瘧患者的靜脈抗凝血,制作厚薄血膜涂片后-70℃凍存備檢。病例情況如下:患者A,男,44歲,剛果(布)務工,2012年1月18日回國,回國至本次發病期間無外出史,本次發病日期2012年4月25日,癥狀為畏寒、發熱(39.9℃,不規則)、發冷伴腹瀉。該患者曾于2011年4月在剛果(布)發病,境外醫療機構未進行實驗室檢查,予青蒿素類注射劑治療3 d后癥狀消失;患者B,男,22歲,塞拉利昂務工,2012年12月4日回國,回國至本次發病期間無外出史,本次發病日期2012年12月27日,癥狀為發熱(38.4℃,不規則)、發冷、出汗,曾于2012年6月在境外出現類似癥狀,未行實驗室檢查,予青蒿素類注射劑治療3 d后癥狀消失;患者C,男,25歲,尼日利亞黑人,發病前3周入境,于2012年12月31日發病,癥狀為發熱且時間不規則,否認既往患過瘧疾。
二、試劑與儀器
Giemsa染液為實驗室自配;DNA提取試劑為QIAamp DNA Micro Kit;聚合酶鏈反應(PCR)擴增試劑為Invitrogen公司Platinum PCR SuperMix;顯微照相系統購自德國Leica公司;PCR擴增儀購自美國ABI公司;電泳儀和凝膠成像系統為英國SYNGENE公司產品。
三、方法
1.厚、薄血膜涂片檢查 按張進順等[5]描述的方法進行制作厚、薄血膜涂片,行Giemsa染色后顯微鏡檢查并照相。
2.核酸擴增及序列分析 采用巢氏PCR對瘧原蟲18S rRNA基因進行擴增,按文獻[6-8]提供序列由Invitrogen公司合成引物,見表1。第1輪擴增體系為上下游引物(10 μmol/L)各 1μL,Platinum PCR SuperMix 18μL,DNA 模板5μL,計25μL體系;第2輪擴增體系為上、下游引物(10 μmol/L)各 1μL,Platinum PCR SuperMix 16μL,以第1輪反應產物1μL作為模板,補去離子水至25μL,各種特異性引物分別加入體系,不共用體系。擴增條件第1輪和第2輪相同,均為95 ℃ 5 min,1個循環;94 ℃ 30 s,58.5 ℃ 30 s,72℃ 90 s,36個循環;72℃ 5 min,1個循環;4℃,∞。擴增完成后對第2輪擴增產物進行瓊脂糖電泳檢測。產物測序由寶生物工程(大連)有限公司完成。
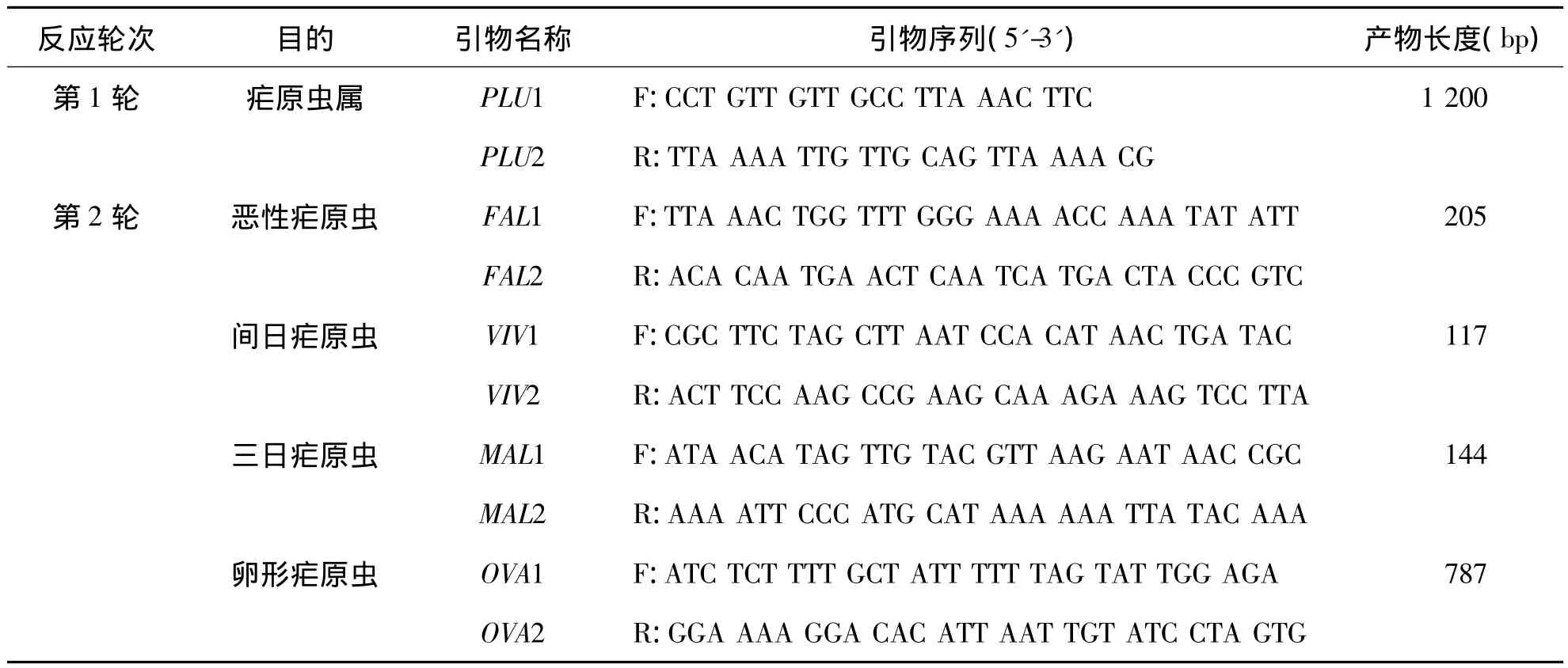
表1 巢氏PCR擴增18S rRNA基因引物序列
結 果
一、厚薄血膜涂片鏡檢結果
厚血膜中卵形瘧原蟲除滋養體以外各期原蟲均為圓形或卵圓形;數目不等的細胞核較為明顯,呈紫紅色;細胞質濃郁,呈深藍色;偶見紅色較粗大的紅色薛氏點(Schuffner's dot)和黃棕色的瘧色素。薄血膜中,被卵形瘧原蟲寄生的紅細胞可呈卵圓形、梭形或淚滴形;略脹大;邊緣不整齊呈鋸齒狀或一端似掃帚狀等。滋養體階段細胞核粗大明顯呈紫紅色;胞漿粗壯,可有空泡,亦可出現阿米巴樣偽足;裂殖體階段蟲體呈圓形或卵圓形,細胞核呈分裂狀,成熟的裂殖體一般含有6~12個裂殖子排列成環狀或不規則串狀。配子體階段蟲體呈圓形或橢圓形;胞漿均勻;細胞核1個,位于蟲體的邊緣或中央。薛氏點可存在被各階段原蟲寄生的紅細胞內,包括早期滋養體,較明顯。瘧色素呈黃棕色粒狀或短桿狀;常出現在成熟滋養體及以后各發育階段,隨蟲體的發育量增加;在裂殖體階段集中,在配子體階段相對分散。見圖1。
二、巢氏PCR結果
患者A為卵形瘧原蟲感染;患者B為卵形、惡性瘧原蟲混合感染;患者C為卵形、間日瘧原蟲混合感染。見圖2。
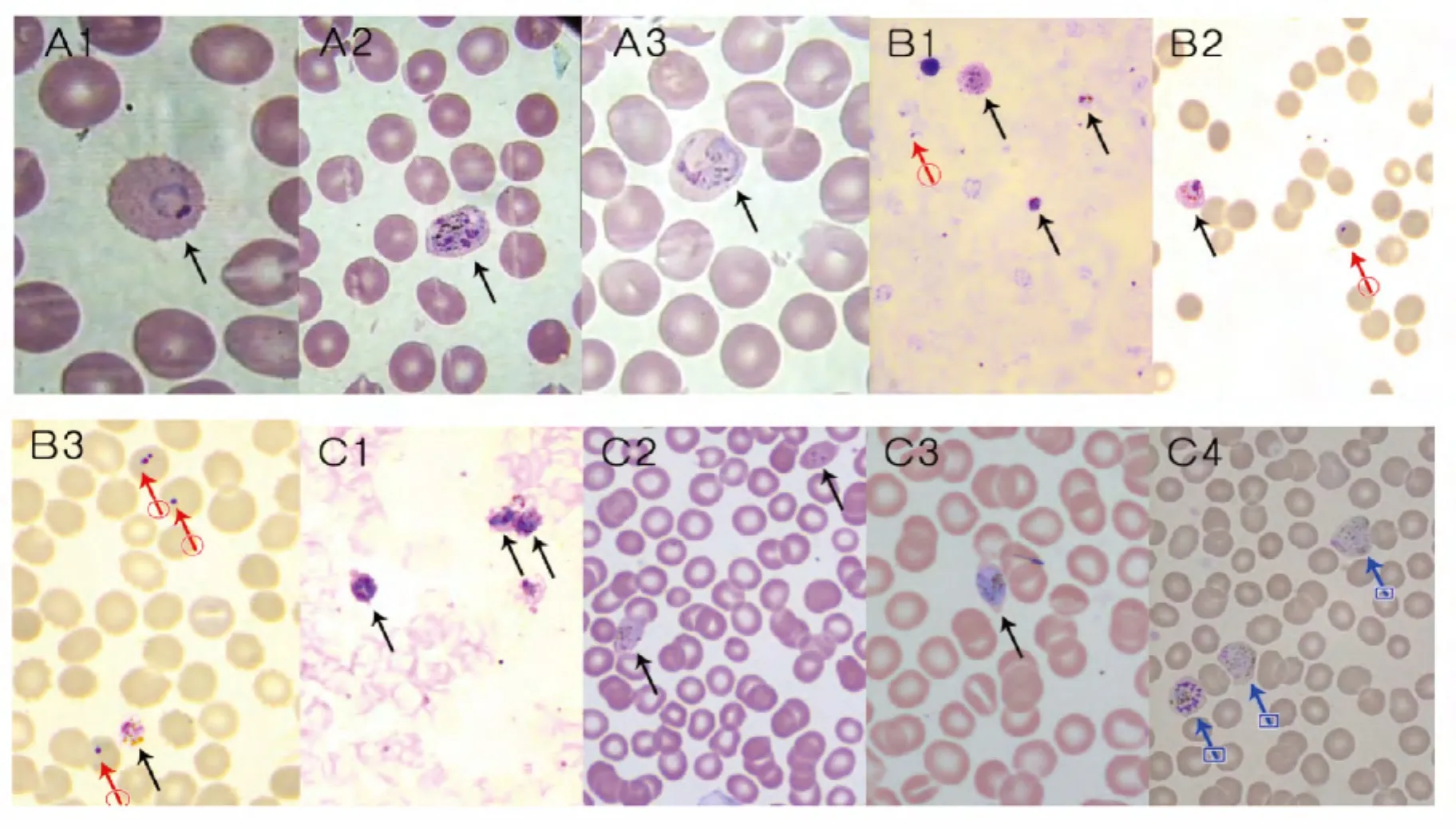
圖1 患者外周血涂片中的原蟲

圖2 3例患者巢氏PCR擴增結果
三、患者A擴增產物測序結果
本研究對患者A卵形瘧原蟲特異性條帶進行了測序。由于采用的是巢氏PCR產物進行測序,存在產物不單一情況,遂取中間無套峰的600 bp(見圖3)采用NCBI Blast工具進行比對,比對結果顯示與 Sequence ID:gb|HQ697267.1/gb|HQ697266.1/dbj|AB182490.1 等卵形瘧原蟲 18S rRNA基因序列的同源性為100%。
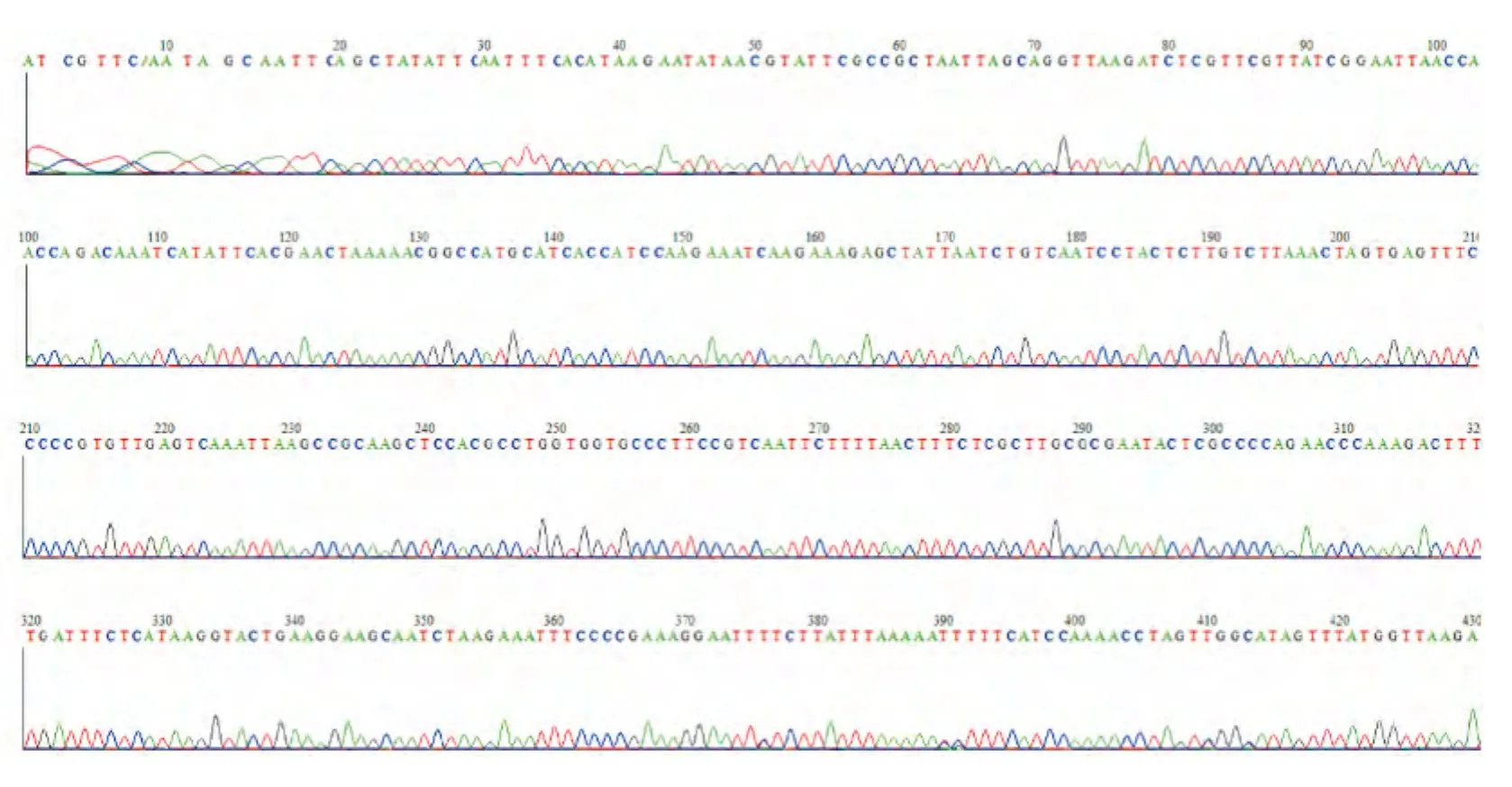

圖3 患者A的測序結果
討 論
本研究所檢出的3例卵形瘧患者的輸入地均為非洲中西部有卵形瘧原蟲流行的國家[9-11],其中2例患者在國外有瘧疾的既往史,另1例患者為瘧疾流行區居民。患者A薄血膜(首診醫療機構未制作厚血膜)初次檢查結果為未檢出瘧原蟲,但由于其具有瘧疾流行病學史和臨床表現,因此對其標本進行了巢氏PCR擴增,當結果為陽性時,回顧閱片時才發現確有卵形瘧原蟲的滋養體和裂殖體,出現首次形態學檢查假陰性可能與患者帶蟲密度較低和鏡檢人員不熟練有關;患者B的厚、薄血膜上,具有形態學上非常典型的卵形和惡性瘧原蟲形態,不容易產生漏診,兩種檢查方法結果一致;患者C形態學檢查結果較巢氏PCR漏診了間日瘧原蟲的感染,由于間日瘧原蟲和卵形瘧原蟲形態上的相似,使得此類混合感染的診斷極為困難,需仔細檢查才可以避免。可見瘧原蟲顯微鏡檢查方法的局限性、混合感染及罕見蟲種(卵形瘧在瘧疾流行最為嚴重的非洲其感染患者占瘧疾病例的比例也很少超過10.5%[12],中國則無本地感染病例,輸入性的卵形瘧也罕見)的出現使輸入性瘧疾的實驗室診斷具有一定難度。目前國內在瘧疾實驗室診斷上具有豐富經驗的檢驗人員斷檔,也是輸入性瘧疾病例漏診和誤診的原因之一[13-16]。因此應當加強瘧疾消除地區瘧原蟲形態學檢查技術培訓,推廣分子生物學檢查技術的應用,減少輸入性卵形瘧實驗室檢查的誤診與漏診。
卵形瘧原蟲雖在形態上同間日和三日瘧原蟲有一定的區別,但這種區別不僅需要閱片經驗,同時還受藥物、血標本類型及操作等多種因素影響。被寄生紅細胞脹大與否及脹大程度是卵形瘧與三日、間日瘧原蟲鑒別要點,但細胞脹大是相對的,當采用不新鮮抗凝標本時這種相對脹大就很難發現;紅細胞邊緣形態也是鑒別點之一,也會受制片和滲透壓等因素影響,這種影響甚或導致判斷錯誤;薛氏點、齊氏點和瘧色素等受標本新鮮度和染色質量的影響更大,標本陳舊、染色不佳時可能根本無法觀察到這些特點;裂殖子的數目和排列形態及瘧原蟲胞漿的特點雖也可作為上述3種瘧原蟲鑒別的要點,但其之間存在不同程度的交叉(裂殖子數目:間日瘧原蟲12~24個,卵形瘧原蟲和三日瘧原蟲為6~12個;胞漿空泡3種瘧原蟲均可出現,間日瘧原蟲和卵形瘧原蟲還可出現偽足)。
一般認為卵形瘧原蟲的潛伏期為10~17 d,發作癥狀較輕,很少復發,多在6~10次發作后自愈[3],這可能與卵形瘧原蟲僅感染網織紅細胞,其原蟲血癥一般限制在2% ~5%的紅細胞內[17]有關。而本研究中患者A在無瘧疾流行區居留時間遠遠超過潛伏期。因此,該患者可能是復發病例,也不排除少數卵形瘧潛伏期更長,或該患者期間有過瘧疾發作,由于癥狀較輕而被忽視的可能。患者C為卵形和間日瘧原蟲的混合感染。間日瘧在紅細胞膜上的受體是Duffy血型抗原。而西非黑人和美國黑人Duffy血型陰性[18],缺少間日瘧受體決定簇,故間日瘧原蟲不能侵入這類紅細胞寄生,可以說Duffy血型陰性的人群對間日瘧原蟲存在天然抵抗[3]。因此,在西非黑人似乎不應該存在卵形和間日瘧原蟲的混合感染。所以患者C的Duffy血型及產生此類混合感染的現象值得進一步研究。而 Purnomo等[19]曾報道1例四重瘧疾感染的病例和在瘧疾高度流行區域健康帶蟲者同時感染3~4種瘧原蟲并不罕見的事實又使卵形和間日瘧原蟲的混合感染可以解釋。
聯合國千年發展目標提出在全球根除瘧疾倡議。衛生部等13部委制定和頒布了“中國消除瘧疾行動計劃(2010~2020年)”。加強瘧疾消除地區瘧原蟲形態學檢查技術培訓及推廣分子生物學檢查寄生蟲技術的應用,減少輸入性卵形瘧實驗室檢查的誤診與漏診十分必要。
[1]Craig CF.New varieties and species of malaria plasmodia[J].J Parasitology,1914,1(2):85-94.
[2]Stephens JWW.A new malaria parasite of man[J].Ann Trop Med Parasitol,1922,87(14):383-388.
[3]張進順,李 薇,孫 新,等.診斷醫學寄生蟲學[M].第5版.北京:人民衛生出版社,2010:109-138.
[4]湯林華,王汝波,王建軍,等.輸入性瘧疾的診治與管理[M].上海:上海科學技術出版社,2010:22-28.
[5]張進順,高興政.臨床寄生蟲檢驗學[M].北京:人民衛生出版社,2009:103-109.
[6]Snounou G,Viryakosol S,Zhu XP,et al.High sensitivity of detection of human malaria parasites by the use of nested polymerase chain reaction[J].Mol Biochem Parasitol,1993,61(2):315-320.
[7]Snounou G,Viriyakosol S,Jarra W,et al.Identification of the four human malaria parasite species in field samples bythe polymerase chain reaction and detection of high prevalence of mixed infections[J].Mol Biochem Parasitol,1993,58(2):283-292.
[8]Singh B,Bobogare A,Cox-Singh J,et al.A genusand species-specific nested polymerase chain reaction malaria detection assay for epidemiologic studies[J].Am J Trop Med Hyg,1999,60(4):687-692.
[9]Carme B,Kenmogne D,Copin N,et al.Plasmodium prevalence and parasitic burden in blood donors of Brazzaville,Congo[J].Ann Soc Belg Med Trop,1993,73(3):179-187.
[10]Gbakima AA.Inland valley swamp rice development:malaria,schistosomiasis,onchocerciasisin south central Sierra Leone[J].Public Health,1994,108(2):149-157.
[11]May J,Mockenhaupt FP,Ademowo OG,et al.High rate of mixed and subpatent malarial infections in southwest Nigeria[J].Am J Trop Med Hyg,1999,61(2):339-343.
[12]Gutman J,Guarner J.Pediatric malaria:8-year case series in Atlanta,Georgia,and review of the literature[J].J Travel Med,2010,17(5):334-338.
[13]Rantala AM,Taylor SM,Trottman PA,et al.Comparison of real-time PCR and microscopy for malaria parasite detection in Malawian pregnant women[J].Malar J,2010,9:269.
[14]Ndao M,Bandyayera E,Kokoskin E,et al.Comparison of blood smear,antigen detection,and nested-PCR methods for screening refugees from regions where malaria is endemic after a malaria outbreak in Quebec,Canada[J].J Clin Microbiol,2004,42(6):2694-2700.
[15]師永霞,黃吉城,蘇錦坤,等.1例國內罕見的輸入性卵形瘧的實驗室檢測[J].中國人獸共患病學報,2011,27(10):914-917.
[16]段績輝,王郭清,張湘君,等.發病不穩定地區瘧疾誤診原因分析[J].中國熱帶醫學,2007,7(7):1111-1112.
[17]Collins WE,Jeffery GM.Plasmodium ovale:parasite and disease[J].Clin Microbiol Rev,2005,18(3):570-581.
[18]王 晨,陳和平,岳丹琪,等.上海地區人群中部分稀有血型篩選[J].檢驗醫學,2007,22(5):583-584.
[19]Purnomo,Solihin A,Gomez-Saladin E,et al.Rare quadruple malaria infection in Irian Jaya Indonesia[J].J Parasitol,1999,85(3):574-579.

