Kiss-1與結腸癌SW480細胞增殖的關系
鐘 華,吳雪艷,劉迪群
(南華大學附屬第一醫院消化內科,湖南 衡陽 421001)
結腸癌是我國最常見的消化系統惡性腫瘤之一,其發病率位居第二位,僅次于胃癌,且近年呈現年輕化及上升趨勢。細胞惡性增殖是惡性腫瘤的重要生物學特性之一,它與腫瘤的惡性程度直接相關。Kiss-1是繼nm23之后,Lee等[1]應用微細胞介導的染色體雜交技術及差減雜交技術在人黑色素瘤細胞株中發現的一種腫瘤轉移抑制基因。其定位于染色體1q32-q41,基因序列中包含四個外顯子,其編碼的蛋白kisspeptin是由145個氨基酸組成的親水性多肽[2]。本研究旨在體外構建高表達Kiss-1的人結直腸腺癌細胞株(SW480)細胞株模型,擬探討Kiss-1基因對結腸癌增殖的影響,為結腸癌患者創造新的治療靶點提供理論依據。
1 材料與方法
1.1 材料與細胞培養
人結腸癌細胞株SW480(湘雅醫學院腫瘤研究所惠贈)培養于含10%胎牛血清的1640培養基中,置于37 ℃,5%CO2飽和濕度培養箱中培養。質粒pEGFP-N1-Kiss-1及空載質粒由上海吉凱公司合成,兩種質粒均含有GFP綠色熒光,經上海吉凱公司測序鑒定無誤。質粒小提試劑盒為康為公司產品,脂質體轉染試劑盒Lipofectamine2000購自美國invitrogen公司,G418及CCK8試劑盒購自北京索萊寶生物科技有限公司,兔抗人Kiss-1一抗購自武漢博士德生物工程有限公司,二抗購自美國Epitomics公司。
1.2 質粒擴增與提取
LB肉湯(Luria-Bertani,LB)2.5 g加入100 mL一級水中配置成25 mg/mL的LB液態培養基,高溫蒸汽消毒備用。培養基中加入卡那霉素,使其終濃度為30 μg/mL。質粒pEGFP-N1-Kiss-1及空載質粒各100 μL分別加入5 mL LB培養基中,37 ℃、180 r/min震蕩16 h。提取純化質粒并進行瓊脂糖凝膠電泳及分光光度計測量質粒濃度。
1.3 穩定轉染
細胞生長至90%~95%融合度時進行轉染。用無血清1640培養基將8 μg pEGFP-N1-Kiss-1質粒和10 μL Lipofectamine2000分別稀釋至總體積為250 μL,室溫下靜置5 min。輕輕混勻兩種溶液,室溫下靜置20 min,將混合液加入SW480細胞中,37 ℃,5%CO2飽和濕度培養箱中培養6 h。吸去培養基,PBS液洗兩遍,加入含10%胎牛血清的1640培養基終止轉染。42 h后更換完全培養基,加入500 μg/mL G418篩選,培養3~4天待細胞大量死亡時,降低G418濃度至300 μg/mL維持篩選4周左右,獲得穩定轉染細胞。空載體pEGFP-N1轉染SW480細胞作為陰性對照組。
1.4 Western blot鑒定Kiss-1在SW480細胞中的表達
分別提取空白對照組、陰性對照組及實驗組中SW480細胞總蛋白,用15%SDS聚丙烯酰胺凝膠電泳,半干轉法轉移至聚偏二氟乙烯膜(Polyvinylidene Fluoride,PVDF膜),麗春紅染色驗證后用含5%血清的TBST封閉2 h,依次孵育對應一抗及辣根過氧化物酶標記的二抗,最后暗室曝光顯像,檢測其中Kiss-1表達的變化。
1.5 CCK8法檢測細胞增殖情況
已處對數生長期的各組細胞用0.25%胰酶消化,制成細胞懸液接種于96孔板內(每孔2×103個細胞)定容至100 μL培養,每組細胞設3個復孔,同時設置3個空白孔(只含細胞培養基)。分別于0、24、48及72 h每孔加入5 μL CCK-8溶液,5%CO2及飽和濕度培養基繼續孵育2 h,檢測450 nm光譜下的吸光度,根據標準曲線用吸光值計算細胞數量,繪制細胞增殖曲線圖。
1.6 統計學方法
2 結 果
2.1 重組質粒pEGFP-N1-Kiss-1的測序鑒定
經上海吉凱基因化學技術有限公司的序列測定分析,顯示合成的目的基因Kiss-1序列完全符合Gene Bank中Kiss-1 cDNA的序列(圖1)。
2.2 SW480細胞轉染質粒及篩選
SW480細胞轉染質粒后24 h,在熒光顯微鏡下觀察細胞,可見綠色熒光。經過4周的G418篩選,G418維持濃度為300 μg/mL,視野里幾乎所有細胞都帶有綠色熒光蛋白。停用G418一周,熒光顯微鏡下觀察綠色熒光基本保持不變。穩定轉染細胞株篩選成功。
2.3 Western blot檢測Kiss-1在SW480細胞中的表達
提取SW480、SW480-pEGFP-N1和SW480-Kiss-1細胞中總蛋白,Western blot檢測Kiss-1蛋白kisspeptin的表達,可見kisspeptin在實驗組的SW480細胞中高表達,而在空白對照組及陰性對照組的SW480細胞中表達量低。結果表明,Kiss-1基因在SW480-Kiss-1細胞中能穩定、高效表達。
2.4 CCK8法檢測各組細胞的增殖能力
圖1 目的基因Kiss-1的測序圖譜位點72-489區間為目的基因序列
運用CCK8法檢測Kiss-1對SW480細胞的增殖情況的影響。分別于種板0、24、48、72 h加入CCK8試劑,孵育2 h,用酶標儀測定各組細胞的450 nm波長吸光值(OD值),繪制細胞增殖曲線。結果顯示,培養24 h時各組細胞增殖能力間差異無統計學意義(P>0.05)。48 h后,隨著培養時間延長,實驗組細胞增殖能力明顯低于對照組(P<0.05)。而空白對照組與陰性對照組間細胞增殖能力無明顯差異(P>0.05)(圖2)。
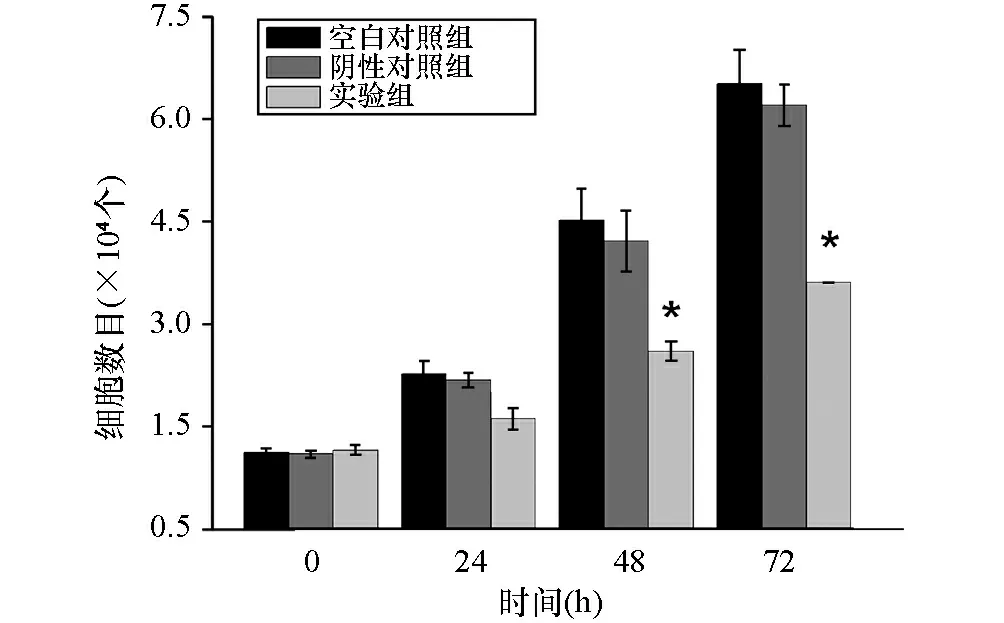
圖2 CCK8法檢測Kiss-1對SW480細胞增殖能力的影響
3 討 論
腫瘤的發生發展與細胞惡性增殖密切相關,細胞增殖失控級凋亡異常導致腫瘤細胞壽命延長。多種癌基因與抑癌基因參與腫瘤的發生與發展過程。Kiss-1是近來頗受關注的一種抑癌基因,其基因結構由四個外顯子區域組成,外顯子Ⅰ與外顯子Ⅱ為非編碼區,外顯子Ⅲ的結構依次為翻譯起始位點、38個非編碼堿基、及103個編碼堿基,外顯子Ⅳ含335個翻譯堿基、翻譯終止點、多腺苷酸化信號和121個非編碼堿基。先前有學者研究表明其對胃癌、腎細胞癌等多種人類惡性腫瘤有轉移抑制作用[3-5]。同時在小細胞肺癌、骨肉瘤、胃癌等腫瘤細胞增殖過程中,Kiss-1也發揮著負性調節作用[4,6-7]。同樣地,對鼻咽癌、肝癌患者的研究顯示,低表達Kiss-1的患者惡性程度更高,患者的預后明顯落后于高表達Kiss-1的患者,而Kiss-1表達水平高的腫瘤患者,腫瘤發展慢,預后相對較好[8]。國內外亦不乏學者對Kiss-1基因與結腸癌組織進行研究。Liang等[9]通過免疫組織化學方法發現,Kiss-1基因與結腸癌的分級、分期、腫瘤大小及淋巴結轉移存在一定的關聯性,提出Kiss-1對診斷結腸癌、判斷其預后具有重要的潛在意義。本研究通過構建pEGFP-N1-Kiss-1重組質粒,成功將Kiss-1重組質粒轉染SW480細胞。CCK8實驗證實SW480細胞的體外增殖能力從細胞周期的48h開始顯著下降,實驗組細胞生長速度較陰性對照組及空白對照組明顯減慢,差異有統計學意義。因此,推測Kiss-1基因能有效抑制結腸癌SW480細胞的增殖能力,從而影響結腸癌的發生、發展。
腫瘤的發生是多種基因共同作用的多步驟、多階段的過程,很多研究結果顯示Kiss-1基因的表達與多種腫瘤的增殖、浸潤、轉移密切相關,然而其在腫瘤的發生發展中的具體作用機制有待進一步研究。
[1]Lee JH,Miele ME,Hicks DJ,et al.KiSS-1,a novel human malignant melanoma metastasis-suppressor gene[J].J Natl Cancer Inst,1996,88(23):1731-1737.
[2]Lee YR,Tsunekawa K,Moon MJ,et al.Molecular evolution of multiple forms of kisspeptins and GPR54 receptors in vertebrates[J].Endocrinology,2009,150(6):2837-2846.
[3]Ji K,Ye L,Mason MD,et al.The Kiss-1/Kiss-1R complex as a negative regulator of cell motility and cancer metastasis (Review)[J].Int J Mol Med,2013,32(4):747-754.
[4]Li N,Wang HX,Zhang J,et al.KISS-1 inhibits the proliferation and invasion of gastric carcinoma cells[J].World J Gastroenterol,2012,18(15):1827-1833.
[5]Chen Y,Yusenko MV,Kovacs G.Lack of KISS1R expression is associated with rapid progression of conventional renal cell carcinomas[J].J Pathol,2011,223(1):46-53.
[6]胡向東,熊聲賀,熊麗.人Kiss-1重組質粒的構建及其對小細胞肺癌NCI-H446細胞增殖能力的影響[J].實用臨床醫學,2013,14(4):7-9.
[7]林建華,沈榮凱,張俐.KiSS-1基因對骨肉瘤MG63細胞增殖與黏附能力影響的研究[J].中華腫瘤防治雜志,2011,18(9):667.
[8]Shengbing Z,Feng LJ,Bin W,et al.Expression of KiSS-1 gene and its role in invasion and metastasis of human hepatocellular carcinoma[J].Anat Rec (Hoboken),2009,292(8):1128-1134.
[9]Liang QL,Chen XD,Wang SM,et al.Expression of vascular endothelial growth factor and metastin in colorectal carcinoma[J].Nan Fang Yi Ke Da Xue Xue Bao,2007,27(10):1584-1587.

