植物甾醇酯的化學合成及其分離研究進展
許青青 金文彬 蘇寶根 楊亦文 任其龍
植物甾醇酯的化學合成及其分離研究進展
許青青1,2金文彬1蘇寶根1楊亦文1任其龍1
(浙江大學生物質化工教育部重點實驗室1,杭州 310027)
(衢州學院化學與材料工程學院2,衢州 324000)
植物甾醇具有降低血清膽固醇、獨特的消炎、退熱及抗腫瘤等功能,但其不溶于水,脂溶性也相當有限的缺點限制了其應用前景。酯化后的植物甾醇酯不僅大大改善了植物甾醇的脂溶性,而且抑制人體對膽固醇的吸收作用優于植物甾醇。植物甾醇酯的合成正成為世界各國競相研究的熱點。目前,已報道的制備方法主要有化學合成法、脂肪酶催化法和超臨界生物酶法。后兩者均采用酶做催化劑,由于酶的生產成本高,且酶法生產率低限制了其大規模工業化生產,因此化學合成法仍然是植物甾醇酯商業化生產的主要方法和研究重點。本文以此為重點,綜述了近年來植物甾醇酯的化學合成及其分離純化技術的研究概況和最新進展,并展望了未來的研究方向。
植物甾醇 植物甾醇酯 化學合成 分離純化 研究進展
植物甾醇是一種天然活性物質,存在于多種水果、蔬菜、豆類、堅果、谷類及其它植物性食品中,除了眾所周知的具有降低血清膽固醇外,還具有獨特的消炎、退熱、抗腫瘤、抗氧化、美容、抑制血小板凝聚及調節動物生長等功能,廣泛應用在食品、保健、醫藥以及化工等領域。植物甾醇種類繁多,至今發現已有100多種,常見的為β-谷甾醇(β-Sitosterol)、豆甾醇(Stigmasterol)、菜油甾醇(Campesterol)和菜籽甾醇(Brassicasterol)等4種4-無甲基甾醇,其分子的基本骨架由3個六元環和一個五元環組成,C-3位連有一個羥基,C-17位連有一個由8~10個碳原子構成的脂肪族側鏈,C-5位上為雙鍵。植物甾醇的基本結構及常見的4-無甲基甾醇的分子結構如圖1所示。
從圖1可以看到,植物甾醇的分子結構中甾體的多元環及C-17位上連有8~10個碳原子組成的烴鏈導致其在水中的溶解度極小,C-3位羥基使其在油相中的溶解度相當有限,而且其熔點較高,從而限制了其實際應用范圍。植物甾醇的C-3位羥基是重要的活性基團,可與脂肪酸化合形成植物甾醇酯。酯化后的甾醇酯大大改善了植物甾醇的脂溶性,且熔點也更低;甾醇酯可通過胰膽固醇脂酶水解成為游離甾醇被人體吸收,降膽固醇效果優于甾醇[1-2];甾醇酯還保護了甾醇中活潑的C-3位羥基,增強了穩定性。

圖1 植物甾醇的基本結構及常見的植物甾醇的分子結構
國外自90年代初就開始研究植物甾醇酯制備工藝,并將其添加到油脂和食品中。甾醇酯的安全性已經得到了世界多個國家的認可。1999年,美國食品與醫藥管理局(FDA)批準添加了植物甾醇酯的食品可以使用“有益健康”的標簽。2004年,歐盟委員會批準植物甾醇酯在黃油涂醬、牛奶類產品及優酪乳類等食品中使用。2007年,英國食品標準局給予植物甾醇酯健康成分的審批。目前國外市場已經成功開發出添加植物甾醇酯的人造奶油、黃油、食用油等保健食品,在醫藥和化妝品方面也得到了廣泛應用[2-9]。2010年,我國允許植物甾醇酯作為新資源食品在食品中添加(中華人民共和國衛生部食品安全綜合協調與衛生監督局,2010年第3號新資源食品公告),其產品質量指標見表1。

表1 植物甾醇酯的質量指標
目前,已報道的植物甾醇酯制備方法主要有化學合成法[6-12]、脂肪酶催化法[13-17]和超臨界生物酶法[18-19]。后兩者均采用酶做催化劑,雖然具有反應條件溫和、高效專一、副產物少、易于分離純化等明顯優勢,但酶的生產成本高,且酶法生產率低等限制了其在工業化生產中的應用。到目前為止,化學合成法仍然是植物甾醇酯商業化生產的主要方法,是國內外研究的重點。我國目前對植物甾醇的提取和分離純化技術研究較多,但對植物甾醇酯的開發研究還處于起步和探索階段,研究水平仍大大落后于國外,難以達到產品質量指標。因此,探索和開發操作簡便、條件溫和、綠色、高效的植物甾醇酯化學合成與分離純化技術具有十分重要的實際應用價值。本文將對近年來植物甾醇酯化學合成與分離純化技術的研究概況和最新進展進行總結,并展望今后植物甾醇酯合成的研究重點和方向。
1 植物甾醇酯的制備
植物甾醇酯主要是以酯化或酯交換的方法來制備,酯化一般有以下3種途徑:1)植物甾醇與脂肪酸直接酯化;2)植物甾醇與脂肪酸酸酐反應;3)植物甾醇同脂肪酸鹵化物反應。酯交換一般是植物甾醇同脂肪酸甲酯(乙酯)進行酯交換。用于合成的植物甾醇原料主要為β-谷甾醇、豆甾醇、菜油甾醇和菜籽甾醇,或者是它們的混合物。用于合成的脂肪酸原料包括飽和脂肪酸,如硬脂酸、軟脂酸、月桂酸,不飽和脂肪酸如油酸、亞油酸、共軛亞油酸(CLA)、亞麻酸、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),以及各種脂肪酸不同比例的混合物和葵花籽油等食用油脂。在合成中可采用不同的原料、不同的合成原理、不同的催化劑,在不同的工藝條件下進行。
1.1 植物甾醇與脂肪酸直接酯化
植物甾醇與脂肪酸直接酯化,又叫羧酸酯化,所用的原料均容易獲得,適合大部分甾醇酯的合成,是化學合成中最重要的方法。羧酸酯化是可逆反應,產物水存在于反應體系中對整個酯化過程是不利的。有些學者考慮在反應體系中加入一定量的甲苯或二甲苯,既作為反應溶劑又作為帶水劑。如陳茂彬等[20]以二甲苯為帶水劑,硫酸氫鈉為催化劑,植物甾醇與油酸為原料直接酯化合成甾醇酯。在油酸與甾醇的物質的量比為1.3∶1,催化劑用量為甾醇物質的量的2%,反應溫度135℃,反應時間8 h的最佳反應條件下,酯化率為84.3%。由于甲苯或二甲苯有毒,產品可能存在安全性問題,有些學者采用不加帶水劑,以過量脂肪酸充當反應溶劑,在一定的真空度下去除反應生成的水。如Higgins[6]在真空條件下,以過量熔融脂肪酸作溶劑,硫酸氫鈉作催化劑,脂肪酸與甾醇物質的量比1.2∶1,反應溫度100~200℃,直接酯化合成甾醇酯,酯化率高達98%。之后,Higgins[7]又以熔融脂肪酸作溶劑,植物甾醇、棕櫚油、油酸、硬脂酸、二十二碳六烯酸(DHA)、共軛亞油酸(CLA)為原料,硫酸氫鈉作催化劑,在反應溫度100~200℃,反應時間12~15 h,真空下合成高純度食品級植物甾醇酯。
植物甾醇屬于仲醇,其主體甾核為環戊烷多氫菲核,空間位阻較大,酯化較困難。同時,隨著脂肪酸碳鏈的加長,直接酯化難度也逐漸增大。為了促進反應的進行,反應溫度一般都控制在100℃以上,并延長反應時間。為了防止高溫副反應,有些學者考慮與一些新型技術相結合,如陳舒[21]結合微波技術合成甾醇酯,在硬脂酸與甾醇的物質的量比1.2∶1,反應溫度135℃,反應時間10 min的最優工藝條件下,酯化率為90.6%。結合微波技術,大大縮短了反應時間。
由于羧酸中羰基的活性較低,酯化速率較慢,促使許多學者開展羧酸酯化催化劑的探索性研究。文獻報道羧酸酯化催化劑可選擇無機酸、有機磺酸和酸式鹽等。經過試驗對比,綜合考慮催化劑的腐蝕性、催化效果、價格及后處理等因素,認為有機磺酸和酸式鹽比濃硫酸、磷酸等無機酸催化劑腐蝕性小,后處理方便,催化效果好。陳茂彬[22]分別對對甲苯磺酸、硫酸氫鈉和磷酸二氫鈉催化劑進行了對比試驗。結果表明,對甲苯磺酸催化效率較高,但副反應多,得到的產品顏色較深且不易脫色。磷酸二氫鈉作催化劑得到的產品顏色較淺,但酯化率不高;硫酸氫鈉催化劑易溶于水,在反應后容易除去,所得產品色澤較淺,但反應時間相對要長。Deng等[23]以硫酸氫鈉作催化劑,不含有機溶劑下直接酯化生產多不飽和脂肪酸甾醇酯。在多不飽和脂肪酸與甾醇的質量比為4∶1,催化劑用量為原料重量的3%,反應溫度130℃,反應時間8 h的條件下,酯化率高達96%。董濤等[24]采用十二烷基硫酸鈉作催化劑,以甾醇和月桂酸為原料直接酯化合成甾醇月桂酸酯。在酸醇物質的量比1.4∶1,反應溫度120℃,催化劑用量為甾醇量的1.5%,反應時間4 h的最佳反應條件下,酯化率為87.9%。在月桂酸與甾醇物質的量比1.3∶1,反應溫度120℃,催化劑十二烷基硫酸銅用量為甾醇量的1.0%,反應時間4 h的合成條件下,酯化率為 92.1%[25]。
文獻報道羧酸酯化催化劑也可選擇氧化鋅、氧化鈣、氧化鋁、分子篩、硅膠、雜多酸和強酸性離子交換樹脂等。Roden等[9]以ZnO2或堿水等作催化劑,采用硬脂酸、棕櫚酸、DHA、二十碳五烯酸(EPA)、油酸、亞油酸、亞麻酸為原料,以羧酸、多不飽脂肪酸、飽和酸以及不飽和酸為溶劑,在反應溫度100~220℃,真空下與甾醇直接酯化合成甾醇酯,酯化率達98%。郭濤等[26]以氧化鈣為催化劑,甾醇與脂肪酸直接酯化合成甾醇酯,并且與其他催化劑(氧化鋁、氧化鋅、硅膠、4A型分子篩)的催化效果進行比較。結果表明:以氧化鋁為催化劑,在氧化鋁用量0.8%,酸醇物質的量比1.4∶1,反應溫度190℃下反應10 h,酯化率最高,可達99.5%;氧化鈣、分子篩和硅膠也有較好的催化性能。Meng等[10]在催化劑 ZnO/Al2O3用量10 g/kg(以 ZnO質量計算),油酸與甾醇物質的量比2∶1,反應溫度170℃下反應10 h,酯化率為90%以上。在催化劑硅鎢酸用量0.2%,酸醇物質的量比1.5∶1,反應溫度150℃,反應時間5 h下合成脂肪酸甾醇酯,酯化率可達90%以上[27]。王勇等[28]以硅膠為催化劑,用甾醇與脂肪酸直接酯化合成甾醇酯。在酸醇物質的量比1.5∶1,反應溫度190℃,反應時間10 h的條件下,酯化率達94.3%。何則強等[29]用氧化錫固載磷鎢雜多酸(PW12/SnO2)催化合成α-亞麻酸甾醇酯。在植物甾醇與α-亞麻酸物質的量比為1∶3,催化劑用量為(占總反應物料的質量分數)0.6%,溫度50℃,反應時間5 h條件下,酯化率為85.92%。陳靜等[30]以強酸性離子交換樹脂為催化劑直接酯化合成甾醇酯。在植物甾醇與脂肪酸的物質的量比1.4∶1,反應溫度135℃,催化劑質量分數11%,反應時間13 h的合成條件下,酯化率為40%~60%。
使用離子液體作為催化劑合成甾醇酯的相關研究也有報道。與以上傳統催化劑相比,離子液體催化酯化反應有許多優點,如良好的催化活性,成本低,易于制備、分離和回收[31-33]。楊謙等[34]以煙酸和植物甾醇為原料,甲基咪唑或吡咯烷酮酸性離子液體作催化劑,制備了甾醇煙酸酯。在酸醇物質的量比1.2∶1,反應溫度120℃,反應時間1 h時,酯化收率達82.5%,離子液體可重復使用3次以上,催化活性不受影響。楊葉波等[35]以離子液體 ChCl·2SnCl2為催化劑直接酯化合成亞油酸甾醇酯。在酸醇物質的量比2∶1,ChCl·2SnCl2用量為植物甾醇質量的8%,反應溫度160℃,反應時間4 h的最佳反應條件下,酯化率為89.73%。離子液體在重復使用5次后仍有較高催化活性。在月桂酸與植物甾醇物質的量比3∶1,反應溫度150℃,7%的離子液體ChCl·2SnCl2作為催化劑,反應時間4 h的合成條件下,酯化率達92%[12]。尋找一種高效綠色的催化劑一直是羧酸酯化合成領域的熱點,不同催化劑對羧酸酯化的影響見表2。

表2 不同催化劑對直接酯化的影響
截至目前,羧酸酯化法基本上都是在無溶劑狀態下合成,整個過程不使用有毒有害物質。如張品等[36]在真空度為 0.03~0.04 MPa,α-亞麻酸與甾醇的質量比4∶1,硫酸氫鈉催化劑量2.5%(底物的質量),反應時間8 h,反應溫度140℃的條件下無溶劑直接酯化合成 α-亞麻酸甾醇酯,酯化率為98.9%,是一種綠色、安全、高效的合成工藝。另外,羧酸酯化也可不用催化劑,如美國專利報道了以卡諾拉油脂肪酸、亞油酸、油酸為原料,在反應溫度150~260℃下與甾醇直接酯化合成甾醇酯,酯化率大于95%[37]。整個過程無溶劑和無催化劑,產品達到食品級,并可用于大規模生產。
1.2 植物甾醇與脂肪酸酸酐反應
植物甾醇與脂肪酸酸酐反應生成甾醇酯,稱為酸酐酯化。羧酸酐是比羧酸更強的酰化劑,適用于空間阻礙較大、較難反應的植物甾醇的酯化。植物甾醇與酸酐的物質的量比一般為1∶8~10左右,羧酸酐過量可提高反應速率,縮短反應時間。常加入少量吡啶作為催化劑來加速反應,反應溫度一般控制在80~90℃,反應時間為3~4 h。如陳茂彬等[38]采用植物甾醇與乙酸酐酯化的方法合成甾醇乙酸酯。在原料配比 n(甾醇)∶n(乙酸酐)∶n(吡啶)=1∶9∶5,反應溫度85℃;反應時間2 h的最優工藝條件下,酯化率達98%。
1.3 植物甾醇同脂肪酸鹵化物反應
植物甾醇同脂肪酸鹵化物反應,叫羧酸酰氯酯化。先把羧酸制成酰氯,再與甾醇反應生成甾醇酯,雖然經過2步,結果卻比直接酯化好。因為酰氯的反應活性比相應的羧酸和酸酐都強,酰氯的酯化反應極易進行,是一個不可逆反應。對于不宜采用羧酸直接酯化法來合成甾醇酯的長碳鏈脂肪酸、支鏈脂肪酸、芳香族羧酸和其它存在空間阻礙的羧酸,酰氯酯化法是一個普遍適用的方法。如煙酸與植物甾醇直接酯化很困難,故而采用酰氯酯化法[39]。
1.4 酯交換反應
1996年,美國專利介紹了一種酯交換方法:植物甾醇與過量的脂肪酸甲酯混合,加入乙醇鈉催化劑在90~120℃,666.6~1 999.8 Pa真空度下反應2 h;最后經分離、真空干燥,即得所需的甾醇酯產品。酯交換是一個可逆反應,反應轉化率和產品選擇性與原料配比、反應溫度、反應時間、催化劑種類和催化劑的用量等有關[40]。為促使反應向正方向進行,可采用把生成的低沸點甲醇或乙醇從反應體系中移除的方法。另外,可通過選用合適的催化劑,提高反應溫度,延長反應時間等手段來提高產品收率。為了防止高溫副反應,反應體系也可在充氮、真空或加壓條件下進行。如美國專利報道了在反應體系充氮氣,流速80 mL/min,油酸甲酯與植物甾醇物質的量比1∶1,催化劑氧化鑭5%,機械攪拌速度500 r/min,反應溫度240℃下反應7 h合成油酸甾醇酯的方法[41]。
堿性催化劑是目前酯交換反應使用最廣泛的催化劑,尤其是烷氧基堿金屬化合物,如甲醇鈉、乙醇鈉是最常用的催化劑。van Amerongen等[42]提供了一種植物甾醇與葵花籽油脂肪酸甲酯為原料,以甲醇鈉作催化劑,進行酯交換制備脂肪酸甾醇酯的生產工藝。在溫度110~125℃,微壓,無溶劑條件下進行,酯化率為40%~85%,產品達到食品級。之后,Flickinger等[43]采用脂肪酸甘油酯(卡諾拉油、玉米、葵花籽、棉籽、橄欖和亞麻油脂肪酸甘油酯)與游離甾醇在甲醇鈉或乙醇鈉作用下發生酯交換合成甾醇酯,條件:n(脂肪酸甘油酯)∶n(甾醇)=(0.8~10)∶1,催化劑用量0.01%~0.5%,反應時間0.5~0.6 h,反應溫度120~260℃,真空度1.333~133.322 Pa。Burdiek等[44]采用植物甾醇(β-谷甾醇,豆甾醇,菜油甾醇及混合物)與EPA(二十碳五烯酸)、DHA(二十二碳六烯酸)等n-3系列不飽和脂肪酸(n-3 PUFA)甲酯或乙酯為原料,以C1~C4醇的烷氧基鈉作催化劑,在反應溫度80~140℃,壓力133~665 Pa下合成多不飽和脂肪酸甾醇酯。李春榮等[45]以甲醇鈉作催化劑,通過植物甾醇與共軛亞油酸甲酯發生酯交換反應來制備甾醇共軛亞油酸酯,在反應溫度100℃,反應時間2 h,真空度1 333.22~2 666.44 Pa下,產率94%,純度96%。姜媛媛等[46]以甲醇鈉作催化劑,采用植物甾醇與高油酸葵花籽油甲酯酯交換的方法合成了甾醇高油酸葵花籽油酯。在甲酯與甾醇物質的量比2∶1,催化劑為甾醇質量的3%,反應溫度132℃,反應時間5 h的最優工藝條件下,酯化率達62.1%。夏輝等[47]以甲醇鈉為催化劑,植物甾醇、油酸甲酯為原料,研究了甾醇酯的合成工藝。確定了反應的最優條件為:油酸甲酯與甾醇物質的量比4∶1,催化劑用量1.2%,反應溫度125℃,反應時間4 h,真空度0.095 MPa,甾醇酯純度為92.28%。
氫氧化鈉相對于甲醇鈉的價格要便宜些。Lin Linsen[8]采用甾醇(包括40%β-谷甾醇,20%~30%菜油甾醇,10%~30%的菜籽甾醇)與共軛亞油酸甲酯(共軛亞油酸包括41%順9、反11-CLA;44%反10、順12-CLA,10% 順 10、順 12-CLA)為原料,以甲醇鈉、氫氧化鈉作酯交換催化劑,在110℃,真空度2 666.44 Pa下進行2~20 h合成共軛亞油酸甾醇酯。甲醇鈉在用于制備甾醇酯的堿催化劑中表現出較高的催化活性。另外,CaO、Ca(OH)2、Mg(OH)2等固體堿具有成本低,堿性強的優點,也表現出較好的催化活性。Milsten等[48]以菜籽油、棕櫚仁油、椰子油、豬油、玉米油、棕櫚油、橄欖油、芝麻油、十二烷雙酸、壬二酸、十三烷雙酸為原料,以 CaO、Ca(OH)2、Ca(COO)2、Mg(OH)2或組合物作酯交換催化劑同植物甾醇反應合成甾醇酯。其反應條件為:催化劑用量0.01%~0.2%,酯交換溫度190~210℃,反應壓力 <3 000 Pa。
酯交換反應使用堿性催化劑的優點是反應條件溫和、反應速度快,易于工業化。但酯化率不高,堿性催化劑對設備的強腐蝕性以及副產物甲醇都是合成食品級甾醇酯所不期望的,且在制備過程易生成皂化物,給產物的分離帶來困難。另外,由于產物色澤深,還需要脫色等后處理步驟,易造成環境污染等問題。因此,尋找一種新型高效催化劑,使其具有催化效果好、價格便宜、易于工業化、環保等特點,是酯交換反應合成領域的一個重要課題。
通過上述分析,結合實際研究中各種合成方法的特點,可把其優缺點歸納如表3所示。
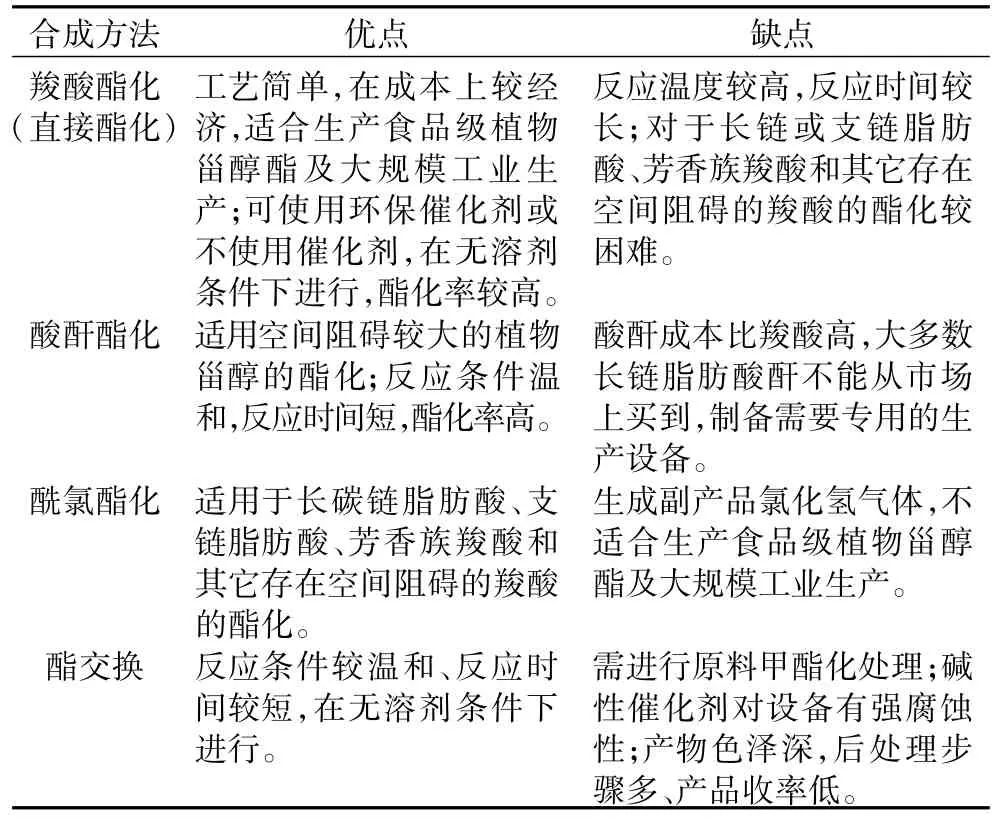
表3 不同合成方法的比較
2 植物甾醇酯的分離純化
合成的植物甾醇酯粗產品中除了甾醇酯,還混有少量的植物甾醇和脂肪酸,這些非目標產物的存在,使合成的甾醇酯往往不能滿足食品、藥品等領域的苛刻要求,需進一步分離純化。目前關于甾醇酯分離純化的報道不多,主要有以下幾種:
2.1 溶劑萃取法
甾醇酯在烷烴溶劑中有較大的溶解度,且隨著溫度升高溶解度顯著提高,而在醇類、酯類中的溶解度很小,且即使升溫溶解度也變化不大。甾醇在醇類(特別是正丁醇)中的溶解度隨溫度變化很大,而在烷烴中溶解度較小,且隨溫度變化也不如在醇類中顯著。姜媛媛等[46]利用高油酸葵花籽油甲酯、植物甾醇和甾醇酯在有機溶劑中的溶解性差異,用甲醇和正己烷對甾醇酯粗產品進行萃取。試驗表明:先用正己烷溶解產品,再用甲醇提取殘留的甲酯,即使提取次數增加,也不能達到產品質量要求;將甲醇與正己烷的添加順序顛倒,則提純后產品顏色很白,符合產品質量要求。董濤[25]利用月桂酸酯和植物甾醇在正庚烷中的溶解度差異實現甾醇與甾醇酯的分離。先用正庚烷溶解甾醇酯,將部分甾醇與甾醇酯分離,再用1 mol/L NaHCO3溶液去除體系中的游離脂肪酸。分離月桂酸酯收率為71.5%,純度為92.5%。同理,使用正己烷分離共軛亞油酸酯收率為62.4%,純度為87.2%。
單純以正己烷為溶劑,脂肪酸皂化后整個溶液為一混濁體系,使醇酯較難分離。張娟聰等[49]選擇正己烷/無水酒精體系則有效地解決了這個問題。以50 mL正己烷無水酒精(1∶1)溶液溶解5 g甾醇油酸酯粗品后,加入過量的NaHCO3以皂化過量的游離脂肪酸,除去皂化物,上層甾醇酯溶液中加入5 g高嶺土脫色2 h,抽濾除去脫色劑后濾液旋轉蒸發得到純化的甾醇酯,收率為95.85%。
楊葉波等[50]以正己烷/無水乙醇/NaHCO3水溶液形成的萃取劑對粗產物一步分離提純。處理工藝為:在正己烷/無水乙醇的復合溶劑中完全溶解粗產物形成澄清溶液,滴加NaHCO3中和,溶液分為2層,上層為溶解了甾醇酯的正己烷相,收集并經旋轉蒸發即得到純化產品。將萃余相加熱去除乙醇后可收集植物甾醇,再進行鹽析可回收脂肪酸鹽。最佳分離工藝參數為∶正己烷∶無水乙醇為1∶1、正己烷/粗產物液質比(mL/g)為 7.5,純度達 99.2%,收率達95.4%。
2.2 硅膠柱層析法
董濤[25]采用硅膠柱層析法分離甾醇月桂酸酯。將反應粗品投入無水乙醇中(料醇比=1∶5),加熱到60℃,加2滴酚酞,用0.1 mol/L的KOH乙醇溶液滴至溶液變紅,振搖30 s不變色。取下層油狀物真空干燥。將上述干燥的混合物加環己烷溶解,然后用硅膠柱層析分離。硅膠柱規格:1 000 mm×12 mm i.d.,100~200目硅膠。硅膠柱色譜條件:流動相為環己烷/無水乙醚(19∶1),流速 25 mL/h,按 1管/15 min收集洗脫液,并用TLC檢測產物,收集甾醇酯。當甾醇酯全部洗脫出來之后洗脫液換成環己烷/無水乙醚/乙醇(19∶1∶10),流速25 mL/h,按 l管/15 min收集洗脫液,并用TLC檢測將吸附在硅膠上的甾醇洗脫下來回收利用。采用硅膠柱層析分離可以得到較為純凈的甾醇酯,且分離簡單,易行,經HPLC測定,純度高達99%[50]。但硅膠柱層析分離耗時且效率低,不適用于工業化生產。
2.3 重結晶法
陳茂彬等[39]將甾醇煙酸酯在有機介質中加入36%鹽酸,25~30℃攪拌反應3~4 h,對產品進行重結晶精制,得到鹽酸甾醇煙酸酯。采用丙酮和正己烷做溶劑對甾醇酯粗產品進行重結晶。試驗表明:用丙酮重結晶后產品仍為粉末狀,且顏色不是很白;用正己烷重結晶出的產品為白色片狀晶體,總產率78.1%,純度 95.95%[22]。
2.4 洗滌法
甾醇油酸酯粗產品中還含有少量未反應完的游離植物甾醇和過量油酸,應設法除去。陳茂彬等[20]將提純工藝分為2步,首先以一定量的2%碳酸氫鈉溶液進行洗滌,使油酸變成水溶性的油酸鈉。粗產品經過2次洗滌后,去掉了大部分油酸。第二步采用少量乙醇進行洗滌,邊攪拌邊加熱到45℃左右。用乙醇洗滌3次后,再經真空干燥,即得甾醇油酸酯產品。經檢測,產品的酸值為2.3 mgKOH/g,游離植物甾醇的質量分數為3.3%,產品純度為90.2%。
2.5 分子蒸餾法
在用植物甾醇與脂肪酸直接酯化合成的甾醇酯樣品中加入3%活性白土脫色后進入分子蒸餾設備。蒸餾溫度170~200℃,壓力0.1 Pa,收集重相即為甾醇酯產品[26]。當分子蒸餾選擇在200℃時,甾醇酯質量分數可達到98.4%[28]。
通過上述分析,目前適于工業化生產的分離純化方法見表4。

表4 分離純化方法比較
由表4可知,選擇正己烷/無水乙醇/碳酸氫鈉水溶液形成的萃取體系進行溶劑萃取是目前較為理想的分離提純方法,與其它方法相比,該工藝采用一步法將甾醇酯從脂肪酸-甾醇-甾醇酯三元體系中提取出來,簡單、經濟。但由于脂肪酸的化學結構不同,所形成的甾醇酯的生理活性和物理化學性質有較大的差別,對甾醇酯產物進行分離純化時,仍必須根據各種甾醇酯在有機溶劑中的溶解度的不同,各種合成方法帶來的產物中雜質種類和含量的不同,對產物純度和色澤度要求的不同,采取相應的萃取、柱層析、重結晶、洗滌、脫色、分子蒸餾等分離純化方法進行處理。
3 結論與展望
植物甾醇酯的制備采用化學合成法具有工藝簡單、成本低、產量高、易于控制和實現工業化生產等優點,近年來國內外不斷有新的成果出現,人們可以結合實際需要選擇不同方法來實現自己的合成目標。由于直接酯化法酯化率高,在成本上也更經濟,適合于生產食品級產品及大規模工業生產,在工業上基本都采用該法。但直接酯化仍存在一些問題,如需要在較高溫度下,長時間反應,這樣容易發生副反應,且隨著脂肪酸碳鏈的加長,反應難度加大等。因此,選擇一種合適的催化劑以及在合成過程中如何采用有效、便捷、適宜于工業化應用的保護措施,以避免副產物的生成仍是直接酯化中一個有待解決的關鍵技術。
我國對植物甾醇酯的開發研究近年來雖有所發展,但與國際水平相比差距甚遠。這無疑是對我國研究工作者的一大挑戰,也是我們面臨的艱巨任務。由于植物甾醇和脂肪酸的種類很多,植物甾醇與脂肪酸酯化得到甾醇酯產品的種類也很多,反應后的體系中酯、酸、醇并存,且它們在有機溶劑中均有相當的溶解度,難以分離完全。目前的分離純化方法中仍存在高純度和高回收率不能兼得的缺陷,要得到高質量的產品是目前制備植物甾醇酯的一個技術難點。因此,探討高效的植物甾醇酯分離純化技術,以提高產品質量,降低生產成本,適應各種應用的需求也是植物甾醇酯制備中的挑戰性課題。
展望未來,尋找一種廉價、高效、綠色的催化劑進行合成,選擇一個合適的溶劑體系和處理工藝進行分離純化,以達到簡化工藝、節省能源、降低生產成本、高安全無污染的目的,將是我國未來植物甾醇酯制備研究的重要發展方向。
[1]博迪克 D C,莫伊尼 G,雷德斯多夫 D,等.植物甾醇和植物甾烷醇衍生物[P].CN:1256277A,2000-06-14
[2]Berry C J,Bierenbaum M L.Anticholesterolemic edible oil:[P]US:6277431.2001-08-21
[3]Wester I.Fat composition for use in food:US,6162483[P].2000-12-19
[4]Stewart D J,Milanova R,Zawistowski J,et al.Phytosterol compositions and use thereof in foods,beverages,pharmaceuticals,nutraceuticals and the like:US,6087353[P].2000-07-11
[5]Nashed B,Yeganeh B,Hayglass K T,et al.Antiatherogenic effects of dietary plant sterols are associated with inhibition of proinflammatory cytokine production in apo E-KO mice[J].Journal of Nutrition,2005,135(10):2438-2444
[6]Higgins III JD.Preparation of sterol and stanol-esters:US,5892068[P].1999-04-06
[7]Higgins III JD.Preparation of sterol and stanol-esters:US,6147236[P].2000-11-14
[8]Liu linsen.Sterol esters of conjugated linoleic acids and process for their production:US,6413571[P].2002-07-02
[9]Roden A,Williams J L,Bruce R,et al.Preparation of sterol and stanol-esters:US,6184397[P].2001-02-06
[10]Meng X,Pan Q,Yang T.Synthesis ofphytosteryl esters by using alumina-supported zinc oxide(ZnO/Al2O3)from esterification production of phytosterol with fatty acid[J].Journal of the American Oil Chemists Society,2011,88(1):143-149
[11]Robles-Manuel S,Barrault J,Valange S.Selective synthesis of phytosterol esters from natural sterols and fatty methyl esters over Mg-containing solid catalysts[J].Comptes Rendus Chimie,2011,14(7-8):656-662
[12]Yang Y B,He W S,Jia C S,et al.Efficient synthesis of phytosteryl esters using the Lewis acidic ionic liquid[J].Journal of Molecular Catalysis A:Chemical,2012,357:39-43
[13]ShimadaY,HirotaY,Baba T,et al.Enzymatic synthesis of steryl esters of polyunsaturated fatty acids[J].Journal of the American Oil Chemists'Society,1999,76(6):713-716
[14]Vu PL,Shin JA,Lim CH,et al.Lipase-catalyzed production of phytosteryl esters and their crystallization behavior in corn oil[J].Food Research International,2004,37(2):175-180
[15]Villeneuve P,Turon F,Caro Y,et al.Lipase-catalyzed synthesis of canola phytosterols oleate esters as cholesterol lowering agents[J].Enzyme and Microbial Technology,2005,37(1):150-155
[16]Kim B H,Akoh C C.Modeling and optimization of lipasecatalyzed synthesis of phytosteryl esters of oleic acid by response surface methodology[J].Food Chemistry,2007,102(1):336-342
[17]Zheng M M,Dong L,Lu Y,et al.Immobilization of candida rugosa lipase on magnetic poly(allyl glycidyl ether-coethylene glycol dimethacrylate)polymer microsphere for synthesis of phytosterol esters of unsaturated fatty acid[J].Journal of Molecular Catalysis B:Enzymatic,2012,74(1-2):16-23
[18]King JW,Snyder JM,Frykman H,et al.Sterol ester production using lipase-catalyzed reaction in supercritical carbon dioxide[J].European Food Research and Technology,2001,212(5):566-569
[19]王騰宇,胡立志,孫博,等.超臨界CO2狀態下生物酶法催化合成植物甾醇酯[J].食品科學,2010,31(22):293-296
[20]陳茂彬,黃琴,吳謀成.植物甾醇油酸酯產品的合成工藝研究[J].中國油脂,2005,30(6):63-65
[21]陳舒.植物甾醇酯微波加熱合成的研究[D].西安:西安理工大學,2007
[22]陳茂彬.植物甾醇酯的制備、生物活性及應用研究[D].武漢:華中農業大學,2005
[23]Deng Q C,Zhang P,Huang Q D,et al.Chemical synthesis of phytosterol esters of polyunsaturated fatty acids with ideal oxidative stability[J].European Journal of Lipid Science and Technology,2011,113(4):441-449
[24]董濤,賈承勝,張曉鳴.SDS催化合成植物甾醇月桂酸酯的研究[J].食品與機械,2008,24(3):44-47.
[25]董濤.植物甾醇酯的化學合成及其抗氧化性研究[D].無錫:江南大學,2008
[26]郭濤,姜元榮,王勇,等.植物甾醇酯制備方法的研究[J].中國油脂,2011,36(1):53-56
[27]Meng X H,Sun PL,Pan Q Y,et al.Synthesis of plant sterol esters catalyzed by heteropolyacid in a solvent-free system[J].European Journal of Lipid Science and Technology,2006,108(1):13-18
[28]王勇,姜元榮,郭濤,等.甾醇酯化反應中催化劑的研究[J].糧油加工,2011(7):30-32
[29]何則強,熊利芝,梁凱.PW12/SnO2催化合成 α-亞麻酸植物甾醇酯[J].中國油脂,2010,35(2):33-36
[30]陳靜,屈凌波,李亞平,等.植物甾醇酯的合成[J].應用化學2011,28(10增刊):168-169
[31]Xu ZJ,Wan H,Miao J.et al.Reusable and efficient polystyrene-supported acidic ionic liquid catalyst for esterifications[J].Journal of Molecular Catalysis A:Chemical,2010,332(1-2):152-157
[32]Zhang L,Xian M,He Y,et al.A bronsted acidic ionic liquid as an efficient and environmentally benign catalyst for biodiesel synthesis from free fatty acids and alcohols[J].Bioresource Technology,2009,100(19):4368-4373
[33]Joseph T,Sahoo S,Halligudi SB.Br?nsted acidic ionic liquids:a green,efficient and reusable catalyst system and reaction medium for Fischer esterification[J].Journal of Molecular Catalysis A:Chemical,2005,234(1-2):107-110
[34]楊謙,余曉姣,姚秉華.吡咯烷酮酸性離子液體催化制備甾醇煙酸酯[J].西北農業學報,2010,19(3):109-113
[35]楊葉波,何文森,賈承勝,等.離子液體催化合成亞油酸植物甾醇酯[J].中國油脂,2011,36(12):28-32
[36]張品,鄧乾春,黃慶德,等.無溶劑直接酯化法合成α-亞麻酸植物甾醇酯工藝研究[J].中國糧油學報,2010,25(1):55-59
[37]Roden A,Williams J L,Bruce R,et al.Preparation of sterol and stanol-esters:US,6410758[P].2002-06-25
[38]陳茂彬,李萬芬,吳謀成.植物甾醇乙酸酯的合成研究[J].化學與生物工程,2003(5):33-34
[39]陳茂彬,黃琴.植物甾醇煙酸酯研究與開發[J].糧食與油脂,2004(12):7-9
[40]Tatu M,Hannu V,Ingmar W.Use of a stanol fatty acid ester for reducing serum cholesterol level:US,5502045[P],1996
[41]Barrault J,Boisseau M,Pouilloux Y,et al.Method for preparing a fatty substance ester and use thereof in pharmaceutics,cosmetics or food industry:US,6828451[P].2004-12-07
[42]van Amerongen M P,Lievense L C.Process for the production of stanol esters,and use thereof:US,6106886[P].2000-08-22
[43]Flickinger B D,Grabiel R,Poppe G.Methods for producing ester-rich composition:US:20020107232,[P].2002-08-08
[44]Burdiek D C,Mone G,Raederstorff D.Phytosterol and/or phytostanol derivatives:US,20020055493[P].2002-05-09
[45]李春榮,王三永,謝志橋.植物甾醇共軛亞油酸的制備及其血脂調節作用的研究[J].中國食品添加劑,2007(3):69-72
[46]姜媛媛,董曉麗,吳文忠.植物甾醇酯的制取與分析[J].大連工業大學學報,2010,29(1):8-10
[47]夏輝,史宣明,魯海龍,醇酯交換法合成甾醇酯工藝研究[J].糧油食品科技,2011,19(1):26-28
[48]Milstein N,Biermann M,Leidl P.Processes for preparing sterol esters:US:6713466[P].2004-03-30
[49]張娟聰.植物甾醇的改性研究[D].杭州:浙江工業大學,2008
[50]楊葉波.離子液體催化合成植物甾醇酯及其分離工藝研究[D].無錫:江南大學,2012.
Progress in the Chemical Synthesis,Separation and Purification of Phytosterol Esters
Xu Qingqing1,2Jin Wenbin1Su Baogen1Yang Yiwen1Ren Qilong1
(Key Laboratory of Biomass Chemical Engineering of Ministry of Education,Zhejiang University1,Hangzhou 310027)
(College of Chemical and Material Engineering,Quzhou University2,Quzhou 324000)
Phytosterols have a ability of reducing serum cholesterol with unique anti-inflammatory,antipyretic and anticancer activities,etc.However,they have some drawbacks such as insoluble in water,which has pretty limited the fat-soluble.Phytosterol esters can greatly improve the fat-soluble and inhibiting cholesterol absorption properties.As a result,synthesis of phytosterol esters is becoming a research hotspot by mass of countries.At present,the preparation of phytosterol esters has been reported mainly in aspects as chemical synthesis,catalysis of lipase,and biological enzyme catalysis in supercritical fluid.The latter two methods both use the enzymes as catalysts;their industrial application is limited because of the high production cost and low productivity of enzymes.Chemical synthesis is still the main method to conduct large-scale commercial production and research focus of phytosterol esters.The progress of chemical synthesis,separation and purification of phytosterol esters in recent years is reviewed in the article.
phytosterols,phytosterol esters,chemical synthesis,separation and purification,progress
O621.25+6.4;O6-332
A
1003-0174(2014)03-0120-09
國家自然科學基金(20936005),“十二五”國家科技支撐計劃(2011BAD23B03)
2013-05-16
許青青,女,1969年出生,副教授,化學合成與分離
楊亦文,男,1963年出生,教授,天然產物提取分離與結構修飾

