熒光聚合酶鏈式反應檢測白粿干模擬轉基因樣品前處理優化
張 冰,王志純,邵碧英,繆婷玉,彭 娟,陳文炳,*
(1.福建出入境檢驗檢疫局檢驗檢疫技術中心,福建 福州 350003;2.廈門塔斯曼生物工程公司,福建 廈門 361023;3.福建省種子總站,福建 福州 350003)
熒光聚合酶鏈式反應檢測白粿干模擬轉基因樣品前處理優化
張 冰1,2,王志純3,邵碧英1,繆婷玉1,彭 娟1,陳文炳1,*
(1.福建出入境檢驗檢疫局檢驗檢疫技術中心,福建 福州 350003;2.廈門塔斯曼生物工程公司,福建 廈門 361023;3.福建省種子總站,福建 福州 350003)
為提高米制品中轉基因成分實時熒光聚合酶鏈式反應檢測的靈敏度與檢出率,應用模擬轉基因白粿干樣品,對影響檢測結果的主要因素,包括樣品顆粒細度、DNA提取過程中樣品在十六烷基三甲基溴化銨裂解緩沖液中溫育時間等因素進行優化。結果表明:提取的DNA量在樣品顆粒細度與十六烷基三甲基溴化銨緩沖液溫育時間的9種處理組合間都有極顯著差異,其中最優條件為樣品顆粒細度>100目、十六烷基三甲基溴化銨緩沖液溫育時間>8 h(過夜)。采用最優前處理組合,樣品的主要轉基因成分檢出限從公認的轉基因含量0.01%(m/m)降到0.001%(m/m),檢測靈敏度提高10倍,有效提高了米制品轉基因成分檢測結果的準確性。
米制品(白粿干);轉基因成分;實時熒光聚合酶鏈反應;檢出限
DNA的聚合酶鏈式反應(polymerase chain reaction,PCR)是目前常用的基因標記方法之一,該方法能穩定、精確地擴增(復制)具有物種特異性的DNA片段,作為物種的DNA分子標記,已被廣泛應用于物種鑒定、檢驗檢疫與轉基因產品的檢測[1-6]等領域。實時熒光PCR方法在普通PCR的基礎上,增加了靶基因的探針,使用熒光信號判別檢測結果,使得該方法的特異性與靈敏度大幅度提高,已經廣泛應用于稻米及其制品的轉基因成分檢測[7-11]。
隨著轉基因技術的不斷發展,被推廣應用的轉基因生物種類越來越多,2012年全球有28個國家種植了1.7億hm2的轉基因農作物,比2011年增長6%,是1996年的100倍。據估計,2012年全球轉基因農作物種子創造的價值達到150億美元,主要有轉基因玉米、大豆、棉花、菜籽及甜菜等[12]。由于轉基因產品對人類、動物的健康,生態環境等存在不確定性與潛在風險,許多國家都制定了標識管理等法規[13-14]對轉基因產品嚴加監控。歐盟、日本等對我國出口食品的轉基因成分檢出是零容忍,2006年9月以來,已有法國、德國、意大利、奧地利和日本等國家因為檢出轉基因大米成分,對我國出口米制品采取了拒絕入境、撤架、召回等措施,并遭到歐盟食品飼料快速預警系統通報,并就我國輸歐盟米制品中的轉基因大米成分出臺緊急措施[15-17],對我國米制品實施更加嚴苛的入境檢查。若原料大米因鄰近田塊轉基因水稻的串粉而遭受污染,其米制品中的轉基因含量甚微[18-19],實驗室樣品制備與DNA提取等前處理稍有不當,就會嚴重影響檢測結果的準確性。對轉基因大豆、玉米、油菜等產品的PCR檢測,有關標準[20-22]都規定需將樣品粉碎至0.5 mm左右;在SN/T 1194—2003《植物及其產品轉基因成分檢測抽樣與制樣方法》、SN/T 2584—2010《水稻及其產品中轉基因成分實時熒光PCR檢測方法》中[23-24],對實驗室樣品處理只有籠統的表述,特別是大米及米制品樣品處理的具體粉碎細度,迄今為止未見確切的報道。
樣品的制作以及DNA提取等前處理措施,是PCR檢測結果準確與否的重要前提。因此,為降低檢測方法的檢出限、提高檢出率、保證檢測結果的準確性、建立規范的技術操作程序,本研究對影響米制品中轉基因成分檢測結果準確性的主要前處理因素進行分析,采用經過研磨、高溫、高壓加工處理、轉基因檢測難度較大的米制品白粿干(也稱年糕片)為樣品,通過添加轉基因大米科豐6號粉末,配制成模擬轉基因樣品,對樣品研磨細度、DNA提取過程中的十六烷基三甲基溴化銨(hexadecyltrimethylammonium bromide,CTAB)裂解緩沖液溫育時間等前處理方法進行分析與優化,以期有效提高米制品轉基因成分實時熒光PCR檢測結果的準確性,為建立精準轉基因檢測方法提供科學依據。
1 材料與方法
1.1 材料與試劑
非轉基因米制品白粿干(片狀)為福建省閩侯佳惠食品有限公司送檢實驗室留樣;轉基因大米科豐6號樣品(轉基因大米含量為100%)由福建省農業科學院提供。
三羥甲基氨基甲烷-乙二胺四乙酸(Tris-EDTA,TE)緩沖液(pH 8.0)、超純水、蛋白酶K、RNA分解酶 上海生工生物工程有限公司;Premix Ex Taq(2×)(Probe qPCR)試劑盒、大米內源基因(GOS)與外源基因(CaMV35S、NOS、Cry1Ab/c)擴增用的引物與探針[23]大連寶生物科技公司(序列見表1);CTAB(分析純) 廣東光華化學廠有限公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA,分析純) 上海天蓮精細化工有限公司;Tris-Cl、氯仿、異戊醇、異丙醇、無水乙醇(均為分析純) 國藥集團化學試劑有限公司。
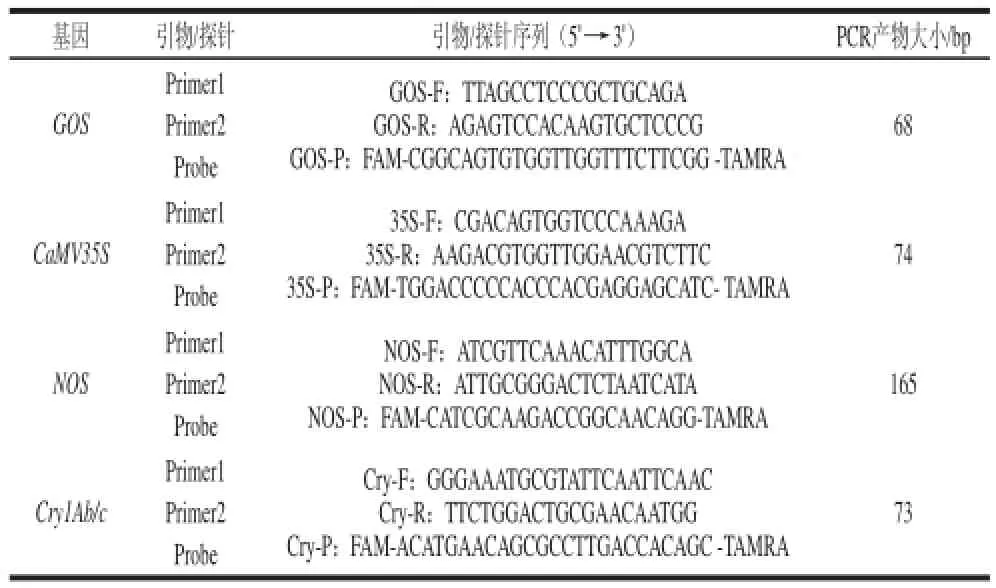
表1 熒光定量PCR引物/探針序列Table1 Primer/probe sequences used in fluorescence PCR
1.2 儀器與設備
高速萬能粉碎機 天津泰斯特儀器公司;圓振篩(分析篩,內徑200 mm,高度50 mm) 德國Retsch公司;CR22GII高速冷凍離心機 日本日立公司;移液器、Minispin臺式離心機 德國Eppendorf公司;WB14溫控搖床 德國Memmert公司;Ultrospec 1100 pro核酸蛋白分析儀 德國Amersham公司;PCR工作臺 美國Labconco公司;ABI 7500實時熒光定量PCR儀 美國Applied Biosystems公司。
1.3 方法
1.3.1 模擬轉基因白粿干樣品制備
每個樣品均勻分為4份,稱取200 g烘干研磨。非轉基因白粿干樣品研磨成粉末,分別過50目(濾過顆粒小于270 μm)與100目(濾過顆粒小于150 μm)圓振篩,制成顆粒細度<50目、50~100目、>100目3個范圍的樣品。科豐6號轉基因大米樣品粉末過篩方法同上。
非轉基因白粿干樣品粉末分別與顆粒細度相同的轉基因大米樣品按照不同質量分數進行配制。稱取相同顆粒細度的非轉基因白粿干樣品粉末99.99 g與轉基因大米樣品0.01 g充分混勻,制成0.01%(m/m)的模擬轉基因白粿干樣品。以同樣的方法制作0.001%(m/m)的模擬轉基因白粿干樣品。
1.3.2 模擬轉基因白粿干樣品DNA提取
采用CTAB法[8]提取DNA,稱取1 g樣品粉末于50 mL離心管中,加入5 mL 20 g/L的CTAB裂解緩沖液,于65 ℃恒溫搖床中振蕩溫育(1、4、>8 h(過夜)),其他步驟按文獻[8]進行,最后將獲得的DNA溶于300 ?L的0.1×TE緩沖液(pH 8.0)中,充分渦旋后,測定DNA溶液的OD260nm/OD280nm值與質量濃度/(ng/μL)。每份樣品重復提取2份DNA。
1.3.3 熒光PCR溫度循環與閾值設定
實時熒光PCR反應溫度循環程序為:95℃,10 min;95 ℃,35 s;60 ℃,60 s;45個循環。閾值設定原則[25]根據儀器噪聲情況進行調整,以閾值線剛好超過正常陰性樣品擴增曲線的最高點為準。
1.3.4 熒光PCR反應體系
熒光PCR單管反應體積為20 ?L,引物與探針等試劑加樣量如表2所示。

表2 熒光PCR反應體系Table2 Fluorescence PCR reaction systems
1.3.5 樣品前處理對熒光PCR檢測的影響
供試白粿干模擬樣品的轉基因大米質量分數為0.01%,按照1.3.1節與1.3.2節設置的3種顆粒細度與3種CTAB溫育時間,共9種處理方法,各提取2份DNA,每份DNA做2個熒光PCR反應,即每個樣本做4個PCR反應;共檢測4個基因,包括大米內源基因(GOS)與3個外源基因(CaMV35S、NOS、Cry1Ab/c);總共進行144管PCR反應,每次(96孔板)實驗都設置陽性對照、非轉基因大米陰性對照與雙蒸水(ddH2O)空白對照各1個,對照不正常時實驗數據認為無效。
1.3.6 轉基因模擬樣品檢出率
CTAB溫育時間同為>8 h(過夜)的情況下,對3種不同顆粒細度轉基因大米質量分數為0.001%的白粿干模擬轉基因樣品,各提取24份DNA,每份DNA做2個PCR反應,共48個PCR重復,進行3個外源基因CaMV35S、NOS、Cry1Ab/c的檢出率測試。
1.4 數據統計分析
采用Microsoft Office Excel 2003進行數據分析,對不同處理條件下樣品DNA質量濃度與內源和外源基因的實時熒光PCR檢測結果(Ct值)的差異顯著性進行方差分析,并估算邊際均值圖。
2 結果與分析
2.1 樣品顆粒細度及CTAB溫育時間對DNA提取效果的影響
轉基因大米質量分數為0.01%的白粿干樣品DNA溶液的質量濃度平均值如表3所示。各個組合樣品的DNA溶液OD260nm/OD280nm值都在1.7~1.9范圍內,符合PCR檢測要求。
由表3可知,在相同的顆粒細度下,提取的DNA質量濃度均隨著DNA提取過程中CTAB溫育時間的延長而提高,溫育時間>8 h(過夜)條件下提取的DNA質量濃度較其他2個溫育時間處理高;在溫育時間相同情況下,DNA質量濃度隨樣品顆粒細度目數的增加而增高,顆粒大小>100目的樣品中提取的DNA質量濃度比其余2種顆粒細度要高;CTAB溫育時間>8 h(過夜)、顆粒大小>100目的樣品提取的DNA質量濃度在9種處理組合中為最高。
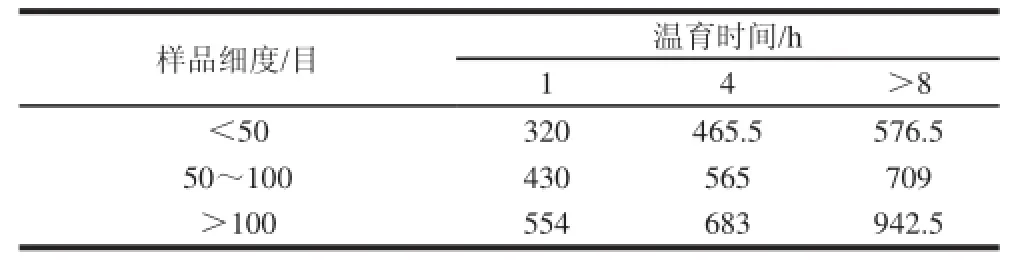
表 33 白粿干模擬轉基因樣品提取的DNA平均質量濃度Table3 DNA average concentrations in simulated transgenic rice cake samples ng/μL
無重復雙因素方差分析結果表明:樣品顆粒細度與CTAB溫育時間對樣品DNA提取質量濃度的影響均達到極顯著水平(F行=30.27,F列=38.50,F0.01=18.00,P<0.01)。
2.2 前處理對熒光PCR檢測的影響
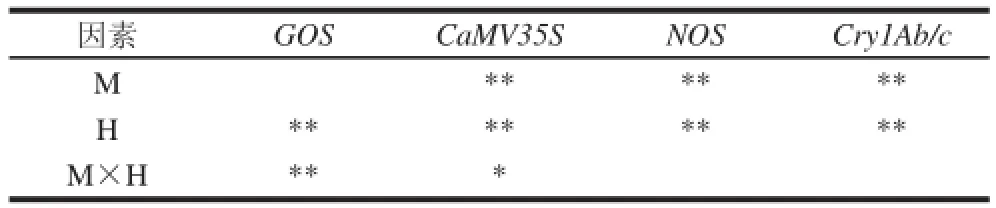
表4 前處理對白粿干模擬轉基因樣品4個基因Ct值的影響顯著性F檢驗Tabllee 44 F test of significant effect of pretreatment on Ct values of 4 genes in simulated transgenic rice cake samples
內源基因GOS和外源基因CaMV35S、NOS、Cry1Ab/c熒光PCR測得的Ct值的F檢驗結果如表4所示,樣品在CTAB裂解緩沖液中的溫育時間對內源基因GOS和3個外源基因熒光PCR檢測結果都有極顯著影響;樣品顆粒細度(目數)因素對3個外源基因熒光PCR檢測結果都有極顯著的影響;兩因素間的交互作用對內源基因GOS的檢測結果有極顯著影響,對CaMV35S有顯著影響,對NOS、Cry1Ab/c基因影響均不顯著。3個外源基因檢測結果的估算邊際均值如圖1所示。
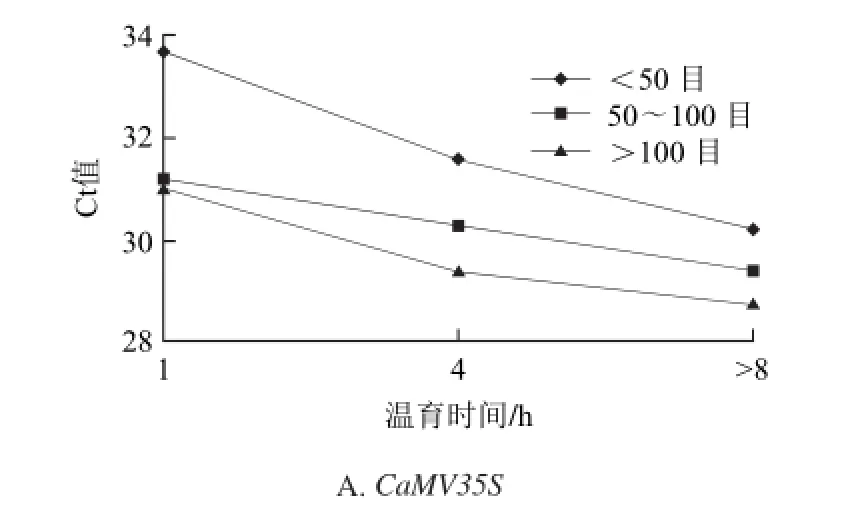
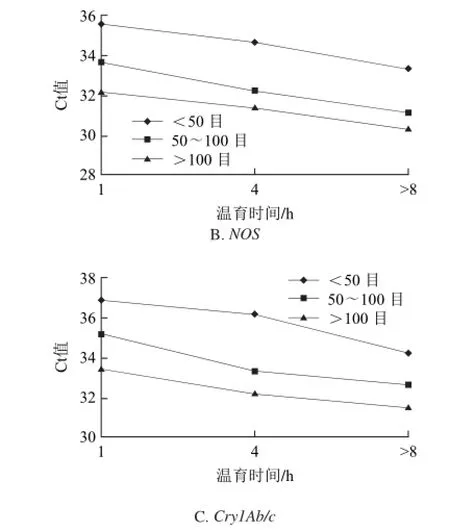
圖1 3個基因的估算邊際均值圖Fig.1 Estimated marginal average Ct values of three genes
結果表明:樣品顆粒細度>100目、CTAB溫育時間>8 h的前處理條件下,Ct值均為最小。因此選擇可見樣品顆粒細度>100目和溫育時間>8 h(過夜)為前處理最佳組合。
2.3 樣品顆粒細度對白粿干低含量轉基因成分檢出率的影響
CTAB緩沖液溫育同為>8 h(過夜)的條件下,3個外源基因CaMV35S、NOS、Cry1Ab/c的檢出率見表5、熒光PCR曲線見圖2。樣品顆粒細度<50目時,CaMV35S、NOS、Cry1Ab/c的檢出率分別為66.67%、70.83%、64.42%;樣品顆粒細度在50~100目時,3個基因檢出率均為87.50%;樣品顆粒細度>100目時,CaMV35S基因檢出率為97.92%,其他2個基因檢出率均為100%。顆粒細度>100目的樣品轉基因成分PCR檢測的Ct值平均數(n=48)都在陽性結果判斷值(36)以下(表6),說明前處理中的研磨細度對檢出率有顯著影響,恰當的前處理措施可以使得檢出限,即檢出率穩定在95%以上的最低檢出含量[26],降低到0.001%,比常規熒光PCR檢出限(0.01%[10,27])降低10倍。

表5 樣品顆粒細度對白粿干模擬樣品轉基因成分檢出率的影響Table5 Effect of sample particle size on detection efficiency of transgenic components in simulated rice cake sample%

表6 經最優前處理后的白粿干模擬樣品轉基因成分CCtt平均值Table6 Average Ct values of transgenic components in simulated rice cake samples after the optimum pre-treatment
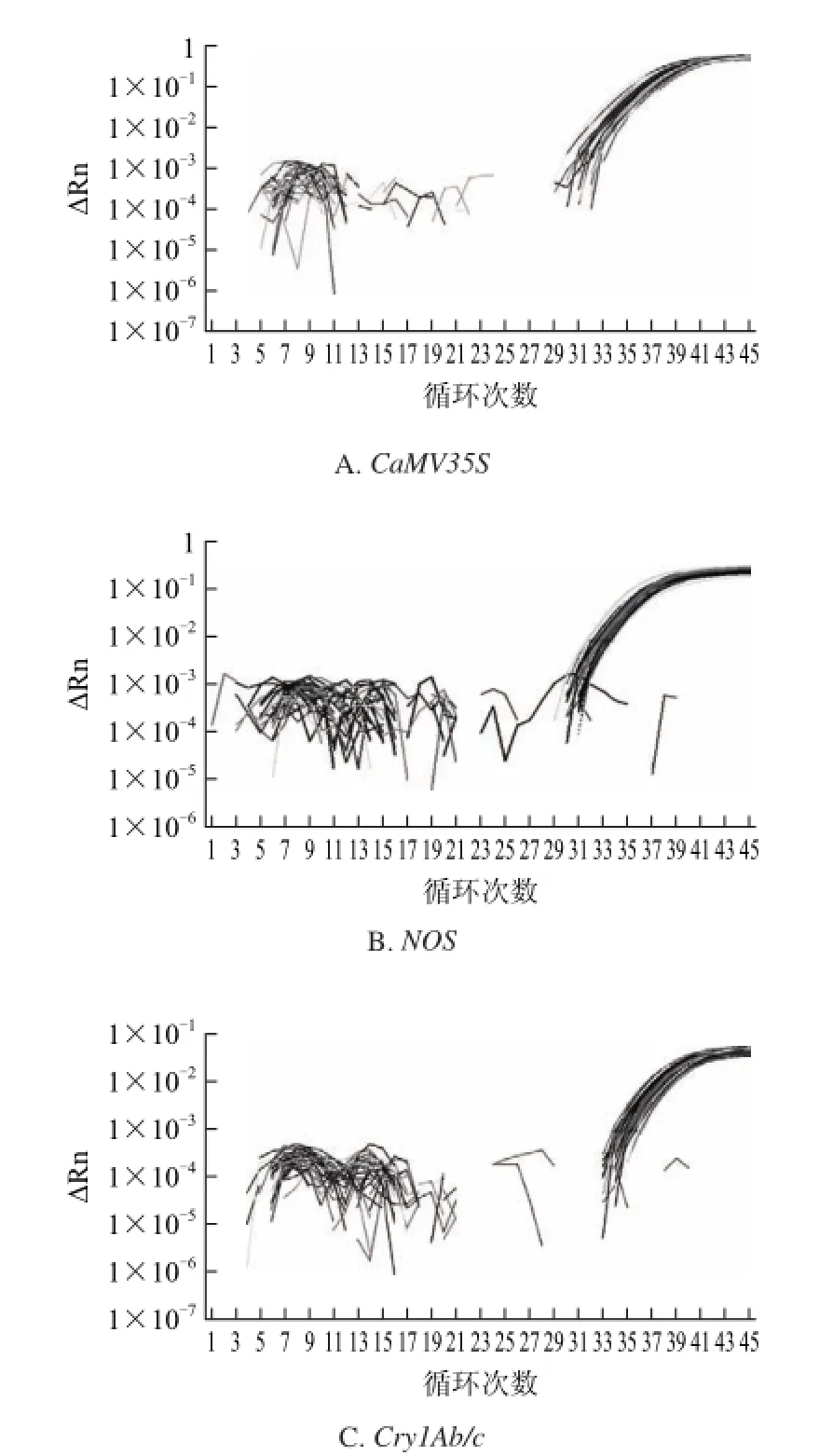
圖2 經最優前處理后的白粿干模擬樣品3個轉基因成分實時熒光PCR曲線圖Fig.2 Fluorescence PCR curves of three genes in simulated transgenic rice cake samples after the optimum pre-treatment
3 結 論
結果表明:樣品顆粒細度與CTAB溫育時間對DNA濃度產生的影響均達到極顯著水準。顆粒細度>100目、CTAB溫育時間>8 h(過夜)的條件下,DNA提取效果最佳、濃度最高。CTAB緩沖液溫育時間對內源基因GOS和3個外源基因熒光PCR檢測結果都有極顯著影響;樣品顆粒細度對3個外源基因熒光PCR檢測結果都有極顯著影響;兩因素間的交互作用僅對GOS有極顯著影響,對CaMV35S有顯著影響,而對NOS、Cry1Ab/c基因影響均不顯著。3個外源基因檢測結果的估算邊際均值表明:樣品顆粒細度>100目和溫育時間>8 h(過夜)為前處理最佳組合。在CTAB溫育時間>8 h(過夜)、樣品顆粒細度目數>100目時,轉基因大米質量分數為0.001%的模擬白粿干轉基因樣品的3個外源基因(CaMV35S、NOS、Cry1Ab/c)檢出率均在97%以上,而且熒光PCR檢測結果Ct平均值都在陽性結果判斷值以下。
當置信水平為95%時,樣品測定值與零濃度樣品(不含待測成分)的測定值有顯著性差異即為檢出限,實驗要求重復20次以上[26]。本研究對添加科豐6號轉基因大米質量分數為0.001%的白粿干模擬轉基因樣品進行3種不同顆粒細度的處理,各重復提取24份DNA,每份DNA做2個PCR反應,共48個PCR重復,結果表明:優化的前處理條件與PCR反應體系能夠使熒光PCR方法的檢出限從0.01%(m/m)降低到0.001%(m/m),即檢測方法靈敏度提高10倍。本研究僅以經過研磨、高溫、高壓加工處理、轉基因檢測難度較大的白粿干模擬轉基因樣品進行方法優化探討,考察前處理條件對轉基因成分定性熒光PCR檢測結果的影響,為進一步研究使用轉基因大米制作的真正的“轉基因大米制品”提供依據與參考;采用更多的轉基因食品種類與基因種類作為研究對象,進行熒光PCR精準檢測方法的研究。
[1] 陳文炳, 王志明, 李壽崧, 等. 分子標記在動植物檢驗檢疫與GMO產品檢測中的應用[J]. 福建農林大學學報, 2004, 33(4): 494-500.
[2] 陳穎, 徐寶梁, 蘇寧, 等. 實時熒光定量PCR技術在轉基因玉米檢測中的應用研究[J]. 作物學報, 2004, 30(6): 602-607.
[3] 邵碧英, 陳文炳, 楊婕. 馬鈴薯及其制品中轉基因成分的多重PCR檢測[J]. 食品科學, 2006, 27(1): 178-181.
[4] 孫敏, 粟志平, 梁成珠, 等. 粉絲類產品中轉基因成分的檢測[J]. 食品科學, 2008, 29(6): 230-233.
[5] 陳文炳, 林少華, 邵碧英, 等. 河豚魚Cyt b基因部分DNA序列分析與應用[J]. 食品科學, 2012, 33(20): 227-232.
[6] 陳雙雅, 陳文炳, 張津, 等. 應用PCR-RFLP和芯片生物分析系統鑒別河豚魚品種[J]. 食品科學, 2012, 33(22): 200-202.
[7] MADE D, DEGNER C, GROHMANN L. Detection of genetically modified rice: a construct-specific real-time PCR method based on DNA sequence from transgenic Bt rice[J]. European Food Research Technology, 2006, 224(2): 217-278.
[8] REITING R, GROHMANN L, MADE D. A testing cascade for the detection of genetically modified rice by real-time PCR in food and its application for detection of an unauthorized rice line similar to KeFeng6[J]. Journal of Consumer Protection and Food Safety, 2012, 5(2): 185-188.
[9] 吳孝橫, 路勇. 利用實時熒光PCR方法檢測轉Bt基因大米[J]. 現代食品科技, 2009, 25(2): 211-216; 220.
[10] 吳志毅, 張明哲, 陳曦. 大米和米制品Bt 63轉基因檢測PCR方法的靈敏度研究[J]. 浙江農業學報, 2009, 21(6): 549-554.
[11] 魏霜, 陳貞, 蘆春斌, 等. 多重PCR檢測轉基因水稻的轉基因成分[J].食品科學, 2012, 33(12): 159-162.
[12] CLIVE J. 2012年全球生物技術/轉基因作物商業化發展態勢[J]. 中國生物工程雜志, 2013, 33(2): 1-8.
[13] KAEPPLER H F. Food safety assessment of genetically modified crops[J]. Agronomy Journal, 2000, 92(4): 793-797.
[14] NICKSON T E. Planning environmental risk assessment for genetically modified crops: problem formulation for stress-tolerant crops[J]. Plant Physiology, 2008, 147(2): 494-502.
[15] European Community. 2008/289/EC: Commission decision of 3 April 2008 on emergency measures regarding the unauthorized genetically modifi ed organism ‘Bt 63’ in rice products[J]. Offi cial Journal of the European Union, 2008, L096: 29-34.
[16] European Community. Commission Implementing Decision of 22 December 2011 on emergency measures regarding unauthorised genetically modified rice in rice products originating from China and repealing Decision 2008/289/EC[J]. Official Journal of the European Union, 2011, L343: 140-148.
[17] European Commission, Health and Consumers Directorate-General, Veterinary and International Affairs. Minutes of the expert group on veterinary cheeks-3 July 2013 (9. Miscellaneous/e) Decision 2013/287/ EU on GM rice from China)(C/OL). Brussels: European Commission, (2013-09-09)[2013-12-16]. http://europa.e U/geninfo/query/resultaction.jsp?SMODE=2&ResultC ount=10&Collection=EuropaFull&Collection=EuropaSL&Collection= EuropaPR&ResultMaxDocs=200&qtype=simple&DefaultLG=en&Re sultTemplate=%2Fresult_en.jsp&page=1&QueryText=2013%2F287% 2FEU&y=17&x=20#queryText=2013%2F287%2FEU&tab=europa&p age=2&filterOn=0.
[18] 戎俊, 宋志平, 蘇軍, 等. Bt/CpTI轉基因稻及其非轉基因親本對照在間隔種植條件下的轉基因漂移[J]. 生物多樣性, 2006, 14(4): 309-314.
[19] 陸永良, 彭于發, 王渭霞, 等. 抗除草劑轉基因水稻基因漂移至常規栽培稻的頻率研究初報[J]. 中國水稻科學, 2010, 24(6): 663-666.
[20] 蔣原, 祝長清, 林宏. SN/T 1195—2003 大豆中轉基因成分的定性PCR檢測方法[S]. 北京: 中國標準出版社, 2003.
[21] 曹際娟, 陳明生, 盧行安, 等. SN/T 1196—2003 玉米中轉基因成分的定性PCR檢測方法[S]. 北京: 中國標準出版社, 2003.
[22] 潘良文, 沈禹飛, 陳家華, 等. SN/T 1197—2003 油菜籽中轉基因成分的定性PCR檢測方法[S]. 北京: 中國標準出版社, 2003.
[23] 陳紅運, 黃文勝, 朱水芳, 等. SN/T 1194—2003 植物及其產品轉基因成分檢測抽樣與制樣方法[S]. 北京: 中國標準出版社, 2003.
[24] 陳紅運, 梁新苗, 陳雙雅, 等. SN/T 2584—2010 水稻及其產品中轉基因成分實時熒光PCR檢測方法[S]. 北京: 中國標準出版社, 2010.
[25] 蔣春燕, 王泰健, 王琴, 等. 實時熒光定量PCR技術[J]. 動物醫學進展, 2005, 26(12): 97-101.
[26] 孫明. 檢出限的分類與計算方法[J]. 現代農業, 2012(3): 33-34.
[27] 黃新, 張琰, 侯立華, 等. 轉基因水稻‘科豐6號’實時熒光PCR定性定量檢測方法研究[J]. 生物技術通報, 2010(2): 90-93.
Pretreatment Optimization of Simulated Rice Cake Samples for Fluorescence Polymerase Chain Reaction to Detect Transgenic Components
ZHANG Bing1,2, WANG Zhi-chun3, SHAO Bi-ying1, MIAO Ting-yu1, PENG Juan1, CHEN Wen-bing1,*
(1. Inspection and Quarantine Techonology Center, Fujian Entry-Exit Inspection and Quarantine Bureau, Fuzhou 350003, China; 2. Xiamen Tasman Bio-Tech Co. Ltd., Xiamen 361023, China; 3. Fujian Provincial Seed Station, Fuzhou 350003, China)
In order to improve the sensitivity and detection limits of transgenic components in rice products, pretreatment conditions for DNA extraction including sample particle size and hexadecyltrimethylammonium bromide (CTAB) lysis buffer were optimized using simulated transgenic rice cake samples. The results showed that the content of DNA had significant differences among 9 treatment combinations of sample particle size and CTAB lysis buffer incubation time. The content of DNA extracted by the combination of sample particle size larger than 100 mesh and CTAB lysis buffer incubation time longer than 8 h (overnight) was the highest. The detection limit of major transgenic components in rice cake samples was reduced from transgenic content of 0.01% (m/m) to 0.001% (m/m), suggesting that the sensitivity of fluorescence polymerase chain reaction (PCR) was improved by 10 times using the optimal pretreatment. The detection accuracy of genetically modified components in rice products was effectively improved as well.
rice products (rice cake); genetically modified ingredients; fluorescence real time-polymerase chain reaction (RT-PCR); limit of detection
TS213.3
A
1002-6630(2014)02-0243-05
10.7506/spkx1002-6630-201402047
2013-07-23
福建出入境檢驗檢疫局科技計劃項目(FK2010-28;FK2013-02)
張冰(1988—),女,助理工程師,碩士,研究方向為食品生物技術。E-mail:1273495290@qq.com
*通信作者:陳文炳(1962—),男,研究員,博士,研究方向為農產品、食品分子生物學檢測技術。E-mail:621213wbc@163.com

