超臨界CO2萃取靈芝孢子油及其揮發性成分分析
高宇杰,趙立艷,安辛欣,楊文建,方 勇,馬 寧,胡秋輝,★
(1.南京財經大學食品科學與工程學院,江蘇 南京 210023;2.南京農業大學食品科技學院,江蘇 南京 210095)
靈芝孢子(Ganoderma lucidumspore) 是我國著名藥用真菌靈芝的有性生殖細胞,靈芝孢子及其提取物具有免疫調節、抗腫瘤、抗氧化、抗衰老、保護神經系統、降血脂、護肝等功能,近年來因其具有比靈芝更強的藥理活性而成為國內外學者研究和開發的熱點[1-2]。破壁靈芝孢子粉含油量達20%~30%,從中提取的脂質成分即為靈芝孢子油,集中了孢子粉中三萜類化合物、不飽和脂肪酸、甾醇、維生素、揮發油等活性成分;其中不飽和脂肪酸含量大于60%[3],以油酸、亞油酸為主并含有多種奇數碳脂肪酸[4],三萜類化合物藥理活性強[5],也是靈芝孢子油中的主要活性成分。植物中揮發性物質不僅決定了其特征性氣味,部分揮發性成分還具有一定的保健功能,陳體強等[6]將靈芝孢子油不經衍生化直接通過氣相色譜-質譜(gas chromatography-mass spectrometry,GCMS)分析,發現靈芝孢子油中含有萜類等揮發性成分,但未報道相對含量。隨著人工栽培靈芝技術的日趨成熟,我國靈芝孢子粉的產量逐年增加,已成為全球最大的靈芝孢子粉產地[7],因此研究孢子粉中油脂的提取工藝及其揮發性物質組成具有重要的理論和實際意義。
超臨界CO2萃取技術具有操作溫度較低有效保護熱敏的活性物質,操作簡單萃取效率高,能耗低對環境無污染等優點,已被廣泛應用于油脂及三萜等功能性成分的制備[8-9]。Khattab等[10]比較了不同萃取方法對亞麻籽油品質和油脂組成的影響,結果表明超臨界CO2萃取油脂得率顯著低于快速溶劑提取和傳統溶劑提取法,但亞麻籽油品質和化學組成上卻顯著好于其他方法,熔點和過氧化值較低,碘值、多不飽和脂肪酸和酚酸含量較高,木酚素僅在超臨界CO2萃取油脂中檢測到。前人多以靈芝孢子油脂得率為考察指標優化超臨界CO2萃取靈芝孢子油工藝條件,且優化出的萃取分離條件、油脂得率差異較大,如朱堅等[11]在14MPa、34℃、270min下獲得了較高的萃取率34.41%,毛方華等[12]通過響應面法優化得到工藝條件為:萃取壓力29MPa、萃取溫度35℃、萃取時間3.5h、CO2流量20L/h,最優條件下靈芝孢子油脂得率為26.13%,提取率達到99%。靈芝孢子油與其他功能油脂的主要區別是富含活性成分三萜類化合物,但關于萃取分離條件對靈芝孢子油中三萜類化合物得率的影響研究較少。
近年來國內外研究主要集中在靈芝子實體、菌絲體及其孢子活性成分定性定量[13]、藥理活性等方面,對靈芝相關產品揮發性物質關注較少。頂空固相微萃取(headspace solid-phase microextration,HS-SPME)結合氣相色譜-質譜(gas chromatography -mass spectrometry,GC-MS),是一種新型樣品采集方法,已廣泛應用于食品揮發性風味物質鑒定領域,具有樣品用量少、不使用有機溶劑、萃取效率高、操作簡單、選擇性強、重現性好等特點[14]。本研究采用超臨界CO2萃取靈芝孢子油,以油脂得率和三萜類化合物得率為考察指標,通過單因素、正交試驗優化超臨界CO2萃取靈芝孢子油的重要工藝參數,擬獲得三萜類化合物含量高、油脂得率較高的工藝條件;采用HS-SPME-GC-MS全面分析超臨界CO2萃取的靈芝孢子油中的揮發性物質組成,進一步探討靈芝孢子油中特征性揮發物質,為工業生產和進一步深入研究提供理論依據。
1 材料與方法
1.1 材料與試劑
破壁赤芝孢子粉(真空包裝,破壁率>85%) 四川省農科院土壤肥料研究所;CO2(食品級,純度>99%)江蘇南通華安超臨界萃取有限公司;乙酸乙酯、冰乙酸、石油醚(沸程:30~60℃)、濃硫酸、高氯酸均為分析純 南京化學試劑有限公司;香草醛、熊果酸標準品(純度98%) 阿拉丁試劑(上海)有限公司。
1.2 儀器與設備
HA121-50-01超臨界萃取裝置 江蘇南通華安超臨界萃取有限公司;101-3AS電熱鼓風干燥箱 上海蘇進儀器設備廠;TE214S電子分析天平 賽多利斯科學儀器有限公司;7890A/5975C氣相色譜-質譜聯用儀 美國Agilent公司;固相微萃取手動進樣手柄、固相微萃取頭(50/30 μm DVB/CAR/PDMS)美國Supelco公司;20mL SPME頂空瓶 南京大滬科技儀器有限公司;HH-2數顯恒溫水浴鍋 常州國華電器有限公司;UV1100紫外-可見分光光度計上海美譜達儀器有限公司;硅膠G板(10cm×20cm×0.25 cm)青島海洋化工廠。
1.3 方法
1.3.1 超臨界CO2萃取靈芝孢子油工藝流程
破壁靈芝孢子粉(破壁后室溫下放置15d)45℃烘干12h后置于1L萃取釜中,設定儀器參數,循環萃取一定時間后收集分離釜Ⅰ、Ⅱ中油脂去雜質干燥后合并稱質量。
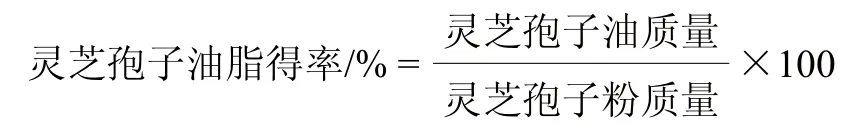
1.3.2 靈芝孢子油總三萜化合物含量測定
參照王江海等[15]的薄層色譜-光度法進行測定。
標準曲線的制作:精確稱量熊果酸對照品10.0mg置于100mL容量瓶中,乙酸乙酯超聲溶解10min,稀釋至刻度線,搖勻,制成0.1mg/mL的標準液。分別吸取0.00、0.20、0.40、0.60、0.80、1.00、1.20、1.40 mL對照品溶液于10mL試管中,于100℃水浴上蒸干后,加入新制0.40mL 5%香草醛-冰乙酸溶液和1.00mL高氯酸,搖均,在60℃水浴中加熱15min后移入冰水浴中冷卻3min,再加入5.00mL冰醋酸,搖勻并置于室溫。15min后用分光光度計于548nm波長下測定對照品溶液的吸光度。以熊果酸質量濃度為橫坐標、吸光度為縱坐標繪制標準曲線。
靈芝孢子油中三萜類化合物含量測定:稱取一定量樣品,溶于少量乙酸乙酯中,用微量取樣器吸取樣品溶液5μL在經過活化的硅膠板上點樣,以熊果酸標準品作參比,用石油醚-乙酸乙酯(95∶5,V/V)展開;展開后揮干溶劑,刮取遷移率值0~0.6部分,用乙酸乙酯提取,提取液置于10mL具塞試管;在100℃水浴上蒸干,加入新制0.40mL 5%香草醛-冰醋酸溶液和1.00mL高氯酸,搖均,在60℃水浴中加熱15min后移入冰水浴中冷卻3min,再加入5.00mL冰醋酸,搖勻并置于室溫。15min后用分光光度計于548nm波長下測定樣品溶液的吸光度,根據標準曲線計算靈芝孢子油中的三萜類化合物含量。
三萜類化合物得率/(g/kg)=靈芝孢子油脂得率/%×靈芝孢子油中三萜類化合物含量/(g/kg)
1.3.3 超臨界CO2萃取靈芝孢子油條件優化
單因素試驗:固定投料量100g、CO2流量20L/h、萃取時間2h、分離釜Ⅱ壓力、溫度和儲罐一致分別為4MPa、36℃,考察萃取壓力、萃取溫度、分離釜Ⅰ壓力、分離釜Ⅰ溫度對靈芝孢子油脂得率的影響。正交試驗:根據單因素研究的基礎上,以油脂得率和三萜類化合物得率為指標,進一步優化萃取和分離條件,確定最佳工藝組合并進行方差分析,在最優條件下進行靈芝孢子油萃取驗證實驗,重復3次取平均值。
1.3.4 頂空固相微萃取
在最優萃取條件下制備靈芝孢子油,萃取后立即進行揮發性成分測定;頂空固相微萃取參數根據本實驗前期研究結果進行。將固相微萃取萃取頭在氣質聯用儀的進樣口250℃老化30min,稱取2.0g靈芝孢子油置于20mL SPME頂空瓶中,蓋好瓶蓋,然后將頂空瓶放入70℃恒溫水浴裝置中,將老化好的萃取頭插入SPME樣品瓶,頂空萃取40min,然后將固相微萃取裝置插入GC-MS進樣口,推出萃取頭,于250℃解吸5min,啟動儀器進行GC-MS檢測。
1.3.5 GC-MS分析條件
GC條件:色譜柱:HP-5MS 5%苯基甲基氧化硅(30m×0.25mm,0.25μm)彈性石英毛細管色譜柱;升溫程序:進樣口溫度250℃,初始柱溫40℃,保持3min,以7℃/min升至120 ℃,保持3min,再以10℃/min升至230℃,保持5min;載氣為高純度氦氣(99.99%),流速1mL/min;不分流,進樣量1μL。
MS條件:電子電離(electron ionization,EI)源;電子能量70eV;離子源溫度230℃;四極桿溫度150℃;傳輸線溫度280℃;全譜掃描,質量掃描范圍:m/z30~550。
1.3.6 化合物鑒定
采用計算機檢索各峰相應的質譜圖與NIST08.L、RTLPEST3.L標準質譜數據庫匹配,篩選匹配度大于80%化合物,結合人工解析和相關文獻報道鑒定化合物,成分定量分析采用峰面積歸一化法。
2 結果與分析
2.1 單因素試驗
2.1.1 萃取壓力對油脂得率的影響
設定萃取溫度40℃、分離釜Ⅰ壓力10MPa、分離釜Ⅰ溫度56℃,考察萃取壓力對油脂得率的影響,結果見圖1a。可以看出隨著萃取壓力增大靈芝孢子油脂得率增加,在35MPa時油脂得率最大。萃取壓力是影響超臨界流體萃取效果的重要參數,相同溫度條件下,超臨界流體的密度隨著壓力的增加而增大,進而提高了超臨界流體的溶解度;壓力的增加還會減少傳質阻力,有利于目標成分的萃取,但壓力增加到一定程度后,超臨界流體的可壓縮性小,油脂得率增加緩慢,同時考慮設備成本和安全因素(設備最大壓力35MPa),選擇30MPa進行進一步研究。
2.1.2 萃取溫度對油脂得率的影響
設定萃取壓力30MPa、分離釜Ⅰ壓力10MPa、分離釜Ⅰ溫度56℃,考察萃取溫度對油脂得率的影響,結果見圖1b。可以看出,45℃時靈芝孢子油脂得率最大,溫度低于45℃時,隨著萃取溫度的升高靈芝孢子油脂得率增加;溫度高于45℃時,靈芝孢子油脂得率隨著溫度升高而下降。溫度對超臨界流體密度的影響復雜,一方面,溫度升高提高了溶劑的揮發度和擴散系數,使超臨界流體的溶解度提高,萃取效果提高;另一方面,溫度升高使流體的密度下降,導致溶解能力下降,降低提取效果[16]。因此選擇45℃進行進一步研究。
2.1.3 分離釜Ⅰ壓力對油脂得率的影響
設定萃取壓力30MPa、萃取溫度45℃、分離釜Ⅰ溫度56℃,考察分離釜Ⅰ壓力對油脂得率的影響,結果見圖1c。可以看出分離釜Ⅰ壓力大于9MPa時油脂得率逐漸下降、9MPa時油脂得率最高;適當的分離釜Ⅰ壓力有利于油脂完全析出且與雜質有效分離,因此選擇分離釜Ⅰ壓力9MPa進行進一步研究。
2.1.4 分離釜Ⅰ溫度對油脂得率的影響
設定萃取壓力30MPa、萃取溫度45℃、分離釜Ⅰ壓力9MPa,考察分離釜Ⅰ溫度對油脂得率的影響,結果見圖1d。可以看出48℃時油脂得率最低,56℃時油脂得率最高,60℃時油脂得率下降;在9MPa較低壓力下溫度升高使CO2溶解度進一步下降,促進油脂析出,但溫度過高油脂中雜質含量增多影響油脂品質,因此選擇分離釜Ⅰ適宜溫度為56℃。
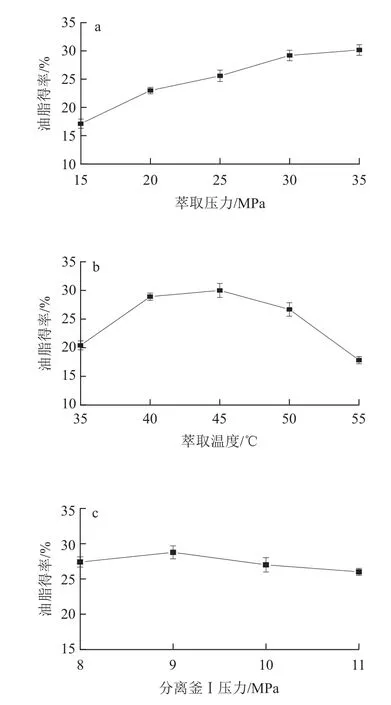
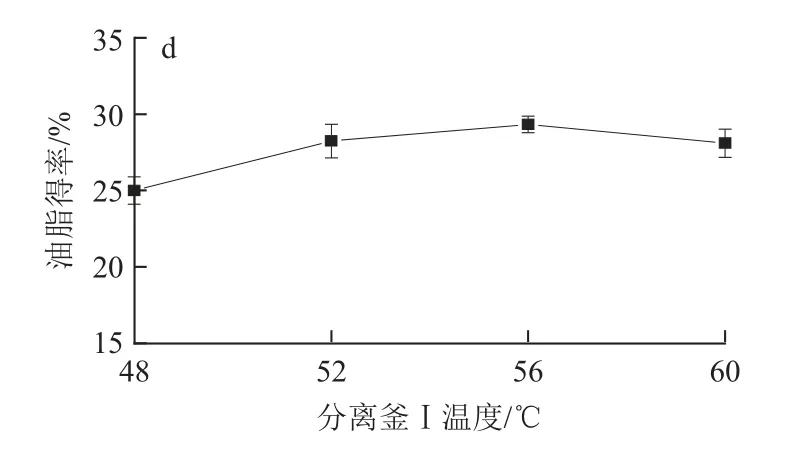
圖1 萃取壓力(a)、萃取溫度(b)、分離釜Ⅰ壓力(c)、分離釜Ⅰ溫度(d)分別對靈芝孢子油脂得率的影響Fig.1 Effects of extraction pressure (a), extraction temperatur e (b),separation Ⅰpressure (c) and separation Ⅰtemperature (d) on the oil yield from Ganoderma lucidum spore
2.2 正交試驗結果
根據單因素試驗結果,選取L9(34)正交表進行正交試驗,結果與分析見表1。由表1極差直觀分析,各因素對油脂得率和三萜類化合物得率影響程度均為萃取壓力>萃取溫度>分離釜Ⅰ溫度>分離釜Ⅰ壓力。以油脂得率為指標,綜合各因素k值得出A3B1C1D2為最佳工藝組合;以三萜類化合物得率為指標,最佳工藝組合為A2B1C1D2,二者僅萃取壓力不同,綜合考慮選擇A2B1C1D2組合,即萃取壓力30MPa、萃取溫度40℃、分離釜Ⅰ壓力8MPa、分離釜Ⅰ溫度56℃。A2B1C1D2組合未出現在正交表中,經驗證在最優組合條件下,靈芝孢子油的得率為29.45%,三萜類化合物得率為38.14 g/kg。
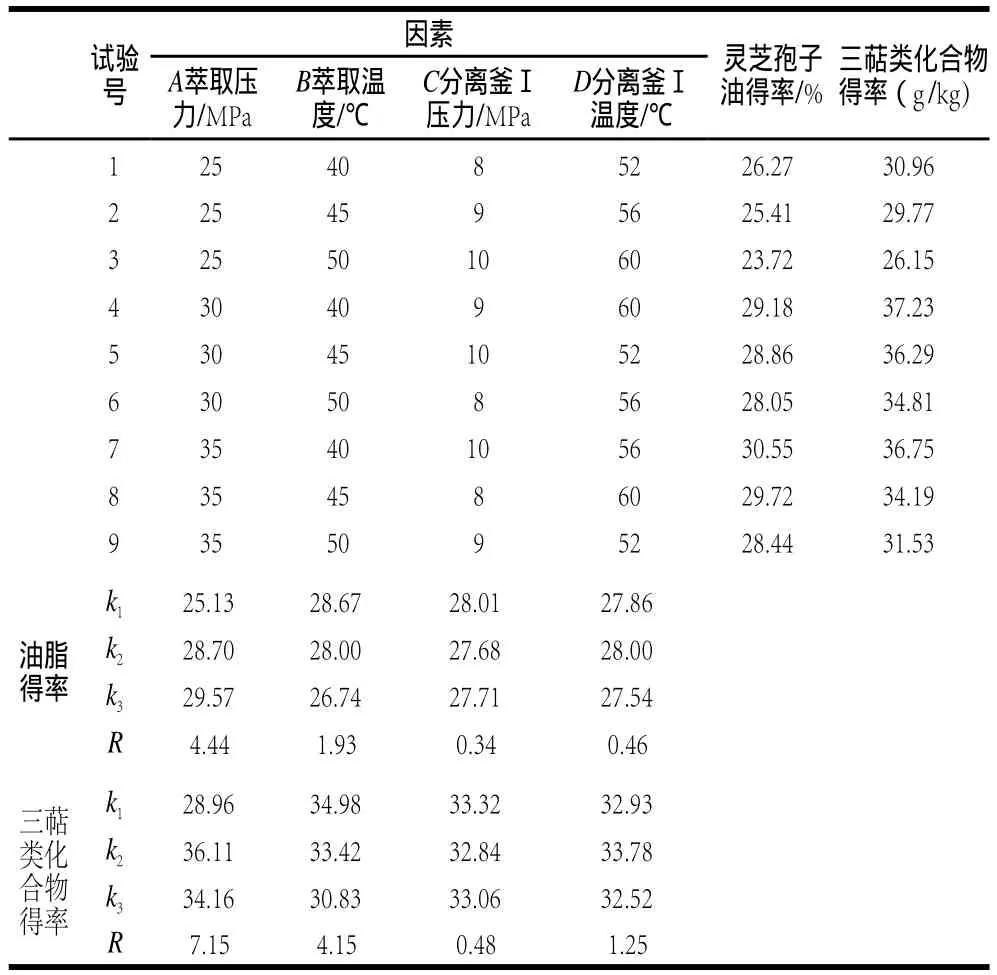
表1 LL9(34)正交試驗數據結果Table 1 Orthogonal array design matrix and experimental results
采用超臨界CO2萃取油脂得率常低于傳統溶劑法[10,17],超臨界CO2萃取法優點是提取效率高、油脂品質好。靈芝孢子油是珍貴的菌物油脂,靈芝三萜類化合物是除靈芝多糖外最主要的活性成分,超臨界狀態的CO2對被萃取物具有一定的選擇性,不同超臨界CO2萃取條件下得到的產物有一定的差異[18],由表1可見,三萜類化合物含量并未隨著油脂得率增加而增加,高壓下三萜類化合物得率有所下降。通過方差分析,以油脂得率和三萜類化合物為指標,萃取壓力、萃取溫度F比值均大于F臨界值(P≤0.05),表明萃取壓力、萃取溫度對結果影響顯著;分離釜Ⅰ壓力、溫度F比值均小于F臨界值(P≤0.05),表明分離釜Ⅰ壓力和溫度對結果影響較小,分離釜Ⅰ、Ⅱ壓力溫度不同,主要影響產物在兩萃取釜中的分配情況,分離釜Ⅰ壓力較高時,水、游離脂肪酸、雜質等主要在萃取釜Ⅱ中分離得到。
2.3 靈芝孢子油揮發性化合物組成及含量分析
經超臨界CO2萃取的靈芝孢子油色澤金黃、具有清香氣味,經HS-SPME-GC-MS分析,揮發性成分離子流圖見圖2(主要10種化合物峰號已標注),通過計算機檢索,扣除頂空瓶中不加樣品時出現的雜質峰,共檢出鑒定65種化合物,占總峰面積83.87%,定性定量結果見表2。由表2可見,靈芝孢子油中揮發性成分可分為7類物質,主要有烴類31種、醇類12種、醛類9種、酯類5種,此外還包括酚類、酮類各1種,雜環化合物2種,其他化合物4種。相對含量最高的為醇類,占總揮發性成分的38.36%,其次為烴類,占29.54%;其他依次為醛類占8.90%、酯類占2.76%,其他類化合物相對含量較低。
頂空固相微萃取在揮發性成分提取分析方面應用廣泛,謝婧等[19]采用水蒸氣蒸餾法、超臨界流體萃取法和頂空固相微萃取法萃取菜籽油揮發性風味成分,結果表明頂空固相微萃取在總峰個數、總峰面積和主峰面積方面均優于其他兩種方法。本研究所使用DVB/CAR/PDMS萃取頭對極性和非極性物質都具有一定的吸附能力,較田光輝等[20]研究相比,采用HS-SPME提取靈芝孢子油中的揮發性成分比靈芝和靈芝菌絲體揮發油成分復雜的多。其中1-甲基萘、苯乙醇、辛醛、壬醛、苯甲醛、苯甲酸乙酯、棕櫚酸乙酯7種物質在靈芝菌絲體揮發性物質中均被檢測到[21],但相對含量差異較大。
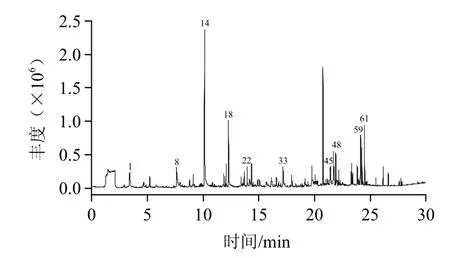
圖2 靈芝孢子油中揮發性化合物總離子流圖Fig.2 TIC profile of volatile compounds in Ganoderma lucidum spore oil

表2 靈芝孢子油中揮發性物質組成及相對含量Table 2 Composition of volatile compounds in Ganoderma luciidduumm spore oil and their relative contents
靈芝孢子油揮發性成分中烴類物質種類最多,烴類物質中又可分為烷類、萜烯、芳香烴類化合物等。烷類化合物閾值較高,一般認為對食品氣味貢獻較小。萜烯類化合物是植物揮發油重要組成成分,閾值低為呈香物質,常作為藥物和香料的成分,對靈芝孢子油氣味有一定貢獻。靈芝孢子油揮發性成分中分離出7種萜烯類化合物,占總峰面積6.64%,其中含量較高的為花側柏烯(2.17%)和β-花柏烯(1.97%),花側柏烯和β-花柏烯為倍半萜類化合物,在食用菌竹蓀[22]和五味子揮發油[23]中均檢測到,金針菇培養基中發現的花側柏烯[24]還具有一定的抑菌作用。芳香烴類化合物共分離10種,占總峰面積的10.43%,相對含量較高的為對二甲苯(2.85%)和萘(1.85%),對二甲苯具有水果甜香氣味,萘具有香樟木氣味也是亞麻籽油調和油風味物質重要組成成分[25]。
醇類是靈芝孢子油中相對含量最高的組分,靈芝菌絲體中主要揮發性物質也為醇類化合物[21],不飽和醇類閾值較低,對靈芝孢子油氣味有較大的貢獻,苯甲醇(16.35%)和苯乙醇(5.74%)含量最高,也是總揮發物中相對含量最高的物質,苯甲醇、苯乙醇表現柔和的花香氣味,是姬松茸子實體和菌絲體的主要揮發性風味物質[26]。其他相對含量較高的醇類依次為八氫-α,α,4α,-四甲基-2-萘甲醇(3.08%)、α-紅沒藥醇(3.32%)和肉桂醇(2.60%),α-紅沒藥醇香氣清淡愉快,具有廣譜的抗菌消炎作用[27],肉桂醇具有類似風信子香氣。
醛類是脂肪氧化產生的特征揮發性物質,閾值低對氣味貢獻大。靈芝孢子油揮發醛中苯甲醛含量最高(2.57%),辛醛、壬醛、癸醛等為脂肪的氧化分解產物,含量相對較低。苯甲醛具有苦杏仁味,在褐黃牛桿菌[28]、姬松茸[26]等食用菌中為主要呈香物質。辛醛、壬醛、癸醛具有清香、脂類風味;肉桂醛、香草醛、胡椒醛等都是重要的香料。靈芝孢子油揮發性成分中酯類化合物、酮類、酚類及其他化合物所占的比例相對較小,可能對靈芝孢子油氣味貢獻較小。
靈芝孢子油揮發性成分中烴類物質種類最多,烴類物質中又可分為烷類、萜烯、芳香烴類化合物等。烷類
3 結 論
超臨界CO2萃取靈芝孢子油的最佳工藝條件為萃取壓力30MPa、萃取溫度40℃、分離釜Ⅰ壓力8MPa、分離釜Ⅰ溫度56℃;此條件下靈芝孢子油得率為29.45%,三萜類化合物得率為38.14g/kg。萃取壓力和溫度對三萜類化合物得率影響顯著,分離釜Ⅰ壓力、溫度對萃取結果影響較小,不顯著。
HS-SPME-GC-MS對靈芝孢子油中揮發性成分分離效果較好,共鑒定65種化合物,主要為烴類、醇類、醛類和酯類化合物;其中醇類、萜烯、芳香烴和醛類化合物為主要氣味貢獻物質,協同構成了靈芝孢子油的氣味。苯甲醇、苯乙醇相對含量最高,分別為16.35%、5.74%,初步判斷為靈芝孢子油特征性揮發性化合物。
[1]胡瞬, 易有金, 熊興耀, 等. 靈芝孢子油的研究進展[J]. 安徽農業科學, 2010, 38(17): 9214-9215.
[2]WANG Jiahe, ZHOU Yijun, ZHANG Meng, et al. Active lipids ofGanoderma lucidumspores-induced apoptosis in human leukemia THP-1 cells via MAPK and PI3K pathways[J]. Journal of Ethnopharmacology, 2012, 139(2): 582-589.
[3]孟凡冰, 李云成, 鐘耕. 靈芝孢子油的提取及其脂肪酸檢測方法的研究[J]. 食品科學, 2013, 34(2): 42-45.
[4]GAO Pei, HIRANO T, CHEN Zhiqing, et al. Isolation and identification of C-19 fatty acids with anti-tumor activity from the spores ofGanoderma lucidum(reishi mushroom)[J]. Fitoterapia, 2012,83(3): 490-499.
[5]馬林, 吳豐, 陳若蕓. 靈芝三萜成分分析[J]. 藥學學報, 2003, 38(1):61-68.
[6]陳體強, 吳錦忠. 超微粉碎后超臨界CO2萃取靈芝孢子揮發油組分的GC-MS分析[J]. 天然產物研究與開發, 2006, 18(6): 982-985.
[7]陳逸湘, 凌宏通, 曾振基, 等. 無公害室內靈芝栽培技術[J]. 中國食用菌, 2012, 31(5): 20-22.
[8]MITRA P, RAMASWAMY H S, CHANG K S. Pumpkin (Cucurbita maxima) seed oil extraction using supercritical carbon dioxide and physicochemical properties of the oil[J]. Journal of Food Engin eering,2009, 95(1): 208-213.
[9]ANIKO F G, SZABOLCS S, BELA S, et al. Supercritical fluid extraction ofAlnus glutinosa(L.) Gaertn[J]. The Journal of Supercritical Fluids, 2012, 61: 55-61.
[10]KHATTAB R Y, ZEITOUN M A. Quality evaluation of flaxseed oil obtained by different extraction techniques[J]. LWT-Food Science and Technology, 2013, 53(1): 338-345.
[11]朱堅, 李曄, 鄧優錦, 等. 超臨界CO2萃取靈芝孢子油的工藝研究[J].中國食用菌, 2009, 28(6): 50-52.
[12]毛方華, 陳體強, 王宏雨. 超臨界CO2萃取靈芝孢子油工藝條件的響應面優化[J]. 中國糧油學報, 2012, 27(6): 71-75.
[13]SAGRATINI G, MAGGI F, CAPRIOLI G, et al. Comparative study of aroma pro le and phenolic content of Montepulciano monovarietal red wines from the Marches and Abruzzo regions of Italy using H SSPME-GC-MS and HPLC-MS[J]. Food Chemistry, 2012, 132(3):1592-1599.
[14]YUAN Jianping, WANG Jianghai, LIU Xin, et al. Determinatio n of ergosterol inGanodermaspore lipid from the germinating spores ofGanoderma lucidumby high-performance lipid chromatography[J].Journal of Agricultural and Food Chemistry, 2006, 54(17): 6172- 6176.
[15]王江海, 袁建平, 徐世平, 等. 薄層色譜-光度法測定靈芝孢子中的總三萜含量[J]. 中國食品學報, 2004, 4(9): 76-79.
[16]YIN Jianzhong, WANG Aiqin, WEI Wei, et al. Analysis of the operation conditions for supercritical fluid extraction of seed oil[J].Separation and Purification Technology, 2005, 43(2): 163-167.
[17]NISHA A, SANKAR K U, VENKATESWARAN G. Supercritical CO2extraction ofMortierella alpinasingle cell oil: comparison with organic solvent extraction[J]. Food chemistry, 2012, 133(1): 22 0-226.
[18]JULIO M A A, DELCIO S. Extraction of coffee diterpenes and coffee oil using supercritical carbon dioxide[J]. Food Chemistry, 2007,101(3): 1087-1094.
[19]謝婧, 徐俐, 張秋紅, 等. 頂空固相微萃取法提取菜籽油揮發性風味成分[J]. 食品科學, 2013, 34(12): 281-285.
[20]田光輝, 林娟, 陳文強, 等. 野生與栽培靈芝揮發油成分的分析[J].中國食用菌, 2003, 22(2): 47-48.
[21]陳志杰, 楊振東, 顧振新. 頂空固相微萃取氣質聯用檢測靈芝菌絲體揮發性風味物質[J]. 食品研究與開發, 2010, 33(2): 132-135.
[22]陳曦, 黃明泉, 孫寶國, 等. 同時蒸餾萃取-氣相色譜-質譜聯用分析長裙竹蓀揮發性成分[J]. 食品科學, 2012, 33(14): 129-135.
[23]史琳, 王志成, 馮敘橋. 五味子化學成分及藥理作用的研究進展[J].藥物評價研究, 2011, 34(3): 208-212.
[24]ISHIKAWA N K, FUKUSHI Y F, YAMAJI K, et al. Antimicrobial cuparene-type sesquiterpenes, enokipodins C and D, from a mycelial culture ofFlammulina velutipes[J]. Jounal of Natural Products, 2001,64(7): 932-934.
[25]鄧乾春, 黃慶德, 黃鳳洪, 等. 亞麻籽油調和油的熱穩定性研究[J].食品科學, 2012, 33(5): 88-92.
[26]邢增濤, 郭倩, 馮志勇, 等. 姬松茸中揮發性風味物質的GC-MS分析[J]. 中藥材, 2003, 26(11): 789-791.
[27]FORRER M, KULIK E M, FILIPPI A, et al. The antimicrobial a ctivity of alpha-bisabolol and tea tree oil againstSolobacterium moorei, a Gram-positive bacterium associated with halitosis[J]. Archives of Oral Biology, 2013, 58(1): 10-16.
[28]李巍巍, 吳時敏, 徐婷. 褐黃牛肝菌揮發性風味物質組成研究[J]. 上海交通大學學報: 農業科學版, 2009, 27(3): 300-304.

