腰果蛋白的提取工藝條件優化
鐘俊楨,頓儒艷,黃宗蘭,劉 偉,劉成梅*
腰果蛋白的提取工藝條件優化
鐘俊楨,頓儒艷,黃宗蘭,劉 偉,劉成梅*
(南昌大學 食品科學與技術國家重點實驗室,江西 南昌 330047)
以腰果為原料,分析腰果仁的主要成分,比較研究不同提取方法對蛋白質提取率的影響;以料液比、提取液pH值、提取溫度、提取時間為單因素,運用單因素和正交試驗設計,優化腰果蛋白提取的最佳工藝條件。結果表明:腰果仁中粗脂肪含量最高,達44.13%,其他組分含量為:碳水化合物22.91%、蛋白質19.41%、水分3.07%、灰分2.45%;研究發現堿提法提取效果最佳,并確定其最佳工藝條件為料液比1∶40(g/mL)、提取液pH 9、提取溫度35 ℃、提取時間1.5 h,此條 件下獲得的腰果蛋白提取率可達79.0%,腰果蛋白質的純度為86.62%。腰果蛋白聚丙烯酰胺凝膠電泳分析表明:腰果蛋白主要含有22、26.2 kD的亞基,其次是14.1、16 kD,少量亞基為67.5、88 kD。
腰果;蛋白質;營養成分;提取優化;十二烷基硫酸鈉-聚丙烯酰胺凝膠
腰果屬多年生熱帶常綠喬木果樹,生于熱帶亞熱帶,是世界四大著名堅果之一,具有非常高的營養藥用和保健價值[1]。腰果果仁營養豐富,多用于制腰果巧克力、點心和油炸鹽漬食品。腰果仁油為上等食用油,副產品有果殼液、果梨等[2]。腰果的果仁約含40%~57%的油和21%蛋白質,蛋白質含量是一般谷類作物的2 倍之多,氨基酸的種類與谷物中氨基酸的種類互補,是一種具有高營養價值的食物[3]。有研究[4]顯示濃縮腰果蛋白可作為營養添加劑添加入食品中,增強食物的營養,還可以作為功能性食品,改善人體由于缺少蛋白質而引起的一些疾病等。現代醫學研究表明,腰果具有許多重要的醫藥保健作用,例如抗癌、抗菌等作用。目前,主要研究是關于腰果油和腰果酚的報道[5-8],對于腰果果仁中蛋白質的利用和開發還少有研究。Prabha等[9]通過腰果球蛋白粕喂養大鼠,對其監測腰果球蛋白飲食對脂質代謝的影響。Ogunwolu等[10]報道了腰果中濃縮蛋白和分離蛋白的功能性質。Bora等[11]比較研究天然腰果蛋白和變性蛋白功能性質的區別。Yuliana等[12]研究pH值和NaCl對腰果殼分離蛋白功能性質的影響。盡管有一些腰果蛋白功能性質的研究報道,但關于提取優化的工藝研究甚少。腰果蛋白的提取工藝的優化為食品加工產業化提供理論指導,為稀有資源的開發與利用提供理論依據,也豐富了食品行業、醫藥業保健藥品的開發利用等。
本實驗主要以腰果為原料,分析其主要成分,對腰果蛋白質的提取方法及工藝條件進行研究,以期得到最佳提取工藝,并運用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)法對提取的腰果蛋白進行分析,為腰果蛋白加工利用等研究提供理論參考。
1 材料與方法
1.1 材料與試劑
腰果購于南昌洪城大市場,于0~4 ℃貯藏。
SDS-PAGE凝膠電泳所用試劑 美國Sigma公司;所用試劑均為國產分析純。
1.2 儀器與設備
HR83型快速鹵素水分測定儀 梅特勒-托利多儀器(上海)有限公司;Sx-4-10型馬弗爐 湖北英山國營試驗設備廠;FreeZone12plus真空冷凍干燥機 美國Labconco公司;KV-9820自動凱氏定氮儀 美國Microfluidics公司;UV-1600PC紫外分光光度計 上海天美科學儀器有限公司;LXJ-IIBB高速離心機 上海安亭科學儀器廠;HH-4數顯恒溫水浴鍋 江蘇省金壇市榮華儀器制度有限公司;041BR86999電泳儀 美國Bio-Rad公司。
1.3 方法
1.3.1 原料營養成分的測定
水分含量測定:采用常壓干燥法,GB/T 5009.3—2010《食品中水分的測定》;碳水化合物含量測定:采用GB/T 5009.7—2003《食品中還原糖的測定》的方法;粗脂肪含量測定:采用索氏提取法,GB/T 14772—2008《食品中粗脂肪的測定》;蛋白質含量測定:采用凱氏定氮法,GB/T 5009.5—2010《食品中蛋白質的測定》;灰分含量測定:采用灼燒法,GB/T 5009.4—2010《食品中灰分的測定》。
1.3.2 蛋白質含量的測定
蛋白質含量測定:采用考馬斯亮藍Bradford法[13],以牛血清蛋白為標準蛋白,考馬斯亮藍G-250染色,得標準曲線方程為:Y=0.004 6X-0.012 5,R2=0.996 4。按下式計算腰果蛋白提取率。

1.3.3 原料處理及蛋白提取
1.3.3.1 原料預處理
實驗前選取顆粒飽滿、無病蟲害、質地均勻的腰果,取一定量的腰果在粉粹機中進行粉碎,放在干燥器中備用,用石油醚脫脂[14],得到腰果粉。
1.3.3.2 腰果蛋白提取方法選擇
1)Tris-HCl法[15]:取脫脂后的樣品1 g,向其中加入50 mL 0.2 mol/L pH 8的Tris-HCl緩沖液,攪拌溶解,并在45 ℃條件下浸提6 h,于4 000 r/min離心15 min,取上清液測定蛋白質含量。
2)鹽溶法:取脫脂后的樣品1 g,向其中加入50 mL 0.14 mol/L的NaCl溶液,攪拌溶解,并在45 ℃條件下浸提6 h,于4 000 r/min轉速下離心15 min,取上清液測定蛋白質含量。
3)堿溶酸沉法[16]:取脫脂后的樣品1 g,向其中加入50 mL的蒸餾水,用0.01 mol/L的NaOH溶液調pH值至10,攪拌溶解,并在45 ℃條件下浸提6 h,于4 000 r/min離心15 min,取上清液測定蛋白質含量。
1.3.4 蛋白質提取工藝的確定
1.3.4.1 單因素試驗設計
采用堿提法,在其他條件一定時,料液比采用1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)6 個水平,0.01 mol/L的NaOH溶液調節提取液pH值7、8、9、10、11、12共6 個水平,提取溫度采用25、30、35、40、45、50 ℃ 6 個水平,提取時間采用0.5、1.0、1.5、2.0、2.5 h共5 個水平分別進行單因素試驗。
1.3.4.2 正交試驗設計
根據單因素試驗結果,選擇料液比、提取液pH值、提取溫度、提取時間進行四因素三水平L9(43)正交試驗,試驗設計見表1。
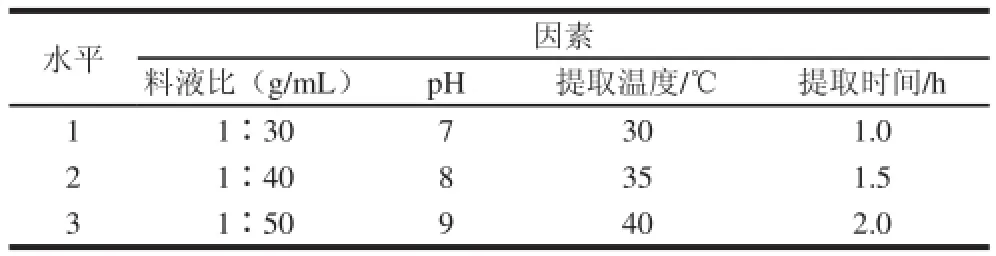
表1 正交試驗因素與水平Table 1 Factors and levels used in orthogonal array design
1.3.5 SDS-PAGE凝膠電泳[17]
將提取的腰果蛋白配制成1 mg/mL溶液,與樣品緩沖液(pH 6.8、0.5 mol/L Tris-HCl 2.0 mL,10 g/100 mL SDS 4.0 mL,甘油2.0 mL,β-巰基乙醇1.0 mL,0.1 g/mL溴酚蘭0.5 mL,超純水0.5 mL)按1∶1的體積比例混合,各8 μL。100 ℃煮沸5 min,離心,上樣8 μL,分離膠質量濃度12 mg/100 mL,濃縮膠質量濃度5 mg/100 mL。開始電流8 mA,進入分離膠后16 mA,電泳時間3.5~4 h。至溴酚藍前沿到達分離膠底部時停止電泳,撥膠,考馬斯亮藍R-250染色液染色1.5~2 h,脫色,至凝膠背景為無色時為止,拍照,分析蛋白質遷移率。
2 結果與分析
2.1 腰果原料基本成分分析
從表2可以看出,腰果仁中含量最高的是粗脂肪,含量44.13%,其次依次為碳水化合物22.91%,蛋白質19.41%,與文獻[3]中報道腰果仁中約含40%~57%的油和21%左右的蛋白質基本一致,蛋白質含量可能由于產地和品種的不同存在一定差異。

表2 腰果原料基本成分分析Table 2 Proximate composition of cashew nuts
2.2 提取方法的選擇
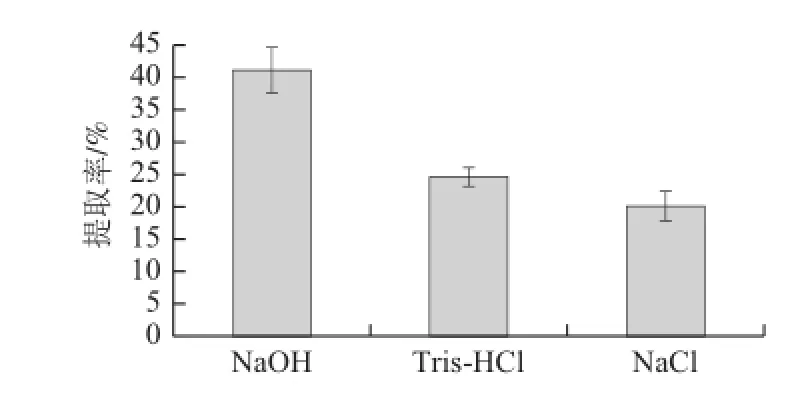
圖1 不同提取方法對腰果蛋白提取率的影響Fig.1 Effect of extraction solvents on protein extraction from cashew nuts
選用不同方法提取腰果蛋白,由圖1可以得出,相比于鹽溶法和Tris-HCl法,采用堿溶法顯著提高蛋白質提取率,達到40.09%(P<0.05),鹽溶法最低20.15%,相比較而言,提取率相差多達約20%。所以本實驗采用堿提法。研究顯示堿可以使腰果的結構變疏松,打破蛋白質分子間的部分氫鍵[18],增加了蛋白的溶解度,使得提取率增加。
2.3 單因素試驗
2.3.1 料液比對腰果蛋白質提取率的影響
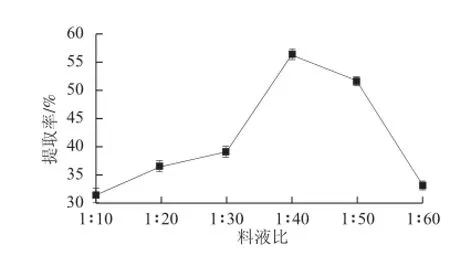
圖2 料液比對腰果蛋白質提取率的影響Fig.2 Effect of solid-to-liquid ratio on protein extraction from cashew nuts
選取溫度45 ℃、時間1 h、pH 9時,以料液比為變量進行3 次平行試驗,由圖2可知,料液比從1∶10~1∶40(g/mL)時,蛋白質提取率呈上升趨勢。當料液比為1∶40(g/mL)時,提取率顯著增高,達到最大為56.32%(P<0.05)。隨著提取液用量的持續增大,提取率逐漸降低至33.05%。可能的原因是隨著溶液體積的增大,溶劑增加,原料內外蛋白質濃度差加大,蛋白質越容易滲透到提取液中,提取率相應增大[19]。當提取液用量繼續增加時,蛋白質溶解達到飽和,加水量過多,酸沉時上清液中殘留的的清蛋白量增加,蛋白的損失量也就增高[20],提取率反而下降,此外,食品工業生產過程中,提取液用量過大會影響濃縮干燥的加大,增加了產品成本,故選取料液比為1∶40(g/mL)進行提取分析。
2.3.2 pH值對腰果蛋白質提取率的影響
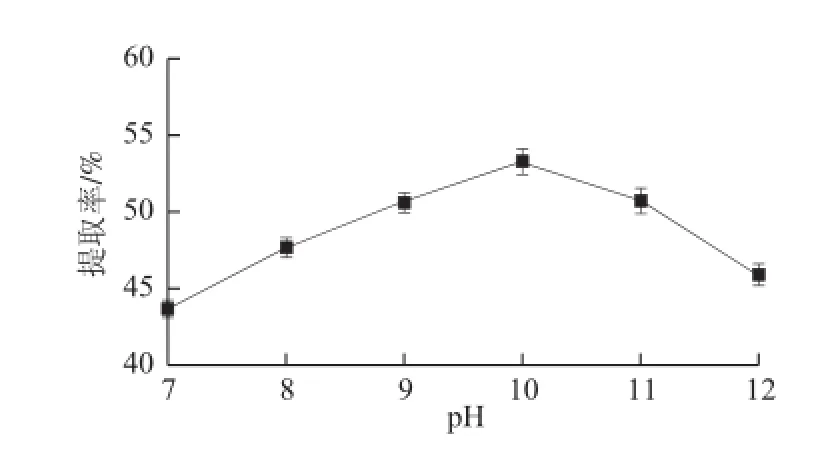
圖3 pH值對腰果蛋白質提取率的影響Fig.3 Effect of pH on protein extraction from cashew nuts
選取料液比為1∶40(mg/mL)、溫度45 ℃、時間1 h,以pH值為變量進行3 次平行試驗,由圖3可知,提取液pH值由7升到10時,腰果蛋白質的提取率隨著pH值的增高而增大,最高達到53.25%(P<0.10),但當pH值繼續增大時,提取率有下降的的趨勢。這是由于堿可以使腰果的結構變疏松,還會打破蛋白質分子間的部分氫鍵[18]從而促使淀粉和蛋白質分離,增加了蛋白提取率,而當pH值繼續增大時,在強堿環境下蛋白質容易變性和水解,同時使蛋白產品的顏色變深,蛋白質長時間受強堿作用會引起“胱賴”反應,還會生成有毒化合物[21],因此試驗的最適提取pH值在9~10之間。
2.3.3 提取溫度對腰果蛋白質提取率的影響
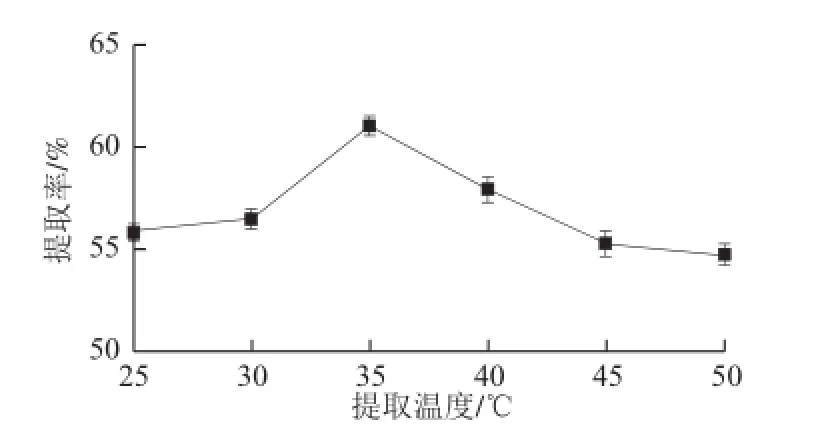
圖4 提取溫度對腰果蛋白質提取率的影響Fig.4 Effect of temperature on protein extraction from cashew nuts
選取料液比為1∶40(mg/mL)、pH 9、時間1 h,以溫度為變量進行3 次平行試驗,由圖4可知,不同提取溫度對蛋白質的提取率具有顯著影響(P<0.05)。當提取溫度為25~35 ℃,提取率逐漸上升,由56.00%上升到61.07%,隨著溫度的持續升高,提取率降低至54.73%。原因可能是35 ℃前,隨著溫度的升高,親水基團慢慢展開,巰基含量增加,蛋白質的溶解度升高;隨著溫度的持續升高,疏水基團被暴露和展開,使得蛋白質分子聚集,溶解度下降[22],導致提取率下降。當溫度升高至一定程度時,蛋白質可能發生變性,所以試驗提取溫度選在35 ℃左右。
2.3.4 提取時間對腰果蛋白質提取率的影響
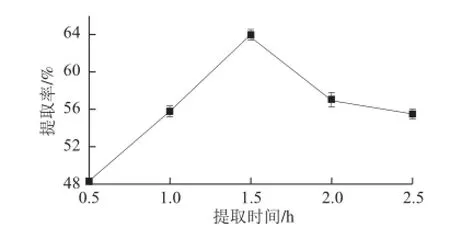
圖5 提取時間對腰果蛋白質提取率的影響Fig.5 Effect of extraction time on protein extraction from cashew nuts
選取料液比為1∶40(mg/mL)、溫度45 ℃、pH 9,以浸提時間為變量進行3 次平行試驗,由圖5可知,在1.5 h之前,腰果蛋白的提取率隨著時間的延長而顯著提高,由48.27%上升到63.93%(P<0.05),1.5 h之后,提取率出現下降趨勢,下降至55.47%。這是由于去脂腰果粉本身需要一定的溶脹時間,充足的溶脹時間利于蛋白質的分離溶解[23],若提取時間過長,浸提液中已溶蛋白質達到飽和[24],并且隨著疏水基團的暴露,有部分蛋白質出現凝聚沉淀,導致提取率的降低。
2.4 腰果蛋白質提取條件優化
在單因素試驗基礎上做正交試驗,優化提取工藝。正交試驗結果見表3。
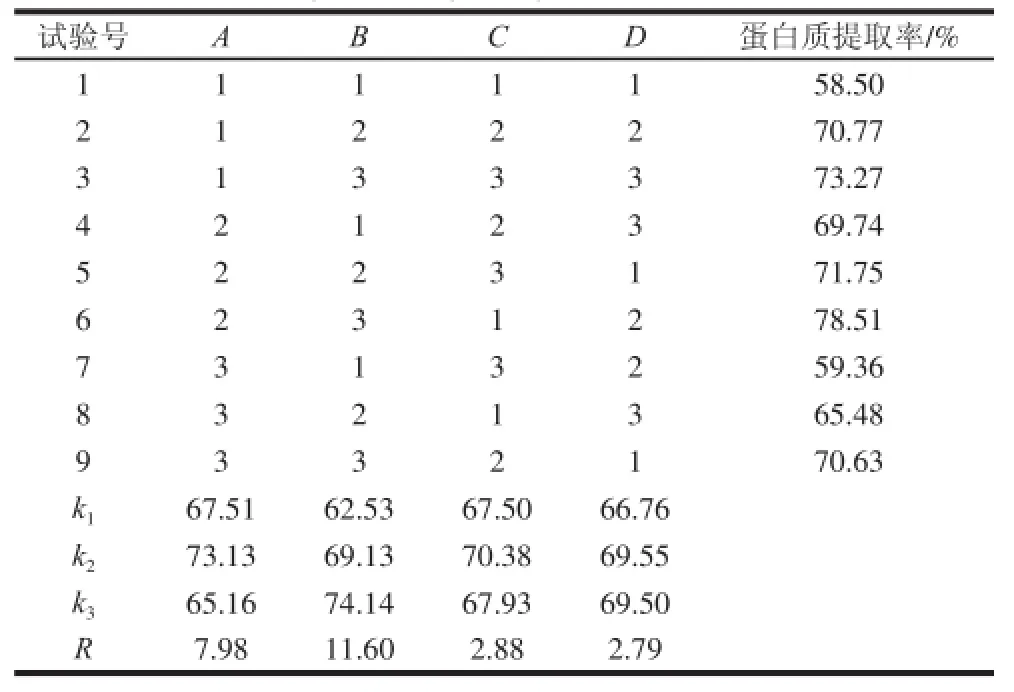
表3 腰果蛋白提取條件優化的正交試驗結果Table 3 Orthogonal array design with experimental results
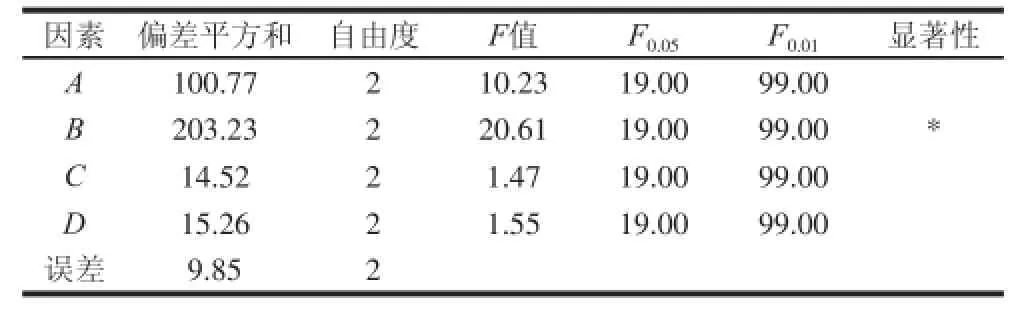
表4 正交試驗結果方差分析表Table 4 Analysis of variance for protein yield with various extraction conditions
選取料液比(A)、提取液pH值(B)、提取溫度(C)、提取時間(D)4 個因素,以腰果蛋白的提取率為指標,得出優化條件。從表3極差R值可以得出,對腰果蛋白提取率影響因素由大到小依次是B>A>C>D,即pH值對腰果蛋白的提取率影響最大。可以得出,最佳工藝條件為A2B3C2D2,即料液比1∶40(g/mL)、提取液pH 9、提取溫度35 ℃、提取時間1.5 h。由表4方差分析結果表明:pH值為影響腰果蛋白質提取過程的顯著因素,料液比、提取時間、提取溫度為不顯著因素。根據最佳工藝條件對腰果蛋白進行提取,測得腰果蛋白的提取率可達79.0%,純度為86.62%。
2.5 腰果蛋白的亞基分布和分子質量
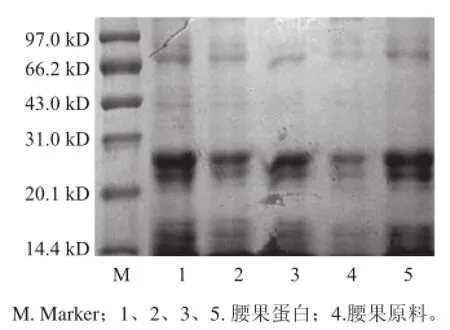
圖6 腰果蛋白質電泳圖Fig.6 SDS-PAGE of protein from cashew nuts
采用SDS-PAGE凝膠電泳對提取的腰果蛋白進行分析,其亞基分布見圖6。染色后提取的腰果蛋白質條帶相比于原料清晰可見,染色程度越深,說 明含量越高,純度越高,反之越低[25]。由圖6可知,提取得到的腰果蛋白相比于腰果原料清晰可見,可以得出提取出的腰果蛋白純度相對較高。從第5列分析,根據遷移率的不同,計算出腰果蛋白中主要含有22、26.2 kD,其次是14.1、16 kD,少量亞基為67.5、88 kD。SDS-PAGE凝膠電泳實驗說明了腰果蛋白的多樣性,驗證了提取的腰果蛋白的純度較高。
3 結 論
3.1 根據國標法測定了腰果的主要成分如下:粗脂肪含量最高,達44.13%,其他組分含量為:碳水化合物22.91%,蛋白質19.41%,水分3.07%,灰分2.45%。
3.2 選擇最優提取方法堿提法,并通過單因素、正交試驗得出腰果蛋白提取的最佳工藝條件是:料液比1∶40(g/mL)、提取液pH 9、提取溫度35 ℃、提取時間1.5 h,所得腰果蛋白的提取率可達79.0%,純度達86.62%。
3.3 SDS-PAGE凝膠電泳得出腰果蛋白中主要含有22、26.2 kD,其次是14.1、16 kD,少量亞基為67.5、88 kD,表現了腰果蛋白的多樣性和提取后的純度較高。
參考文獻:
[1] 趙麗, 黃海杰. 我國腰果研究概況[J]. 中國南方果樹, 2012, 41(2): 41-46; 77.
[2] 黃敏, 操慶國. 腰果產業具有良好的發展前景[J]. 食品工程, 2009(1): 27-29.
[3] SOARES D J, MENEZED D V, PEDRO H, et al. Prevalent fatty acids in cashew nuts obtained from conventional and organic cultivation in different stages of processing[J]. Food Science and Technology, 2013, 33(2): 265-270.
[4] RIBEIRO V G P, BARRETO A C H, DENARDIN J C, et al. Magnetic nanoparticles coated with anacardic acid derived from cashew nut shell liquid[J]. Journal of Materials Science, 2013, 48(22): 7875-7882.
[5] SOARES D J, MEBEZED D V, PEDRO H, et al. Prevalent fatty acids in cashew nuts obtained from conventional and organic cultivation in different stages of processing[J]. Food Science and Technology, 2013, 33(2): 265-270.
[6] AREMU M O, OGUNLADE I, OLONISAKIN A. Fatty acid and amino acid composition of protein concentrate from cashew nut (Anarcadiu occidentale) grown in Nasarawa State, Nigeria[J]. Pakistan Journal of Nutrition, 2007, 6(5): 419-423.
[7] 孫延芳, 楊開寶, 劉瑩, 等. 腰果種仁脂肪酸GC-MS分析[J]. 黑龍江農業科學, 2012(1): 92-93.
[8] GOMEZ-CARAVACA A M, VERARDO V, CABONI M F. Chromatographic techniques for the determination of alkyl-phenols, tocopherols and other minor polar compounds in raw and roasted cold pressed cashew nut oils[J]. Journal of Chromatography A, 2010, 1217(47): 7411-7417.
[9] PRABHA S P S, RAJAMOHAN T. Effect of inclusion of cashew globulin (Anacardium occidentale) to a casein diet on lipid parameters in rats[J]. Plant Foods for Human Nutrition, 1998, 53(1): 83-92.
[10] OGUNWOLU S O, HENSHAW F O, MOCK H P, et al. Functional properties of protein concentrates and isolates produced from cashew (Anacardium occidentale L.) nut[J]. Food Chemistry, 2009, 115(3): 852-858.
[11] BORA P S, NETO V Q. Functionality of native and denatured cashew nut kernel protein isolates at isoelectric pH as a function of salt concentration[J]. Journal of the Science of Food and Agriculture, 2004, 84(15): 2022-2027.
[12] YULIANA M, TRUONG C T, HUYNH L H, et al. Isolation and characterization of protein isolated from defat ted cashew nut shell: influence of pH and NaCl on solubility and functional properties[J]. LWT-Food Science and Technology, 2014, 55(2): 621-626.
[13] BRADFORD M M. A rapid and sensitive method for quantitation of microgram quantities of protein utilizing principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254.
[14] 于陽陽. 東北核桃楸種仁蛋白提取及降血壓肽制備的研究[D]. 哈爾濱: 東北林業大學, 2012
[15] 李瑩瑩, 吳彩娥, 楊劍婷, 等. 白果蛋白質提取及SDS-PAGE分析[J].食品科學, 2010, 31(22): 36-40.
[16] 王姝, 王昌濤, 于國萍. 羽扇豆蛋白的提取及性質研究[J]. 食品科技, 2012, 37(5): 230-235.
[17] 郭堯君. 蛋白質電泳實驗技術[M]. 北京: 中國科學出版社, 1992: 123-156.
[18] 張相年, 趙樹進, 李超. 蛋白分離技術的應用和進展[J]. 中國藥業, 2006, 15(2): 72-73.
[19] 蔡金星, 劉秀鳳, 常學東, 等. 蠶豆蛋白質提取分離及其物化性質研究[J]. 食品工業科技, 2007, 28(10): 142-144.
[20] 邵佩蘭, 徐明. 提取大豆分離蛋白的工藝研究[J]. 糧油加工與食品機械, 2005(9): 47-48; 51.
[21] 王憲澤. 生物化學實驗技術原理和方法[M]. 北京: 中國農業出版社, 2002.
[22] 李新華, 閆榮. 遼西大扁杏杏仁蛋白的組成及堿法提取工藝的研究[J].食品科技, 2009, 34(5): 132-135.
[23] 李順靈, 嚴有兵, 李向珍. 食用菜籽蛋白的提取分離及其應用研究[J].食品工業科技, 2007, 28(3): 12-14.
[24] 郭興峰, 陳計巒, 林燕, 等. 熱榨和冷榨核桃餅粕中蛋白質提取及其性質研究[J]. 農業工程學報, 2012, 28(18): 287-292.
[25] 王廷華, 鄒曉莉. 蛋白質理論與技術[M]. 北京: 北京科學技術出版社, 2007.
Optimizing the Extraction of Protein from Cashew Nuts
ZHONG Jun-zhen, DUN Ru-yan, HUANG Zong-lan, LIU Wei, LIU Cheng-mei*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In the present study, cashew nuts were analyzed for main chemical components. A comparative investigation of different extraction methods for protein extraction from cashew nuts was made. The extraction process was optimized with regard to solid-to-liquid (S/L) ratio, solvent pH, extraction temperature and time by single-fact or and orthogonal array designs. The results showed that crude fat was the most abundant component in cashew nuts with a level of 44.13%, which also contained 22.91% carbonhydrates, 19.41% protein, 3.07% water and 2.45%. The best extraction efficiency was achieved using alkali extraction and the best experimental conditions were found to be extraction at 35 ℃ for 1.5 h using an extraction solvent at pH 9 with an S/ L ratio of 1:40 (g/mL). Under the optimized conditions, the yield of protein was 79.0% with a purity of 86.62%. SDS-PAGE analysis showed that the major subunits of cashew nuts protein had a molecular mass of 22 and 26.2 kD, respectively, and 14.1- and 16-kD subunits and a small amount of 67.5- and 88-kD subunits were also observed.
cashew nuts; protein; nutritional components; optimized extraction; sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)
TS255.6
A
1002-6630(2014)16-0018-05
10.7506/spkx1002-6630-201416004
2013-10-24
公益性行業(農業)科研專項(201303077)
鐘俊楨(1984—),女,助理研究員,博士,研究方向為食品科學與工程。E-mail:zhongjunzhen@163.com
*通信作者:劉成梅(1963—),男,教授,博士,研究方向為食物資源利用與開發。E-mail:chengmeiliu@yahoo.com.cn

