響應面法優化松茸多糖酶法提取工藝及其體外抗氧化性分析
陳煉紅,楊麗珠,索化夷,李 鍵*
響應面法優化松茸多糖酶法提取工藝及其體外抗氧化性分析
陳煉紅1,楊麗珠2,索化夷3,李 鍵4,*
(1.西南民族大學生命科學與技術學院,四川 成都 610041;2.中國海洋大學食品科學與工程學院,山東 青島 266003;3.西南大學食品科學學院,重慶 400716;4.西南民族大學青藏高原研究院,四川 成都 610041)
為確定復合酶(纖維素酶、果膠酶、中性蛋白酶)提取松茸多糖的最佳工藝,并對其體外抗氧化活性進行初步研究,在單因素試驗的基礎上,以料液比、pH值、酶解時間和酶解溫度為影響因素,利用Box-Behnken方法進行四因素三水平試驗設計,以多糖提取率為響應值,進行響應面分析;分別用鄰苯三酚自氧化法和對DPPH自由基的清除作用測定松茸多糖的體外抗氧化性。結果表明:多糖提取的最佳工藝為料液比1∶40(g/mL)、pH 5、酶解溫度35 ℃、酶解時間71 min,松茸多糖的提取率預測值為7.06%,驗證值為6.95%,與預測值相對誤差為1.56%;松茸多糖對超氧陰離子自由基和DPPH自由基具有較強的清除作用,其IC50值分別為0.565 mg/mL和0.454 mg/mL。因此,復合酶法提取松茸多糖高效、簡單,可用作松茸多糖的提取工藝;松茸多糖具有明顯的體外抗氧化活性。
松茸;響應面法;多糖;提取工藝;抗氧化性
松茸(Tricholoma matsutak),又名松口蘑,別名大花菌、剝皮菌,屬于擔子菌綱傘菌目口蘑科口蘑屬。松茸富含粗蛋白、粗脂肪、粗纖維和多種維生素,不但味道鮮美,而且還具有益腸胃、理氣化痰等功能,生長在寒溫帶海拔3 500 m以上的高山林地,生態習性的特殊性使得松茸更加珍貴。多糖是松茸主要的的活性成分,松茸多糖具有顯著的免疫調節、抗疲勞、抗炎護肝以及對環磷酰胺誘發損傷的拮抗作用等功效[1]。最近的研究表明,松茸多糖能夠抑制人神經膠細胞系(U87)、人乳腺癌細胞(MCF-7)、人胰腺導管上皮癌(PANC-1)以及人宮頸癌(HeLa)細胞的生長,且能引起上述細胞S期阻滯,上調p53mRNA表達水平[2]。松茸多糖提取效率和質量對于進一步開發松茸相關保健產品具有重要的意義。本研究利用響應面法對松茸的復合酶法提供最佳條件的選擇,提高松茸多糖的得率,并對提取后的松茸多糖進行體外抗氧化能力的測定,旨在對松茸多糖資源的開發利用提供一定的理論依據。
1 材料與方法
1.1 材料與試劑
松茸(Tricholoma matsutak)采自四川省甘孜草原,烘干磨碎過100 目篩備用。
纖維素酶(15 U/mg) 上海博奧生物科技有限公司;木瓜蛋白酶(600 U/mg) 北京奧博星生物技術有限公司;果膠酶(500 U/mg) 成都市科龍化工試劑廠。
正丁醇、三氯甲烷、無水乙醇、濃硫酸、苯酚、葡萄糖、檸檬酸、磷酸氫二鈉等(均為分析純) 成都市科龍化工試劑廠;鄰苯三酚、Tris試劑、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 成都迪康生物技術有限公司。
1.2 儀器與設備
400 g多功能粉碎機 永康市小寶電器有限公司;DHG-9203A型電熱恒溫鼓風干燥箱 上海一恒科技有限公司;AL204電子天平(精確至0.000 1 g) 梅特勒-托利多儀器(上海)有限公司;AKHL-Ⅲ-24超純水機 成都康寧試驗專用純水設備廠;XW-80A旋渦混合器、RE-85Z旋轉蒸發器 上海青浦滬西儀器廠;HH-6數顯恒溫水浴鍋 國華電器有限公司;5804R離心機 德國Eppendorf公司;UV-6100型紫外-可見分光光度計 上海美譜達儀器有限公司;磁力攪拌器、SHZ-D(Ⅲ)循環水式真空泵 鞏義市英峪予華儀器廠;DHZ-C大容量冷凍恒溫振蕩器 太倉市試驗設備廠。
1.3 方法
1.3.1 松茸多糖酶法提取工藝[3-6]
干松茸→粉碎→復合酶水解(單因素和多因素)→離心(7 500 r/min,10 min)→取上清液→脫蛋白(Sevag試劑(三氯甲烷-正丁醇(4∶1,V/V)脫蛋白,重復操作4 次)→真空濃縮(旋轉蒸發器濃縮多糖提取液至原體積的1/3)→乙醇沉淀(4 ℃低溫,體積分數80%乙醇溶液醇沉過夜,棕色絮狀粗多糖析出)→離心(參數同上)→沉淀→干燥→定容→測粗多糖含量
1.3.2 標準曲線的制作及多糖含量的測定
采用蒽酮-硫酸法測定多糖含量[7-10],分別吸取0.04 mg/mL的葡萄糖標準液0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL,各以超純水補至2.0 mL置于比色杯中。分別加入質量分數6%的苯酚1.0 mL及濃硫酸5.0 mL,靜置10 min,搖勻,室溫放置20 min后于紫外-可見分光光度計620 nm波長處測吸光度,以2.0 mL水按同樣顯色操作為空白,以葡萄糖質量濃度為橫坐標,吸光度為縱坐標,繪制葡萄糖標準曲線。
標準曲線回歸方程為:A=8.652x+0.085(x為葡萄糖質量濃度/(mg/mL),A為吸光度),R2=0.997,線性關系良好。
松茸提取液中多糖含量的測定:同樣采用苯酚-硫酸法。將提取后經干燥過的多糖用體積分數80%乙醇溶液定容于500 mL容量瓶內,吸取1.0 mL以超純水補至2.0 mL。分別加入質量分數6%的苯酚1.0 mL及濃硫酸5.0 mL,靜置10 min,搖勻,室溫放置20 min后于紫外-可見分光光度計490 nm波長處測吸光度。將測定出的吸光度代入葡萄糖標準曲線中便可得到多糖提取液中多糖的含量。按照式(1)可計算出松茸多糖的提取率:
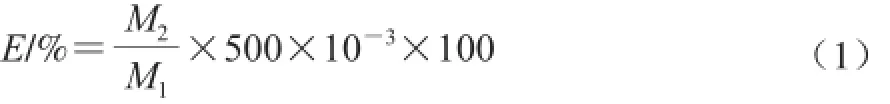
式中:E為松茸多糖的提取率/%;M1為松茸粉質量/mg;M2為依據回歸方程計算出的粗多糖質量濃度/(mg/mL)。
1.3.3 松茸粗多糖提取單因素試驗[11-14]
將復合酶的條件定為纖維素酶、果膠酶、中性蛋白酶的比例為1∶1∶1,加入的總量為水解液體積的0.2%。在酶添加量一定的條件下,分別考察不同料液比(g/mL)(1∶10、1∶20、1∶30、1∶40、1∶50)、不同pH值(3.0、4.0、5.0、6.0、7.0)、不同酶解時間(20、40、60、80、100 min)和不同酶解溫度(30、35、40、45、50 ℃)對松茸多糖提取率的影響。
1.3.4 響應面優化試驗
在上述單因素試驗的基礎上,選擇料液比、pH值、酶解時間和酶解溫度為自變量,根據Box-Behnken設計原理[14-15],進行四因素三水平的響應面分析試驗[16-20],因素水平設計見表1。以松茸粗多糖提取率為響應值,利用Design Expert 8.05軟件對數據進行分析,得出最佳酶解工藝條件。
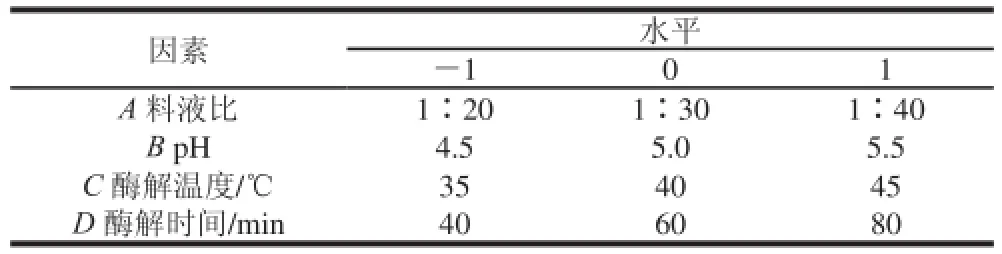
表1 響應面試驗設計因素與水平Table 1 Factors and levels used in response surface design
1.3.5 松茸多糖體外抗氧化活性實驗
1.3.5.1 超氧陰離子自由基清除率的測定[21-23]
分別取不同質量濃度的樣品溶液1.0 mL,加入50 mmol/L的Tris-HCl緩沖液(pH 8.2)4.0 mL,25 ℃水浴保溫10 min,然后加入25 mmol/L的鄰苯三酚0.1 mL,混勻,保溫5 min,立即加入2 滴10 mol/L的HCl溶液終止反應,讀取溶液在波長325 nm處的吸光度。空白組加入蒸餾水1.0 mL代替樣液,以VC為對照。按照式(2)計算松茸多糖清除超氧陰離子自由基的清除率:
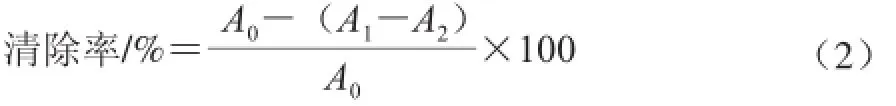
式中:A0為空白組的吸光度;A1為樣品溶液的吸光度;A2為不加鄰苯三酚的樣品溶液的吸光度。
1.3.5.2 DPPH自由基清除率的測定[24-25]
取不同質量濃度的樣品溶液2 mL和2 mL DPPH溶液(0.08 mg/mL)分別置于不同三角瓶中,混勻,反應30 min后在517 nm波長處測定其吸光度,以VC為對照。按照式(3)計算松茸多糖清除DPPH自由基的清除率:
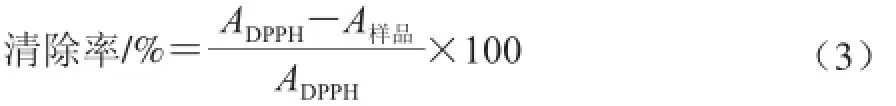
式中:ADPPH為DPPH溶液的吸光度;A樣品為加入樣品溶液或VC后樣品DPPH溶液的吸光度。
2 結果與分析
2.1 單因素試驗
2.1.1 料液比對松茸多糖提取率的影響
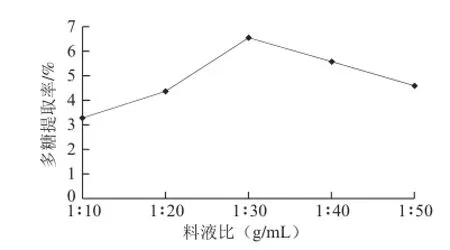
圖1 料液比對松茸多糖提取率的影響Fig.1 Effect of water/material ratio on the extraction efficiency of Tricholoma matsutake polysaccharides
由圖1可知,在pH5.0(pH值用磷酸氫二鈉和檸檬酸配制的緩沖液調節)、酶解時間60 min、酶解溫度40℃的條件下,當料液比為1∶30時,松茸多糖提取率達到6.57%,之后,隨著液體體積增大,多糖得率反而減小,在此料液比條件下松茸多糖的溶解度達到最大,因此采用1∶30的料液比最佳。
2.1.2 pH值對松茸多糖提取率的影響
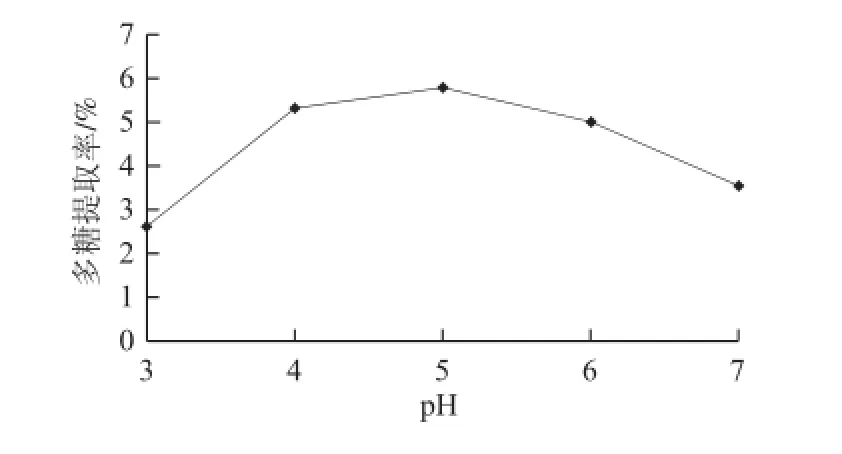
圖2 pH值對松茸多糖提取率的影響Fig.2 Effect of pH on the extraction efficiency of Tricholoma matsutake polysaccharides
由圖2可知,在料液比1∶30、酶解時間60 min、酶解溫度40 ℃的條件下,當pH值為3.0時,松茸多糖的提取率最低,溶液的酸度太大抑制了酶的活性;當pH值為5.0時,松茸多糖提取率達到5.75%,之后,隨著pH值增大,多糖得率反而減小,這是因為pH值的升高影響了酶與底物的親和力,破壞了酶的活性,從而造成了多糖提取率的下降[6]。綜合考慮, pH值為4.5時最佳。
2.1.3 酶解時間對松茸多糖得率的影響
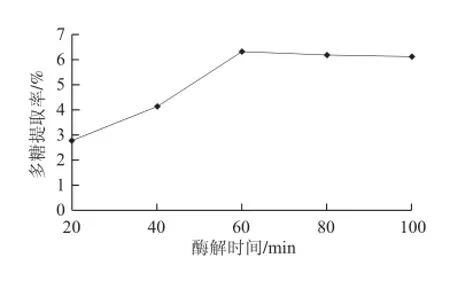
圖3 酶解時間對松茸多糖提取率的影響Fig.3 Effect of hydrolysis time on the extraction efficiency of Tricholoma matsutake polysaccharides
由圖3可知,在料液比1∶30、pH4.5、酶解溫度40 ℃的條件下,當酶解時間為60 min時,松茸多糖提取率達到6.36%,之后,隨著酶解時間的延長,多糖提取率略有下降。當酶解時間太短,酶解不充分,而酶解時間過長也不能顯著增加松茸多糖的提取率。綜合考慮,酶解時間為60 min時最佳。
2.1.4 酶解溫度對松茸多糖提取率的影響
由圖4可知,在料液比1∶30、pH4.5、酶解時間60 min的條件下,當酶解溫度為40 ℃時,松茸多糖提取率達到6.53%,之后,隨著酶解溫度的升高,多糖提取率反而減小。當酶解溫度升高到一定值時,破壞了酶的活性,多糖提取率減小。綜合考慮,酶解溫度為40 ℃時最佳。
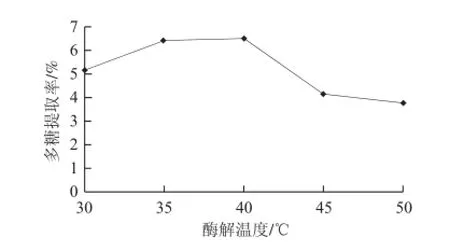
圖4 酶解溫度對松茸多糖提取率的影響Fig.4 Effect of hydrolysis temperature on the extraction efficiency of Tricholoma matsutake polysaccharides
2.2 響應面優化試驗
在單因素試驗結果的基礎上,以料液比、pH值、酶解時間和酶解溫度4 個因素為自變量,以松茸粗多糖提取率為響應值,采用響應面法進行四因素三水平的試驗設計,共包括29 組試驗方案。試驗方案及試驗結果見表2,回歸分析見表3。

表2 2 松茸多糖提取率的響應面試驗方案及結果Table 2 Response surface design arrangement and experimental results
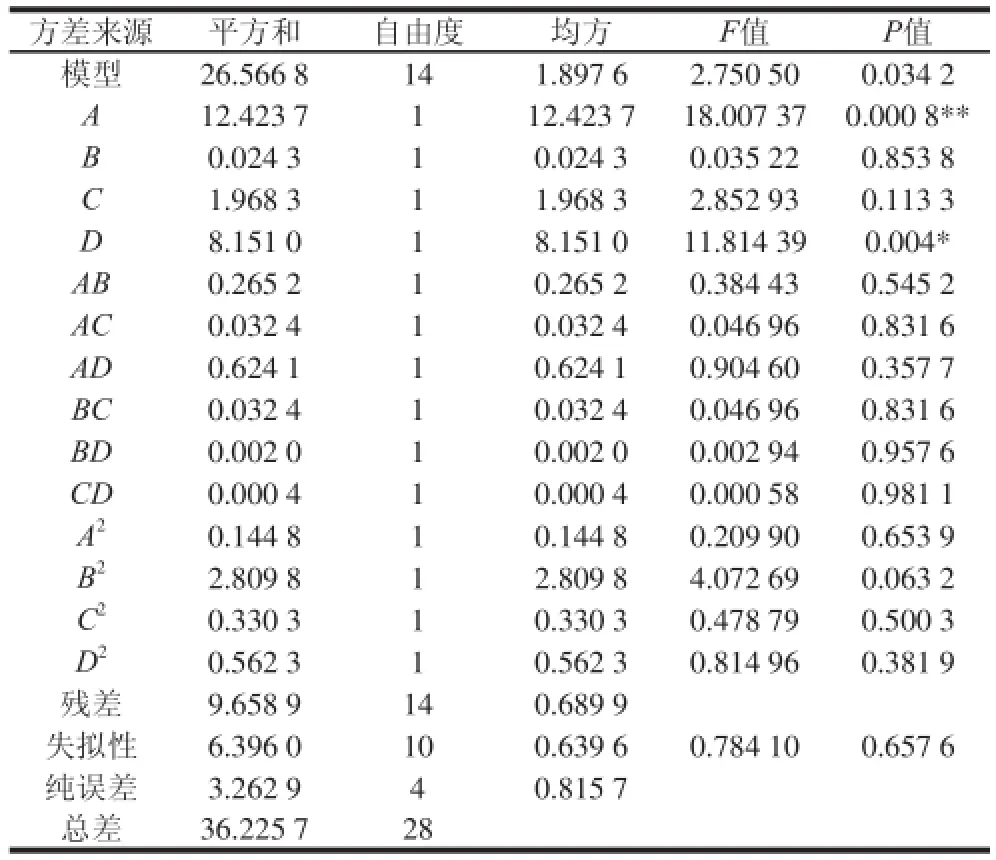
表3 擬合二次多項式模型的方差分析Table 3 Analysis of variance of the fitted quadratic polynomial model
2.2.1 模型方程的建立與顯著性檢驗
對表2中的數據進行多元回歸擬合,獲得松茸多糖提取率對編碼自變量料液比、pH值、酶解溫度和酶解時間的二次多項回歸方程:
Y=5.75+1.02A+0.045B-0.40C+0.82D+0.26AB-0.09AC-0.40AD-0.090BC-0.023BD-0.010CD-0.15A2-0.66B2-0.23C2-0.29D2
對模型進行方差分析(表3),可以看出:P模型= 0.034 2<0.05,表明模型顯著;多糖提取率失擬項P=0.6576,表明失擬不顯著,所選用的二次回歸模型是適當的;對模型進行回歸方程系數顯著性檢驗,得到模型一次項A(P<0.001)差異極顯著,一次項D(P<0.05)差異顯著,表明料液比與酶解時間對多糖提取率有顯著影響。
2.2.2 松茸多糖的響應面分析
利用Design-Expert 8.05軟件對表2中的數據進行二次多元回歸擬合,所得到的二次回歸方程的響應面如圖5所示。
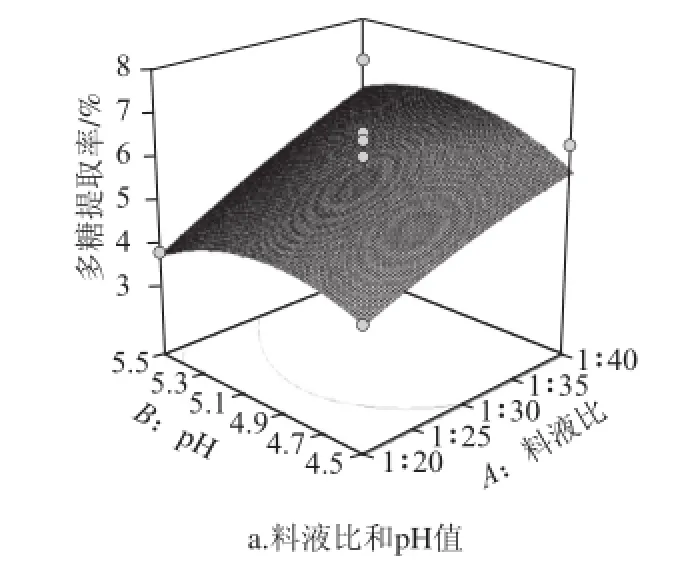
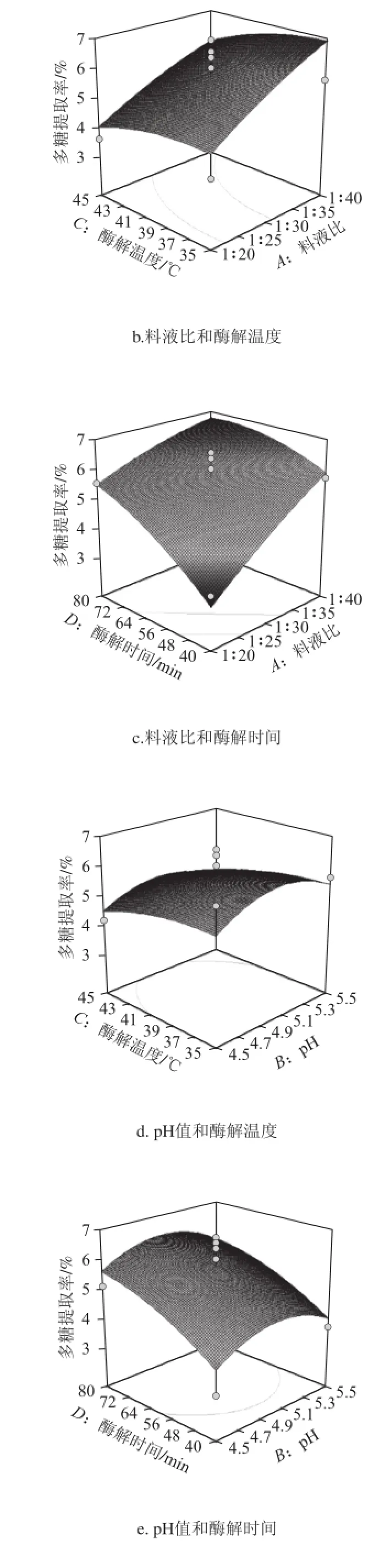
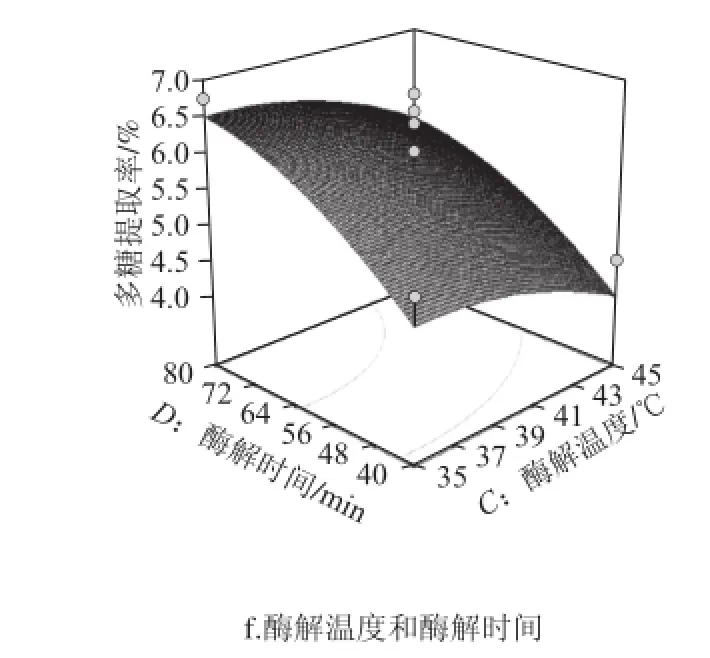
圖5 兩因素交互作用對松茸提取率影響的響應面圖Fig.5 Response surface plots showing the effects of operating parameters on the extraction efficiency of Tricholoma matsutake polysaccharides
從圖5可以直觀地看出,各試驗因素的交互作用不顯著。試驗因素中料液比對松茸多糖提取率有顯著影響,酶解時間次之。通過對回歸模型求解方程,得出松茸多糖的最佳提取工藝為料液比1∶40(g/mL)、pH 5、酶解溫度35 ℃、酶解時間71 min,在此提取條件下多糖的最大提取率為7.06%。
2.2.3 驗證實驗
在上述最佳提取工藝參數下,進行3 組平行實驗,所得多糖提取率的平均值為6.95%,與回歸方程所得的多糖提取率7.06%相對誤差為1.56%。說明回歸方程能較真實地反應各因素對松茸多糖提取率的影響,證明用響應面法優化松茸多糖提取率回歸模型較可靠。
2.3 松茸多糖體外抗氧化活性分析
2.3.1 超氧陰離子自由基清除能力
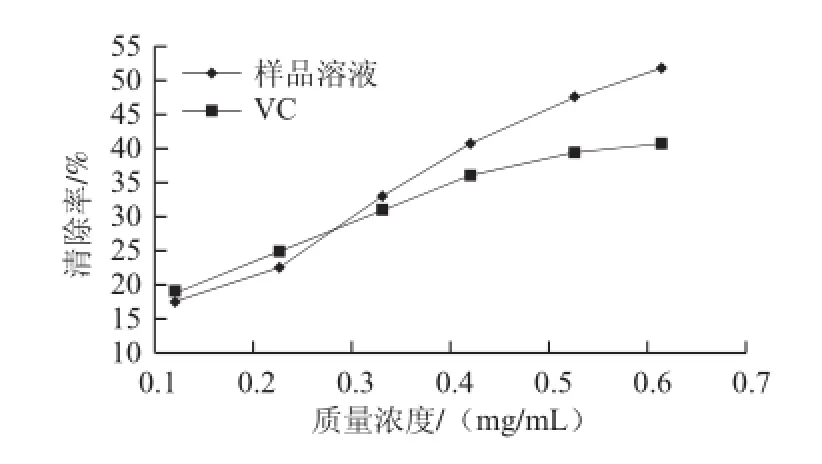
圖6 松茸多糖對超氧陰離子自 由基的清除率Fig.6 Superoxide anion free radical scavenging effect of Tricholoma matsutake polysaccharides
從圖6可看出,在測定的質量濃度范圍內,隨著松茸多糖質量濃度的增大,對超氧陰離子自由基的清除率也是增大的,在松茸質量濃度達到一定值后,其超氧陰離子自由基的清除率是大于VC的。松茸多糖對超氧陰離子自由基的IC50值為0.565 mg/mL,VC對超氧陰離子自由基的IC50值為0.766 mg/mL。
2.3.2 DPPH自由基清除能力
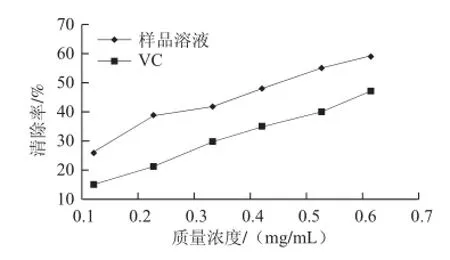
圖7 松茸多糖對DPPH自由基的清除率Fig.7 DPPH free radical scavenging effect of Tricholoma matsutake polysaccharides
從圖7可看出,在測定的質量濃度范圍內,隨著松茸多糖質量濃度的增大,對DPPH的清除率也是增大的,在整個測定的質量濃度范圍內,其DPPH自由基的清除率都是大于VC的。松茸多糖對DPPH自由基的IC50值為0.454 mg/mL,VC對DPPH自由基的IC50值為0.663 mg/mL。
3 結 論
使用復合酶法提取松茸多糖,在單因素試驗的基礎上,以松茸多糖得率為響應值,響應面優化后,得到松茸多糖的最佳提取工藝為料液比1∶40(g/mL)、pH 5、酶解溫度35 ℃、酶解時間71 min,在此提取條件下多糖的提取率為6.95%,與預測值7.06%相比,相對誤差為1.56%。說明回歸方程能較真實地反應各因素對松茸多糖提取率的影響,證明用響應面法優化松茸多糖提取率回歸模型較可靠。
松茸多糖的體外抗氧化能力實驗結果表明,多糖對不同自由基的清除能力不同,且在一定的質量濃度范圍內(0.1~0.6 mg/mL)呈正相關的關系;在一定的質量濃度范圍內(0.1~0.6 mg/mL),松茸多糖清除自由基的能力是大于VC的,整個多糖體外抗氧化性的研究都表明了松茸多糖都具有較強的體外抗氧化能力,為今后松茸多糖相關產品的的開發利用提供了一定的參考和依據。
[1] 楊培國, 趙晶, 張輝. 松茸多糖的化學組分及藥理作用研究[J]. 長春中醫藥大學學報, 2008, 24(4): 374-375.
[2] 張治業. 松茸多糖對不同腫瘤細胞系的體外抗腫瘤作用[J]. 山東醫藥, 2011, 51(13): 70-71.
[3] HOSHI H, IIJIMA H, ISHIHARA Y, et al. Absorption and tissue distribution of an immunomodulatory alpha-D-glucan afteroral administration of Tricholoma matsutake[J]. Journal of Agricultural and Food Chemistry, 2008, 56(17): 7715-7720.
[4] KIM J Y, LEE Y G, PARK J S, et al. Immunostimul atoryactivities of polysaccharides from liquid culture of pine-mushroom Tricholoma matsutake[J]. Journal of Microbiology and Biotechnology, 2008, 18(1): 95-103.
[5] QIN Junzhe, CHEN Ming, CHEN Han, et al. Prospect and current studies on edible and pharmaceutical fungi polysaccarides[J]. Edible Fungi of China, 2003, 23(2): 6-9.
[6] 劉剛, 王輝, 郭咸希, 等. 松茸多糖的分離與純化[J]. 中國藥師, 2011, 14(8): 1099-1101.
[7] 劉倩, 何法林, 江春花, 等. 松茸多糖兩種測定方法的比較研究[J].時珍國醫, 2010, 21(5): 1058-1059.
[8] 張惟杰. 糖復合物生化研究技術[M]. 2版. 杭州: 浙江大學出版社, 2006: 179-197.
[9] 岳金玫, 浦彪, 周月霞, 等. 響應面法優化塊菌多糖的酶法輔助提取工藝[J]. 食品科學, 2013, 34(2): 119-124.
[10] 孫培龍. 姬松茸多糖的分離純化結構鑒定及抗腫瘤活性研究[D].杭州: 浙江大學, 2007: 76.
[11] 吳鏑. 松茸提取物抗腫瘤作用的研究[D]. 長春: 長春中醫藥大學, 2008: 9-11.
[12] 李磊, 王衛國. 真菌多糖藥理作用及其提取,純化研究進展[J]. 河南工業大學學報, 2008, 29(2): 87-92.
[13] 葉敏. 紅拖竹蓀多糖的提取工藝及其體外抗氧化性[J]. 貴州農業科學, 2012, 40(12): 172-175.
[14] 尹秀蓮, 游慶宏, 蔣中海. 松茸多糖的提取純化工藝研究[J]. 中國釀造, 2009, 28(10): 171-173.
[15] 蔣中海, 尹秀蓮, 游慶紅. 響應面法優化松茸多糖提取工藝[J]. 中國調味品, 2011, 36(9): 68-71.
[16] DING Xiang, TANG Jie, CAO Mei, et al. Structure elucidation and antioxidant activity of a novel poltsaccharide isolated from Tricholoma matsutake[J]. International Journal of Biological Macromolecules, 2010, 47(2): 271-275.
[17] 胡婧楠, 留景圣. 松茸多糖的研究進展[J]. 食品工業, 2011, 31(7): 107-109.
[18] 陳春陽, 劉景圣. 松茸胞外多糖提取條件的優化[J]. 中國食物與營養, 2012, 18(1): 60-62.
[19] 魏楨元, 鐘耀廣, 劉長江. 響應面優化法對香菇多糖提取的工藝研究[J]. 遼寧農業科學, 2010(2): 11-14.
[20] 陳君琛, 賴譜富, 周學化, 等. 響應面法優化大球蓋菇粗多糖提取工藝[J]. 食品科學, 2012, 33(2): 139-142.
[21] CHANDRIKA L P, FEREIDOON S. Optimization of extraction of phenolic compounds from wheat using response surface methodology[J]. Food Chemistry, 2005, 93(1): 47-56.
[22] 劉青, 劉珍伶, 周娟. 金線蓮多糖的體外抗氧化活性[J]. 華僑大學學報: 自然科學版, 2010, 31(6): 718-720.
[23] 劉玉芬, 夏海濤, 徐芹喜. 海英菜多糖提取工藝的響應面法優化及其體外抗氧化作用[J]. 食品科學, 2012, 33(20): 138-143.
[24] CAPEK P, MACHOBA E, TURIAN J. Scavenging and antioxidant actibities of immunomodulating polysaccharids isolated form Salvia offi cinalis[J]. International of Biologica Macromolecules, 2009, 44(1): 75-80.
[25] 祝元婷, 吳文林, 張利, 等. 超聲提取鼠尾草葉多糖工藝優化及其DPPH自由基清除能力評價[J]. 食品科學, 2011, 32(16): 76-79.
Response Surface Analysis for the Optimization of Extraction Process for Polysaccharides from Tricholoma matsutake and Antioxidant Activity of the Extracted Polysaccharides
CHEN Lian-hong1, YANG Li-zhu2, SUO Hua-yi3, LI Jian4,*
(1. College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China; 2. College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China; 3. College of Food Science, Southwest University, Chongqing 400716, China; 4. Institute of Qinghai-Tibetan Plateau, Southwest University for Nationalities, Chengdu 610041, China)
Objective: To develop an optimized enzymatic method for extracting polysaccharides from Tricholoma matsutake with a combination of cellulase, pectinase and neutral protease and to evaluate the antioxidant activity in vitro of the extracted polysaccharides. Methods: On the basis of single-factor experiments, a four-factor, three-level Box-Behnken design was utilized for the mathematical modeling of polysaccharide yield as a function of material/water ratio, medium pH and hydrolysis time and temperature. This was followed by response surface analysis of the developed mathematical model. The antioxidant activity of Tricholoma matsutake polysaccharides was determined by pyrogallol autoxidation and free radical-scavenging assay. Results: The optimum condition for the extraction of Tricholoma matsutake polysaccharides were found to be hydrolysis at 35 ℃ for 71 min with a material/solvent ratio of 1:40 (g/mL) at pH 5. Under these conditions, the model-predicted and experimentally measured values of polysaccharide yield were 7.06% and 6.95%, respectively, revealing a relative error of only 1.56% between them. The Tricholoma matsutake polysaccharides had a strong capacity to scavenge superoxide anion (IC50= 0.565 mg/mL) and DPPH free radical (IC50= 0.454 mg/mL). Conclusion: The proposed extraction method is efficient, simple and applicable for the extraction of polysaccharides form Tricholoma matsutakes and the extracted polysaccharides have significant antioxidant capacity in vitro.
Tricholoma matsutake; response surface analysis; polysaccharides; extraction process; antioxidant effect
TS202
A
1002-6630(2014)16-0023-06
10.7506/spkx1002-6630-201416005
2013-11-07
公益性行業(農業)科研專項(201203009);西南民族大學2014年校課題一般項目(2014NY1302)
陳煉紅(1967—),女,副教授,本科,研究方向為民族食品資源開發。E-mail:lianhong_chen@163.com
*通信作者:李鍵(1967—),男,教授,博士,研究方向為民族食品資源開發。E-mail: lijiangracy@yahoo.com

