柞蠶雄蛾黃酮的提取及其體外抗氧化活性分析
田 野,岳喜慶*,楊 梅
柞蠶雄蛾黃酮的提取及其體外抗氧化活性分析
田 野,岳喜慶*,楊 梅
(沈陽農(nóng)業(yè)大學(xué)食品學(xué)院,遼寧 沈陽 110866)
研究柞蠶雄蛾黃酮提取工藝及其體外抗氧化作用,采用超聲波乙醇提取柞蠶雄蛾黃酮,利用紫外-可見吸收光譜對其進(jìn)行鑒定,采用正交試驗(yàn)設(shè)計優(yōu)選柞蠶雄蛾黃酮提取的最佳工藝條件。從還原能力以及清除1,1-二苯基苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羥自由基(·OH)、超氧陰離子自由基(O2-·)效果來考察柞蠶雄蛾黃酮的體外抗氧化能力。得到最佳工藝條件為:乙醇體積分?jǐn)?shù)60%、料液比1∶40(g/mL)、提取時間45 min、提取溫度70 ℃,在此條件下進(jìn)行驗(yàn)證實(shí)驗(yàn),柞蠶雄蛾黃酮的一次提取量可達(dá)3.72 mg/g。柞蠶雄蛾黃酮對自由基的清除能力較強(qiáng),均呈現(xiàn)出量效關(guān)系,其清除DPPH自由基、·OH、O2-·的IC50值分別為752.4、617.8、813.4 μg/mL,其中清除·OH能力要強(qiáng)于VC和2,6-二叔丁基-4-甲基苯酚,清除O2-·能力大于2,6-二叔丁基-4-甲基苯酚。表明柞蠶雄蛾黃酮具有較強(qiáng)的體外抗氧化活性。
柞蠶雄蛾;黃酮;提取;體外抗氧化活性
柞蠶雄蛾屬節(jié)肢動物門昆蟲綱鱗翅目天蠶蛾科柞蠶(Anfheraea pernyi Guerrin Meneville),是一種在我國具有悠久養(yǎng)殖歷史的藥食兩用經(jīng)濟(jì)昆蟲,屬完全變態(tài)昆蟲。起源于中國,分布遼闊,南起云南高原,北至黑龍江,東起山東半島,西至甘肅河西走廊[1]。柞蠶雄蛾營養(yǎng)物質(zhì)豐富,干物質(zhì)中含粗蛋白40.49%,氨基酸種類齊全、比例適當(dāng),高于世界衛(wèi)生組織和聯(lián)合國糧農(nóng)組織(WHO/FAO)推薦的蛋白質(zhì)氨基酸記分模式[3],脂肪酸含量中不飽和脂肪酸占78.6%、必需脂肪酸占43%,超過了《食物成分表》中的任何一種動物的脂肪酸含量[4]。柞蠶雄蛾還含有豐富的礦物質(zhì)、微量元素、維生素、和激素類等其他活性物質(zhì)[2],特別是柞蠶雄蛾中含有豐富的黃酮類化合物,這在動物中不多見。雄蠶蛾藥用功效在《本草綱目》早有記載“雄原蠶蛾益精氣,強(qiáng)陰道,交接不倦,亦壯陽事,止泄精、尿血、暖水臟,治暴風(fēng)、金瘡、凍瘡、湯火瘡,滅瘢痕”[5]。其已被證明具有保肝降酶、增強(qiáng)機(jī)體免疫力、降血脂血糖、抗衰老及抗腫瘤等多種功能特性[4]。
研究開發(fā)生物源的保健品,一直都是保健食品領(lǐng)域所關(guān)注的熱點(diǎn)問題。黃酮類化合物已被證明在生物體內(nèi)具有明顯的預(yù)防心血管疾病、降血壓、抗風(fēng)濕[6]、抗病毒、抗炎抗菌[7]、調(diào)節(jié)機(jī)體免疫力、抗氧化[8]、防癌抗癌[9]等諸多功效。目前,人們對植物體內(nèi)黃酮類化合物的研究很多[10-11],而對動物,特別是昆蟲體內(nèi)黃酮類化合物的研究甚少。近年來,對于柞蠶雄蛾的研究主要涉及雄蛾濃縮液[12]、油[13]、蛋白[14]、激素[15]、保健酒[16]等的提取或制備工藝,未見有對柞蠶雄蛾黃酮提取及其抗氧化活性進(jìn)行研究的報道。本實(shí)驗(yàn)利用超聲波輔助提取技術(shù),對柞蠶雄蛾黃酮的提取工藝及體外抗氧化活性進(jìn)行研究,以期探究柞蠶雄蛾抗氧化功能協(xié)同作用機(jī)制,并為柞蠶雄蛾在食品相關(guān)領(lǐng)域的綜合開發(fā)利用提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
1.1.1 原料
新鮮柞蠶雄處女蛾 遼寧省柞蠶研究所。
1.1.2 試劑
蘆丁標(biāo)準(zhǔn)品 中國醫(yī)藥上海化學(xué)試劑公司。
石油醚(沸程60~90 ℃)、甲醇、無水乙醇、抗壞血酸(VC)、2,6-二叔丁基-4-甲基苯酚(2,6-di-tertbutyl-4-methylphenol,BHT)、亞硝酸鈉、硝酸鋁、氫氧化鈉、鄰苯三酚、三羥甲基氨基甲烷(Tris)、磷酸氫二鈉、磷酸二氫鈉、三氯乙酸、硫代巴比妥、硫酸鐵-EDTA 、雙氧水(H2O2)、2-脫氧核糖、乙醚、鎢酸鈉均為分析純試劑。
1.2 儀器與設(shè)備
SHB-III循環(huán)水式多用真空泵、RE-52A型旋轉(zhuǎn)蒸發(fā)器 上海亞榮生化儀器廠;3-15型臺式離心機(jī) 德國Sigma公司;U-3010紫外-可見分光光度計 日本日立公司;AS2060B型超聲波清洗器 天津奧特賽恩斯儀器有限公司。
1.3 方法
1.3.1 原料處理
新鮮柞蠶雄處女蛾速凍后于恒溫(70 ℃)干燥箱中烘干后粉碎備用。
1.3.2 黃酮類物質(zhì)的提取[17]
將研磨后的柞蠶雄蛾粉置于索氏提取器中,用石油醚溶劑于90 ℃條件下抽提至無色,除去脂肪。旋轉(zhuǎn)蒸發(fā)除去石油醚,以乙醇為提取劑,在超聲波輔助提取后將提取液用旋轉(zhuǎn)蒸發(fā)器在50 ℃條件下減壓濃縮,4 500 r/min離心10 min,吸取上清液作為樣液,放于4 ℃冰箱中保存?zhèn)溆谩?/p>
1.3.3 制備標(biāo)準(zhǔn)液
精密稱取120 ℃蘆丁標(biāo)準(zhǔn)品20 mg,用乙醇溶于100 mL容量瓶,定容至刻度,搖勻。對照液質(zhì)量濃度為0.2 g/L,置于4 ℃冰箱備用。
1.3.4 柞蠶雄蛾黃酮的鑒定及波長的選擇[18]
分別量取1 mL蘆丁標(biāo)準(zhǔn)品溶液和柞蠶雄蛾提取液,各用體積分?jǐn)?shù)70%乙醇溶液4 mL,加入至10 mL容量瓶中;再加入0.3 mL質(zhì)量分?jǐn)?shù)5%的亞硝酸鈉溶液,搖勻后靜置6 min;然后加入0.3 mL質(zhì)量分?jǐn)?shù)10%的硝酸鋁溶液,在搖勻后靜置6 min;最后加入4 mL 1.0 mol/L的氫氧化鈉溶液,加體積分?jǐn)?shù)70%乙醇溶液定容。搖勻后靜置15 min,在波長400~800nm范圍內(nèi)進(jìn)行全波長掃描。
掃描結(jié)果(圖1)所示,柞蠶雄蛾提取液和蘆丁標(biāo)準(zhǔn)溶液的可見吸收光譜相一致,且最大吸收峰值均在510 nm波長處左右,由此說明柞蠶雄蛾提取液中含有黃酮類化合物。

圖1 標(biāo)準(zhǔn)液與樣品液光譜掃描圖Fig.1 Absorption spectra of rutin standard solution and sample solution
1.3.5 標(biāo)準(zhǔn)曲線的制定
精密量取0、0.5、1.0、1.5、2.0、2.5 mL上述標(biāo)準(zhǔn)液于10 mL容量瓶中,以下同1.3.4節(jié)的步驟進(jìn)行。于510 nm波長處測定吸光度,用DPS軟件處理,繪制標(biāo)準(zhǔn)曲線,得到回歸方程為:Y=0.080 5X+0.000 4,相關(guān)系數(shù)R2=0.999 7。式中,Y為質(zhì)量濃度/(g/L),X為吸光度。1.3.6 柞蠶雄蛾黃酮含量的測定
將樣品提取液用乙醇定容于50 mL容量瓶中,從中取出1 mL樣液置容量瓶中。以后添加試劑及處理方法同1.3.4節(jié),在510 nm波長處測定其吸光度。根據(jù)標(biāo)準(zhǔn)曲線方程計算樣品中黃酮的提取量(mg/g)。
1.3.7 正交試驗(yàn)確定超聲波法提取柞蠶雄蛾總黃酮最佳工藝條件

表11 LL9(334)正交試驗(yàn)因素水平表Table 1 Factors and levels used for L9(34) orthogonal desiggnn
在相同原料的基礎(chǔ)上,首先確定選擇用乙醇溶液作為提取劑,提取次數(shù)為2 次。然后選擇乙醇的體積分?jǐn)?shù)、料液比、提取時間、提取溫度4 個因素作為影響柞蠶雄蛾總黃酮提取率的研究對象,在單因素試驗(yàn)基礎(chǔ)之上設(shè)計出因素水平表,以柞蠶雄蛾黃酮提取量作為考察的指標(biāo),進(jìn)行正交試驗(yàn),確定超聲波法提取柞蠶雄蛾總黃酮最佳工藝條件。正交試驗(yàn)因素水平見表1。
1.3.8 體外抗氧化活性的測定
將柞蠶雄蛾黃酮配制成不同質(zhì)量濃度的黃酮溶液,對其體外抗氧化能力進(jìn)行研究,且與同等條件下VC、BHT的抗氧化能力進(jìn)行對比。
1.3.8.1 柞蠶雄蛾黃酮還原能力的測定
參照Tsai等[19]的方法,采用氰鐵化鉀還原法進(jìn)行評價。
1.3.8.2 柞蠶雄蛾黃酮清除DPPH自由基能力的測定[20-21]
精確吸取等體積的不同質(zhì)量濃度樣品試液及2×10-4mol/L DPPH溶液各2 mL于試管中,搖勻,室溫條件下放置30 min,測定其在517 nm波長處的吸光度(Ax);后用無水乙醇加入DPPH溶液作為空白參照組(A0);用2.0 mL不同質(zhì)量濃度的樣品試液與2.0 mL的無水乙醇混合溶液作為樣品對照(Ay);用無水乙醇來校正分光光度計零點(diǎn),陽性對照為VC溶液和BHT溶液,平行測定3 次。DPPH自由基清除率計算見式(1)。

1.3.8.3 柞蠶雄蛾黃酮清除·OH能力的測定[22-23]
取0.2 mL樣液、1.0 mL pH 7.4濃度為0.2 mol/L磷酸緩沖液、0.20 mL 10 mmol/L的2-脫氧核糖溶液、0.20 mL 10 mmol/L的硫酸鐵-EDTA溶液、0.2 mL去離子水,混勻,放入水浴鍋中37 ℃恒溫水浴1 h,后加入0.2 mL 10 mmol/L的H2O2,計時1 h后加入1.0 mL 28 mg/mL的三氯乙酸及1.0 mL 10 mg/mL硫代巴比妥結(jié)束反應(yīng),于100 ℃水浴10 min。然后冰浴至室溫,在532 nm波長處測定吸光度。陽性對照為VC溶液和BHT溶液,平行測定3 次。·OH清除率計算見式(2)。

式中:A0表示不添加樣品時吸光度;Ax表示樣品的吸光度;Ay表示空白的吸光度。
1.3.8.4 柞蠶雄蛾黃酮O2-·清除作用的測定[24-25]
取pH8.2的Tris-HCl緩沖液和50 mmol/L鄰苯三酚在25 ℃條件下水浴保溫10 min,然后取5.0 mL pH 8.2的Tris-HCl緩沖液,加入5 μL 50 mmol/L鄰苯三酚,搖勻,在325 nm波長處立即測定吸光度,每隔1 min測一次吸光度(A),以pH 8.2的Tris-HCl緩沖液為空白,自氧化速率控制在0.060~0.065 A值/min,以測定15 min內(nèi)平均吸光度計。加入樣品后,氧化率的測定:取5.0 mL pH 8.2的Tris-HCl緩沖液,加不同質(zhì)量濃度的待測樣品0.5 mL和5 μL 50 mmol/L的鄰苯三酚溶液(樣品對照組用pH 8.2的Tris-HCl緩沖液來代替),搖勻,然后按上述方法立即進(jìn)行測定(用pH 8.2的Tris-HCl緩沖液作為空白對照組)。O2-·清除率計算見式(3)。

2 結(jié)果與分析
2.1 超聲波提取柞蠶雄蛾黃酮工藝的結(jié)果分析
2.1.1 提取溶劑的確定
在料液比1∶30、提取時間60 min、提取溫度70 ℃條件下,分別用水、甲醇、乙醇、乙酸乙酯、丙酮作為溶劑進(jìn)行提取,提取3 次,結(jié)果見圖2。

圖2 溶劑與黃酮提取量的關(guān)系Fig.2 Effect of solvents on the extraction yield of flavonoids
圖2 表明,在相同條件下,體積分?jǐn)?shù)70%的不同溶劑對柞蠶雄蛾黃酮提取量:70%甲醇(3.09 mg/g)>70%丙酮(3.05 mg/g)>70%乙醇(3.03 mg/g)>70%乙酸乙酯(2.65 mg/g)>水(1.36 mg/g)。若選用甲醇、丙酮作為提取溶劑,雖然提取效果不錯,但是有毒。用乙醇作為溶劑的提取量也較高,與甲醇、丙酮提取量差別非常小,且無毒,考慮無害生產(chǎn)及成本的問題,選用70%乙醇作為提取溶劑。
2.1.2 提取次數(shù)的確定
在70%乙醇、料液比1∶30、提取時間60 min、提取溫度70 ℃條件下,重復(fù)提取4 次,測定不同提取次數(shù)對柞蠶雄蛾黃酮提取量的影響,結(jié)果如表2所示。

表2 提取次數(shù)對黃酮提取量的影響Table 2 Effect of number of extraction cycles on the extraction yield of flavonoids
從表2可以看出,超聲波對于柞蠶雄蛾黃酮提取效果較好,一次提取就基本可以提取出將絕大部分雄蛾黃酮,兩次提取以后提取量增長幅度特別小,且能耗較大,造成浪費(fèi),所以綜合考慮,確定提取2 次為宜。
2.1.3 溶劑體積分?jǐn)?shù)的確定
在料液比1∶30、提取時間60 min、提取溫度70 ℃條件下,分別以35%、50%、65%、80%、95%五個不同體積分?jǐn)?shù)的乙醇溶液進(jìn)行提取,提取2 次,測定不同乙醇體積分?jǐn)?shù)對柞蠶雄蛾黃酮提取量的影響,結(jié)果見圖3。
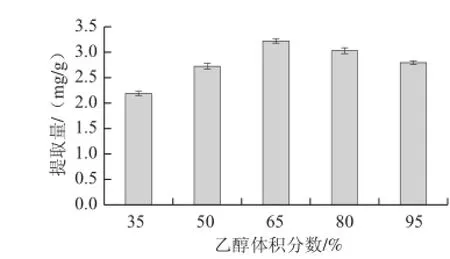
圖3 乙醇體積分?jǐn)?shù)對黃酮提取量的影響Fig.3 Effect of ethanol concentration on the extraction yield of flavonoids
由圖3可以看出,乙醇體積分?jǐn)?shù)在65%時柞蠶雄蛾黃酮提取量最大,所以選擇65%的乙醇作為提取溶劑為宜。
2.1.4 料液比的確定
在65%乙醇、提取時間60 min、提取溫度70 ℃條件下,分別以1∶10、1∶15、1∶25、1∶35、1∶45五個不同料液比進(jìn)行提取,提取2 次,測定不同料液比對柞蠶雄蛾黃酮提取量的影響,結(jié)果見圖4。
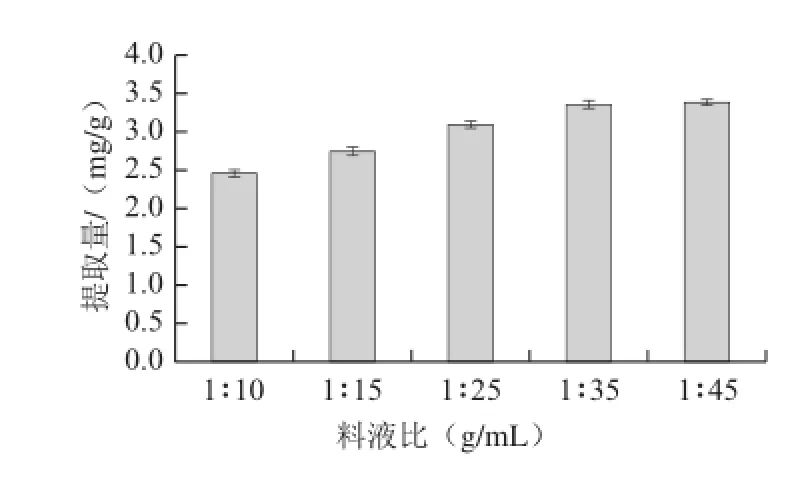
圖4 料液比對黃酮提取量的影響Fig.4 Effect of material/liquid ratio on the extraction yield of flavonoids
從圖4可知,柞蠶雄蛾黃酮的提取量在同一條件下,隨著液體量的增大而逐漸增加,料液比1∶45(提取量3.38 mg/g)與1∶35(提取量3.35 mg/g)相比提取量雖有增長,但差異較小,考慮原料試劑等生產(chǎn)成本,避免浪費(fèi),宜選擇1∶35作為料液比。
2.1.5 超聲波提取時間的確定
在65%乙醇、料液比1∶35、提取溫度70 ℃條件下,分別超聲波提取15、30、45、60、75 min,提取2 次,測定不同提取時間對柞蠶雄蛾黃酮提取量的影響,結(jié)果見圖5。

圖5 提取時間對黃酮提取量的影響Fig.5 Effect of extraction time on the extraction yield of flavonoids
從圖5可以看出,柞蠶雄蛾黃酮提取量隨著提取時間的延長而逐漸增長,其中在45 min之前提取量的增長比較顯著,隨后增長幅度較小,趨于穩(wěn)定。在提取時間為45 min時雄蛾黃酮的提取量為3.53 mg/g,與60 min(提取量3.55 mg/g)和75 min(提取量3.56 mg/g)時的提取量差異較小,綜合考慮減少能耗、減少工時、避免浪費(fèi),選擇45 min作為提取時間為宜。
2.1.6 提取溫度的確定
在65%乙醇、料液比1∶35、提取時間45 min條件下,分別以50、60、70、80、90 ℃五個不同提取溫度進(jìn)行提取,提取2 次,測定不同提取溫度對柞蠶雄蛾黃酮提取量的影響,結(jié)果見圖6。
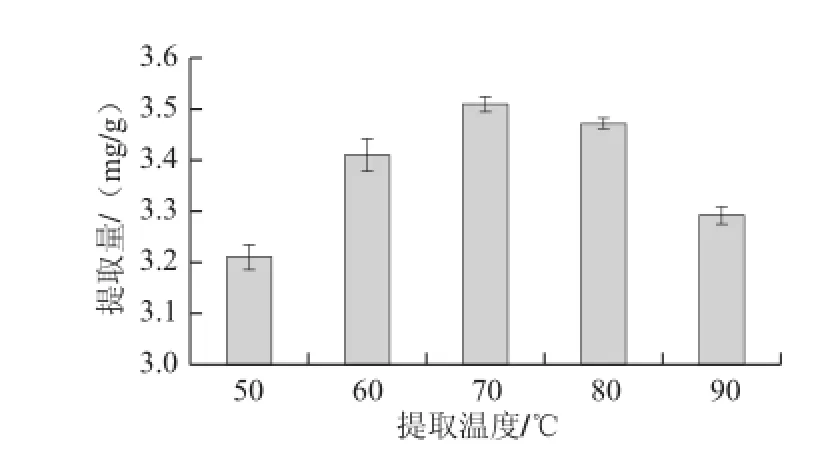
圖6 提取溫度對黃酮提取量的影響Fig.6 Effect of extraction temperature on the extraction yield of flavonoids
由圖6可以看出,提取溫度在70 ℃時柞蠶雄蛾黃酮提取量最大,所以選擇70 ℃作為提取溫度為宜。
2.1.7 正交試驗(yàn)結(jié)果分析
從表3正交分析結(jié)果可以看出,乙醇體積分?jǐn)?shù)對柞蠶雄蛾黃酮提取起主要作用,其次是料液比,提取時間和提取溫度基本無影響,各因素對柞蠶雄蛾總黃酮提取量的影響強(qiáng)弱順序?yàn)橐掖俭w積分?jǐn)?shù)>料液比>提取時間>提取溫度。就提取時間看來,45 min和60 min相比,提取量基本相同,并沒有較大差別,為了節(jié)約能耗,選擇提取時間為45 min。綜合考慮,超聲波提取柞蠶雄蛾黃酮的最佳工藝組合為A1B3C2D2,即乙醇體積分?jǐn)?shù)60%、料液比1∶40、提取時間45 min、提取溫度70 ℃,在此條件下進(jìn)行放大實(shí)驗(yàn),柞蠶雄蛾總黃酮的一次提取量可達(dá)3.72 mg/g。

表3 正交試驗(yàn)設(shè)計及結(jié)果(n=3)Table 3 Results of orthogonal array design (n=3)
2.2 柞蠶雄蛾黃酮的體外抗氧化活性測定結(jié)果
2.2.1 柞蠶雄蛾黃酮還原能力
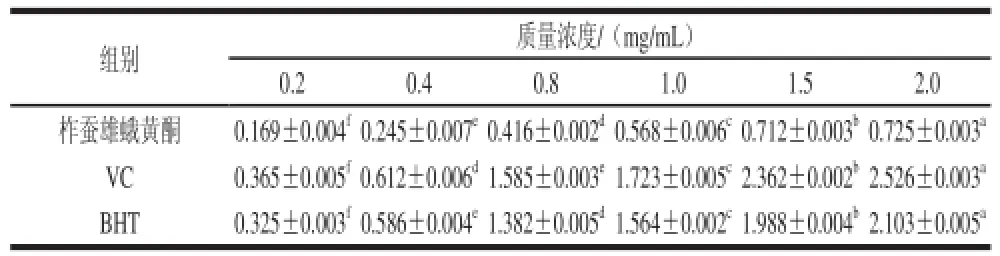
表4 柞蠶雄蛾黃酮還原力的測定結(jié)果Table 4 Reducing power of the flavonoids from male tussah moth
從表4可知,隨著柞蠶雄蛾黃酮質(zhì)量濃度的增加,還原力在不斷增大,還原力與雄蛾黃酮質(zhì)量濃度呈正相關(guān)。在0.2~1.5 mg/mL的范圍內(nèi),雄蛾黃酮的還原力增加迅速,后逐漸趨于穩(wěn)定。但其還原力明顯要低于VC和BHT,2.0 mg/mL的雄蛾黃酮的還原力僅為0.725,而0.8 mg/mL的VC和BHT的還原力就已分別達(dá)到1.585和1.382。
2. 2.2 柞蠶雄蛾黃酮清除DPPH自由基能力

圖7 柞蠶雄蛾黃酮對DPPH自由基清除率Fig.7 Scavenging activity of the flavonoids from tussah male moth against DPPH radical
如圖7所示,雄蛾黃酮類對DPPH自由基有較高的清除率,在0.2~1.0 mg/mL質(zhì)量濃度范圍內(nèi)清除率增加迅速,隨著雄蛾黃酮質(zhì)量濃度的增加,對DPPH自由基的清除能力逐漸增強(qiáng),呈現(xiàn)出正相關(guān),雄蛾黃酮質(zhì)量濃度在3.0 mg/mL以后逐漸趨于穩(wěn)定,能達(dá)到82%以上,但在同等條件下,雄蛾黃酮對DPPH自由基的清除率低于BHT和VC,其清除DPPH自由基的IC50值為752.4 μg/mL,由此可表明雄蛾黃酮具有較好的抗氧化性。
2.2.3 柞蠶雄蛾黃酮清除·OH能力

圖8 柞蠶雄蛾黃酮對·OH清除率Fig.8 Scavenging activity of the flavonoids from male tussah moth against hydroxyl radical
通過圖8可以看出,隨著樣液質(zhì)量濃度的增加,對·OH的清除率呈逐漸上升趨勢,質(zhì)量濃度在1.0 mg/mL以前增長速度較快,且質(zhì)量濃度在1.0mg/mL時,雄蛾黃酮對·OH的清除能力已經(jīng)超過VC,質(zhì)量濃度在1.5 mg/mL時,雄蛾黃酮對·OH的清除能力超過BHT,質(zhì)量濃度在3.0mg/mL以上時,對·OH的清除能力基本趨于穩(wěn)定。可以看出雄蛾黃酮對·OH有較強(qiáng)的清除能力,在達(dá)到一定質(zhì)量濃度以后要優(yōu)于BHT和VC,其清除·OH的IC50值為617.8 μg/mL,表明其具有抗氧化能力。
2.2.4 柞蠶雄蛾黃酮清除O2-·能力

圖9 柞蠶雄蛾黃酮對·清除率Fig.9 Scavenging activitiy of the flavonoids from male tussah moth against superoxide anion radical
由圖9結(jié)果顯示,雄蛾黃酮對O2-·有較好的清除作用,在0.2~3.0 mg/mL區(qū)間內(nèi)的雄蛾黃酮對O2-·的清除率隨著質(zhì)量濃度的增加逐漸增加,呈現(xiàn)量效關(guān)系,3.0 mg/mL時清除率可達(dá)到83%,以后隨著質(zhì)量濃度的提高,清除率趨于平穩(wěn),同時通過陽性對比可以看出,雄蛾黃酮對O2-·的清除能力要強(qiáng)于BHT,低于VC,但相差不是特別大,其清除O2-·的IC50值為813.4 μg/mL。雄蛾黃酮存在對O2-·的抑制作用,說明它具有體外抗氧化活性。
3 結(jié) 論
超聲波輔助提取柞蠶雄蛾黃酮的最佳工藝條件為乙醇體積分?jǐn)?shù)60%、料液比1∶40、提取時間45 min、提取溫度70 ℃,在此條件下進(jìn)行放大實(shí)驗(yàn),柞蠶雄蛾總黃酮的一次提取量可達(dá)3.72 mg/g。各因素對提取率的影響主次順序?yàn)椋阂掖俭w積分?jǐn)?shù)>料液比>提取時間>提取溫度。柞蠶雄蛾黃酮體外抗氧化實(shí)驗(yàn)結(jié)果表明,柞蠶雄蛾黃酮具有較好的還原力,但稍差于VC和BHT;對DPPH自由基的清除有一定的效果,但能力差于VC和BHT;對·OH有較強(qiáng)的清除能力,當(dāng)雄蛾黃酮質(zhì)量濃度在1.5 mg/mL以上時,清除能力優(yōu)于VC和BHT;對O2-·有明顯的清除作用,當(dāng)雄蛾黃酮質(zhì)量濃度1.0 mg/mL以上時,清除能力優(yōu)于BHT。其清除DPPH自由基、·OH、O2-·的IC50值分別為752.4、617.8、813.4 μg/mL,清除能力在一定范圍內(nèi)隨雄蛾黃酮質(zhì)量濃度的升高而升高,均呈現(xiàn)出一定的量效關(guān)系。由此可知,柞蠶雄蛾黃酮具有較強(qiáng)的體外抗氧化活性。
科學(xué)已證明與自由基有關(guān)的疾病有上百種,其中包括對人類威脅最大的心腦血管病和腫瘤[21]。·OH、O2-·等活性氧自由基是在機(jī)體的代謝過程中產(chǎn)生的。在正常的生理狀態(tài)下,活性氧自由基會處于較低的水平,產(chǎn)生和與清除處于一種的動態(tài)平衡狀態(tài);但在某些病理狀態(tài)下,這種平衡將會被打破,從而導(dǎo)致機(jī)體的損傷,常常是造成細(xì)胞膜和生物大分子的損傷。柞蠶雄蛾黃酮清除自由基的原理是該化合物具有酚羥基,能與活性氧自由基發(fā)生反應(yīng),形成共振穩(wěn)定的半醌式自由基,從而中斷鏈?zhǔn)椒磻?yīng)。通過體外實(shí)驗(yàn),可以直觀地驗(yàn)證受試物的作用效果,為體內(nèi)實(shí)驗(yàn)的開展奠定了實(shí)驗(yàn)基礎(chǔ),對闡明其作用機(jī)制提供相應(yīng)的幫助和依據(jù)。黃酮類化合物在人體中是不能直接合成的,只能從食物中來獲得[26]。本實(shí)驗(yàn)對柞蠶雄蛾黃酮類物質(zhì)的提取及體外抗氧化活性研究,為更好的開發(fā)動物性黃酮資源提供了理論依據(jù)。柞蠶雄蛾黃酮的抗氧化能力可能是柞蠶雄蛾保肝降酶、增強(qiáng)機(jī)體免疫力、降血脂血糖、抗腫瘤及抗衰老等其他功能特性的作用機(jī)理之一,目前對于柞蠶雄蛾抗氧化功能的研究還基本處于一個表層階段,柞蠶雄蛾各種活性成分間的協(xié)同作用機(jī)制、構(gòu)效關(guān)系等均有待去進(jìn)一步的深入研究,以能夠?yàn)樽跣Q雄蛾功能性的進(jìn)一步開發(fā)利用提供更好的幫助。
[1] 王連珍. 現(xiàn)代中國柞蠶的地理分布[J]. 遼寧絲綢, 2000(4): 25-26.
[2] 顧美兒, 時連根, 傅淑清. 雄蠶蛾開發(fā)利用研究進(jìn)展[J]. 蠶桑通報, 2007, 38(1): 15-18.
[3] 劉軍, 廖森泰, 鄒宇曉, 等. 雄蠶蛾營養(yǎng)活性成分的提取方法及工藝條件優(yōu)化[J]. 蠶業(yè)科學(xué), 2013, 39(1): 146-151.
[4] 鄒德慶. 柞蠶雄蛾濃縮液2號的初步研究[D]. 北京: 中國農(nóng)業(yè)大學(xué), 2005: 3-4.
[5] 李時珍. 本草綱目[M]. 北京: 人民衛(wèi)生出版社, 1982: 2254-2255.
[6] ZHANG Shouqin, XU Jun, WANG Changzheng. High hydrostatic pressure extraction of flavonoids from propolis[J]. Journal of Chemical Technology and Biotechnology, 2005, 80(1): 50-54.
[7] TANG Baokun, LEE Yujin, LEE Yuri, et al. Examination of 1-methylimidazole series ionic liquids in the extraction of flavonoids from Chamaecyparis obtuse leaves using a response surface methodology[J]. Journal of Chromatography B, 2013, 933: 8-14.
[8] SHENG Zunlai, WAN Pengfei, DONG Chunliu, et al. Optimization of total flavonoids content extracted from Flos Populi using response surface methodology[J]. Industrial Crops and Products, 2013, 43: 778-786.
[9] ROUTRAY W, ORSAT V. Microwave-assisted extraction of flavonoids: a review[J]. Food Bioprocess Technology, 2012, 5(2): 409-424.
[10] SALLEH L M, RAHMAN R A, SELAMAT J, et al. Supercritical carbon dioxide extraction of bioactive flavonoid from Strobilanthes crispus[J]. Food and Bioproducts Processing, 2010, 88(2): 319-326.
[11] TANG Hongmei, CHANG Lixin, DING Cunbao, et al. Process research on the reflux extraction of flavonoids from rubus crataegifolius leaves[J]. Medicinal Plant, 2012, 3(6): 58-63.
[12] 鄒德慶, 范作卿, 李智峰, 等. 柞蠶雄蛾濃縮液生產(chǎn)的部分工藝條件改進(jìn)與產(chǎn)品質(zhì)量檢測[J]. 蠶業(yè)科學(xué), 2012, 38(5): 942-948.
[13] 高曉旭. 柞蠶雄蛾油的提取及應(yīng)用研究[D]. 沈陽: 沈陽農(nóng)業(yè)大學(xué), 2006: 14-15.
[14] 張鷺, 唐道邦, 肖更生, 等. 雄蠶蛾蛋白制備功能性多肽酶解條件優(yōu)化研究[J]. 食品科學(xué), 2008, 29(12): 417-421.
[15] 都興范, 李樹英, 李亞潔, 等. 柞蠶雄蛾類甾體激素的分析研究[J].遼寧農(nóng)業(yè)科學(xué), 2005(2): 44-45.
[16] 蘇明利, 蔡勇, 吳健輝, 等. 雄蠶蛾酒及其生產(chǎn)方法: 中國, 200910265089.3[P]. 2009-12-30.
[17] 藏楠, 王學(xué)英, 孫佳, 等. 不同品種不同發(fā)育時期的柞蠶幼蟲黃酮類化合物的提取及含量變化[J]. 食品研究與開發(fā), 2008, 29(5): 35-38.
[18] 汪璇, 張建新, 孫長江, 等. 響應(yīng)面法優(yōu)化黃粉蟲黃酮提取工藝[J].食品科學(xué), 2013, 34(4): 11-16.
[19] TSAI S Y, HUANG S J, MAU J L. Antioxidant properties of hot water extracts from Agrocybe cylindracea[J]. Food Chemistry, 2006, 98(4): 670-677.
[20] SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4): 1202-1205.
[21] 夏道宗, 王慧銘, 任琪雅, 等. 高良姜總黃酮的超聲萃取及其體外抗氧化作用研究[J]. 中國食品學(xué)報, 2009, 9(3): 63-68.
[22] 馬虎飛, 王思敏, 楊章民. 陜北野生枸杞多糖的體外抗氧化研究[J].食品科學(xué), 2011, 32(3): 60-63.
[23] 周勸娥, 田呈瑞, 關(guān)為, 等. 陜西苦菜葉總黃酮的提取及抗氧化活性的測定[J]. 食品工業(yè)科技, 2013, 34(9): 97-101.
[24] 古麗巴哈爾·阿巴拜克力. 新疆瑣瑣葡萄葉總黃酮提取工藝及抗氧化活性[J]. 食品科學(xué), 2013, 34(12): 104-108.
[25] 帕爾哈提·柔孜, 阿依姑麗·艾合麥提, 朱昆, 等. 玫瑰花瓣總黃酮和總多糖的體外抗氧化研究[J]. 食品科學(xué), 2013, 34(11): 138-141.
[26] 潘亞平, 張振海, 丁冬梅, 等. 黃酮類化合物腸道細(xì)菌生物轉(zhuǎn)化的研究進(jìn)展[J]. 食品工業(yè)科技, 2013, 38(19): 3239-3245.
Ultrasound-Assisted Extraction and Antioxidant Activity in vitro of Flavonoids from Male Tussah Moth
TIAN Ye, YUE Xi-qing*, YANG Mei
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Objective: To investigate the extraction and antioxidant effects of flavonoids from male tussah moth. Methods: Flavonoids were ultrasonically extracted from male tussah moth with ethanol. The extract was analyzed qualitatively by UV-visible absorption spectroscopy. The optimum extraction conditions were determined by orthogonal array design. The antioxidant activity of flavonoids from male tussah moth investigated by comparing the reducing power and radical scavenging effects against DPPH, hydroxyl and superoxide anion radicals with those of VC and BHT in vitro. Results: The optimum extraction conditions were as follows: ethanol concentration 60%, solid/solvent ratio 1:40, extraction time 45 min and temperature 70 ℃. Under the optimized conditions, the yield of total flavonoids from male tussah moth was 3.72 mg/g in one extraction cycle. The extracted fl avonoids had potent radical scavenging activity in a dose-dependent manner against DPPH, hydroxyl and superoxide anion radicals, and its IC50was 752.4, 617.8 and 813.4 μg/mL, respectively. The hydroxyl radical scavenging activity was stronger than that of VC and BHT, and the superoxide anion radical activity was stronger than that of BHT. Conclusion: Flavonoids from male tussah moth had strong antioxidant effects in vitro.
male tussah moth; flavonoids; extraction; antioxidant activity in vitro
S885.1
A
1002-6630(2014)16-0085-06
10.7506/spkx1002-6630-201416016
2013-10-23
田野(1988—),男,碩士研究生,研究方向?yàn)閯游镄允称房茖W(xué)利用技術(shù)。E-mail:tianye74123@126.com
*通信作者:岳喜慶(1966—),男,教授,博士,研究方向?yàn)樾螽a(chǎn)品加工。E-mail:yxqsyau@126.com

