鴨肉肌動球蛋白解離的影響因素研究
董 晗,王道營,張牧焓,諸永志,徐為民,*,劉 芳
(1.江蘇省農業科學院農產品加工研究所,江蘇 南京 210014;2.南京財經大學食品科學與工程學院,江蘇 南京 210046)
鴨肉肌動球蛋白解離的影響因素研究
董 晗1,2,王道營1,張牧焓1,諸永志1,徐為民1,*,劉 芳1
(1.江蘇省農業科學院農產品加工研究所,江蘇 南京 210014;2.南京財經大學食品科學與工程學院,江蘇 南京 210046)
研究可能影響鴨肉肌動球蛋白解離的多種因素,包括內部因素(AMP、IMP、ADP、ATP、Ca2+、)和外部因素(NaCl腌制、不同種類磷酸鹽腌制)。以肌動球蛋白提取物和鴨肉為原料,主要應用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和蛋白質印跡(Western blotting)法進行檢測。結果表明:在4℃條件下,經過8、16 mmol/L的AMP、IMP處理和25~50 mmol/L處理的肌動球蛋白,檢測到肌動蛋白條帶濃度明顯增加;經過8、16 mmol/L ADP處理和0.1~5.0 mmol/L Ca2+處理后的肌動球蛋白,檢測到肌動蛋白條帶濃度無明顯變化。腌制對肌動球蛋白解離無明顯影響。
鴨肉;肌動球蛋白;解離;影響因素
鴨肉及其制品深受中國人廣泛喜愛,人們通常以肉品嫩度來評定肉制品品質[1-4]。因此,如何改善肉制品的嫩度成為提高肉品品質的關鍵問題。一般認為,肉在加熱后,肉中膠原蛋白凝膠化使得肉質變嫩[5-9];但經過實驗研究,加熱的另一影響是促進了肌動球蛋白解離[10-11]。因此推斷,肌動球蛋白的解離能夠改善肉品嫩度,實驗擬對鴨肉中肌動球蛋白解離規律及影響肌動球蛋白解離的因素進行研究,進而揭示肌動球蛋白解離與嫩度的關系。
肌動球蛋白是肌動蛋白與肌球蛋白發生結合后的復合物。肌動球蛋白的聚合度不同,因此它的分子質量也不確定。肌動蛋白與肌球蛋白的結合比例從1∶2.5到1∶4。肌動球蛋白的結合與解離與肌肉的收縮直接相關。肌球蛋白形狀類似“豆芽”,頭部為重酶解肌球蛋白,尾部為輕酶解肌球蛋白。肌球蛋白的頭部有ATP酶活性,可以催化ATP降解。肌動蛋白單獨存在時為球狀分子,稱為G-肌動蛋白,但在ATP和磷酸鹽的存在下,G-肌動蛋白聚會成F-肌動蛋白,后者可以與原肌球蛋白等結合生成細絲,參與肌肉的收縮過程[12]。在ATP的作用下,肌球蛋白與肌動蛋白結合成肌動球蛋白。
而在成熟過程中,肉的嫩度逐漸改善,可能原因也是各種因素作用于肌動球蛋白而使其發生解離作用。由此可見,肌動蛋白與肌球蛋白是否結合、結合是否緊密是決定肉品嫩度的關鍵因素[13]。因此,探究影響肌動球蛋白解離的因素成為眾多肉品科研工作者的工作重點。
現今已經研究發現的可以促進肌動球蛋白解離的因素有IMP和AMP[14],和焦磷酸鹽與MgCl2共存的情況下[15]。可能影響肌動球蛋白解離的其他多種因素還未有深入發現,因此,影響肌動球蛋白解離的因素還有待于進一步研究。
1 材料與方法
1.1 材料與試劑
鴨肉原料取自肉用麻鴨(3 kg左右),選自當地農貿市場(孝陵衛農貿市場),隨機選取40日齡左右健康肉用麻鴨6只,按企業的工藝要求,宰殺、放血、去毛,迅速剝離兩側胸肌,放置4℃條件下過夜成熟,待用。
抗兔骨骼肌肌動蛋白多克隆抗體、IMP、AMP、ADP、ATP 美國Sigma公司;羊抗兔IgG、DAB顯色試劑盒 巴傲得生物科技公司;Goat anti-GAPDH 美國Genscript公司;預熱寬范圍標準蛋白 加拿大Fermentas公司。
1.2 儀器與設備
HH-8數顯恒溫水浴鍋 常州國華電器有限公司;T-25數顯勻漿機 德國IKA公司;HI-9025酸度計 意大利Hanna公司;SPX-250B-Z生化培養箱 上海博訊有限公司;UniCenMR冷凍離心機 德國Herolab公司;UV-6100紫外-可見光分光光度計 上海元析儀器有限公司;Mini-PROTEAN Tetra Cell電泳儀、Semi-Dry轉印儀美國Bio-Rad公司;JS-680C全自動凝膠成像分析儀 上海培清科技有限公司。
1.3 方法
1.3.1 實驗設計
實驗共設兩組,一組以鴨胸肉肉糜提取的肌動球蛋白為實驗原料,驗證影響肌動球蛋白解離的內部因素:IMP、AMP、ADP、ATP、CaCl2、Na3PO4;另一組以完整鴨胸肉塊為實驗原料,驗證影響肌動球蛋白解離的外部因素:NaCl腌制、磷酸鹽腌制。
1.3.2 前處理方法
內部因素組:準確吸取0.5 mL肌動球蛋白溶液,放入1.5 mL離心管,分別加入1 mL不同濃度的IMP、AMP、ADP、ATP、CaCl2、Na3PO4溶液,4℃條件下振蕩反應16 h。反應完畢后,離心分離,取0.2 mL上清液,用于十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)、蛋白質印跡(Western blotting)法檢測。
外部因素組:1)NaCl腌制:取完整的鴨胸肉,分別用NaCl干腌(胸肉表面撒鹽)15 h,濕腌(100℃飽和食鹽水,冷卻至室溫后腌制)15 h,干腌3 h后濕腌12 h,濕腌3 h后干腌12 h。2)混合磷酸鹽腌制:取完整的鴨胸肉,并取3種不同的磷酸鹽(焦磷酸鈉、三聚磷酸鈉、六偏磷酸鈉)分別溶于5 mL蒸餾水中。用5 mL注射器分別向鴨胸肉注入焦磷酸鈉溶液、三聚磷酸鈉溶液、六偏磷酸鈉溶液。磷酸鹽的用量為0.4 g/100 g鴨肉,腌制24 h。注射期間進行2~3次滾揉,以利于磷酸鹽均勻分布。
鴨肉腌制后,提取肌動蛋白溶液,進行SDS-PAGE分析。
相關溶液配制方法:IMP溶液配制:20mmol/L Tris-HCl,3 mmol/L NaN3,x mmol/L IMP(x為IMP濃度,x = 0、12、24),pH 7.2。
AMP、ADP、ATP溶液配制:同IMP溶液。
Na3PO4溶液配制:20 mmol/L Tris-HCl,xmmol/L Na3PO4(x為Na3PO4濃度,x = 0、7.5、15、37.5、75),pH 7.2。
CaCl2溶液配制:20mmol/L Tris-HCl,xmmol/L CaCl2(x為CaCl2濃度,x = 0、0.15、0.3、0.75、1.5、3、7.5),pH 7.2。
100℃飽和食鹽水:燒杯中加一定量的水,煮沸后向其中加熱NaCl固體,不停攪拌,直到有固體未溶解,且等足夠長時間仍未溶解,過濾得濾液,即為100℃飽和食鹽水。
1.3.3 肌動球蛋白和肌動蛋白提取方法
肌動球蛋白的提取方法為,參考Okitani等[11,14]的方法,并稍作修改。具體為2 g新鮮鴨肉肉糜溶于20 mL Weber-Edsall溶液(0.6 mol/L KCl、0.04 mol/L NaHCO3、0.01 mol/L Na2CO3,pH 7.2),12 000 r/min勻漿2次(每次30 s,中間間隔10 s)。勻漿后溶液置于4℃培養箱內,搖床振蕩24 h。過濾后,4℃、12 000×g離心20 min,棄去上清液,沉淀溶于20 mL Weber-Edsall溶液,振蕩混勻后,4℃、12 000×g離心20 min,棄去上清液,沉淀溶于5 mL Tris-HCl緩沖溶液(20 mmol/L Tris-HCl、0.6 mmol/L KCl,pH 7.2)即得肌動球蛋白溶液。利用考馬斯亮藍法測定蛋白質量濃度后,并調整質量濃度為10 mg/mL,立即使用。
肌動蛋白的提取方法與肌動球蛋白提取方法類似。具體為2 g新鮮鴨肉肉糜溶于20 mL Weber-Edsall溶液(0.6 mol/L KCl、0.04 mol/L NaHCO3、0.01 mol/L Na2CO3,pH 7.2),12 000 r/min勻漿2次(每次30 s,中間間隔10 s)。勻漿后溶液置于4℃培養箱內,搖床振蕩24 h。過濾后,用蒸餾水使KCl濃度調整到0.2 mol/L。取其中0.2 mL樣品Ⅰ(肉樣勻漿稀釋液,即為肌肉全蛋白提取液)用于電泳檢測總蛋白,剩余部分于4℃、12 000×g離心20 min,取0.2 mL樣品Ⅱ(離心上清液,即為肌動蛋白 提取液)并加入0.4 mL上樣緩沖液制成電泳樣品。
1.3.4 檢測方法
采用Western blotting法檢測提取液中肌動蛋白含量。采用變性不連續電泳,分離膠12%,濃縮膠5%(丙烯酰胺與甲叉雙丙烯酰胺質量比為36.5∶1)。電泳分離后用半干轉膜儀將凝膠中的蛋白轉印到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,Tris-HCl緩沖溶液+吐溫溶液(TBST溶液)漂洗(3次,每次5 min)。轉印后的PVDF膜用含有5 g/100 mL脫脂奶粉的TBST溶液(0.05%吐溫-20、50 mmol/L Tris-HCl、150 mmol/L NaCl、5 mmol/L KCl,pH 7.4)室溫封閉1 h,膜漂洗3次后與一抗(一抗為抗兔骨骼肌肌動蛋白多克隆抗體,用含有5 g/100 mL脫脂奶粉的TBST溶液1∶1 000稀釋)結合,4℃搖床孵育過夜,然后膜漂洗3次后與二抗(二抗為辣根過氧化酶連接的羊抗兔IgG,用含有5 g/100 mL脫脂奶粉的TBST溶液1∶5 000稀釋)結合,室溫搖床孵育1 h,膜漂洗后使用DAB顯色劑顯色,顯色后蒸餾水徹底沖洗停止反應,并使用凝膠成像儀拍照。實驗選用GAPDH作為內參蛋白。Quantity One軟件掃描蛋白免疫印跡條帶,得出光密度值用于數據分析。
1.4 數據分析
所有圖片使用Quantity One處理分析,所有數據以表示,所得數據使用SPSS18.0進行單因素方差分析。不同處理組間差異分析采用單因素方差分析,用Duncan’s多重比較,α = 0.05。定量分析統計圖使用Sigma Plot繪制。
2 結果與分析
2.1 內部環境影響因素
2.1.1 IMP對鴨肉肌動球蛋白解離的影響
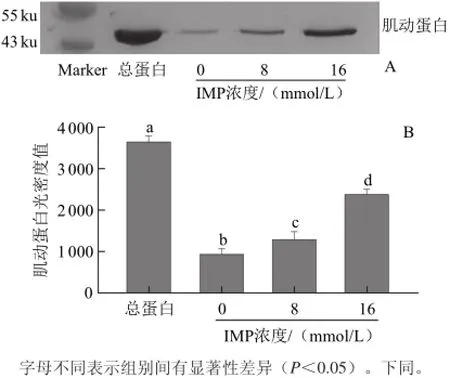
圖1 IMP 對肌動球蛋白解離影響的Western blotting轉印圖(A)和定量分析圖(B)Fig.1 Western blotting (A) and quantitative analysis (B) for the effect of IMP on actomyosin dissociation
由圖1A可知,對照組只有微弱的肌動蛋白條帶,在IMP的作用下,可以觀察到條帶濃度逐漸增大。由圖1B也得出相同結果,加入IMP后的肌動蛋白含量均高于對照組,并隨著IMP濃度的增加而增加,8 mmol/L IMP處理組顯著高于對照組(P<0.05),16 mmol/L處理組顯著高于8 mmol/L組與對照組(P<0.05)。
2.1.2 AMP對鴨肉肌動球蛋白解離的影響
由圖2A可知,對照組的肌動蛋白條帶濃度很低,在AMP的作用下,可以觀察到條帶濃度逐漸增大。由圖2B也得出相同結果,加入AMP后的肌動蛋白含量均高于對照組,并隨著AMP濃度的增加而增加,但是經過8mmol/L AMP處理的與對照組沒有顯著差異(P>0.05),16 mmol/L處理組顯著高于8 mmol/L組與對照組(P<0.05)。
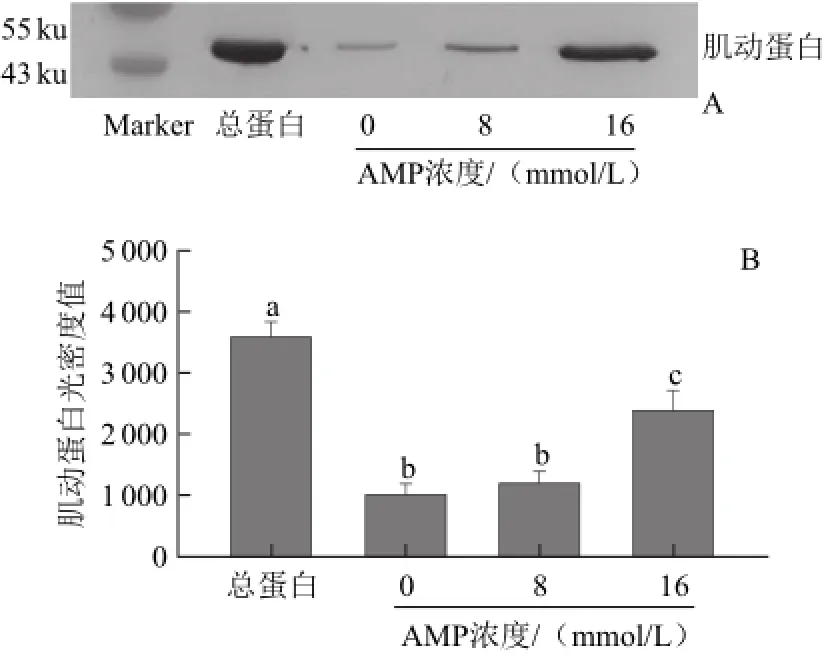
圖2 AMP對肌動球蛋白解離影響的Western blotting轉印圖(A)和定量分析圖(B)Fig.2 Western blotting (A) and quantitative analysis (B) for the effect of AMP on actomyosin dissociation
2.1.3 ADP對鴨肉肌動球蛋白解離的影響
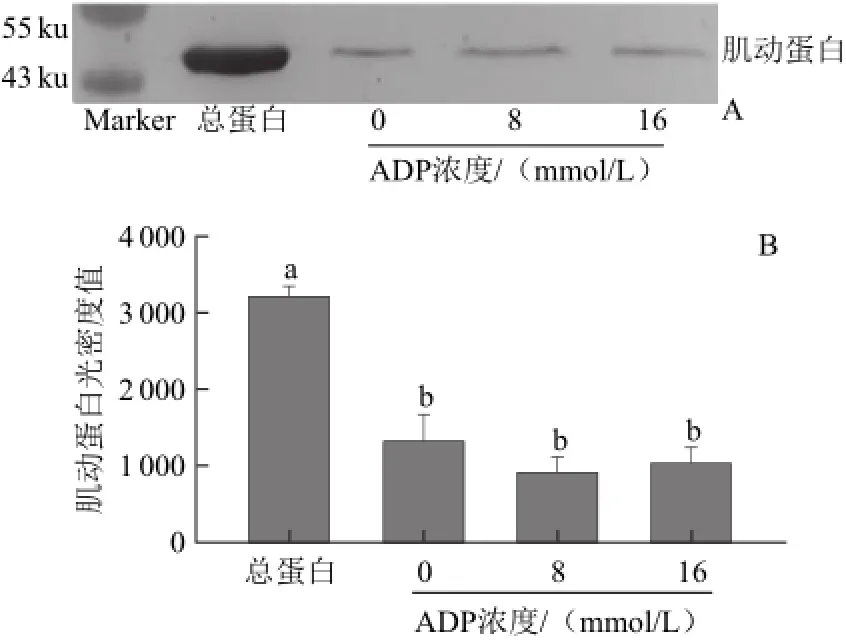
圖3 ADP對肌動球蛋白解離影響的Western blotting轉印圖(A)和定量分析圖(B)Fig.3 Western blotting (A) and quantitative analysis (B) for the effect of ADP on actomyosin dissociation
由圖3A可知,不同濃度ADP處理組與對照組的肌動蛋白條帶濃度都很低,并沒有觀察出ADP對肌動球蛋白的解離有任何影響。由圖3B也得出相同結果,加入8、16 mmol/L ADP的處理組與對照組沒有顯著差異(P>0.05)。
2.1.4 ATP對鴨肉肌動球蛋白解離的影響
由圖4可知,對照組可以檢測到微弱的肌動蛋白條帶,但經過ATP處理的肌動球蛋白提取液,卻檢測不到肌動蛋白的存在。

圖4 ATP對肌動球蛋白解離影響的Western blotting轉印圖Fig.4 Western blotting for the effect of ATP on actomyosin dissociation
2.1.5 Na3PO4對鴨肉肌動球蛋白解離的影響
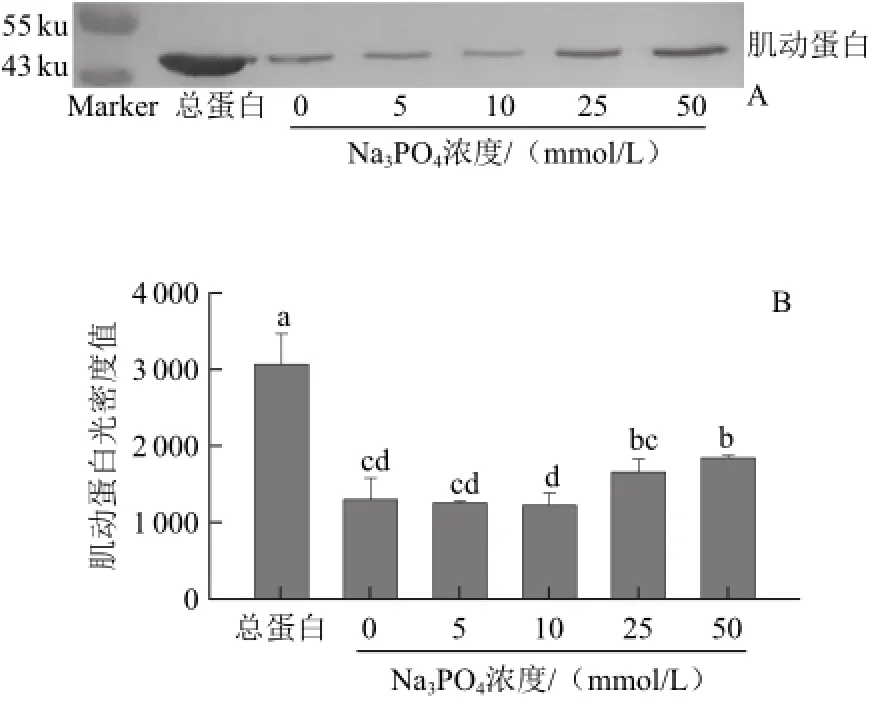
圖5 Na3PO4對肌動球蛋白解離影響的Western bloting轉印圖(A)和定量分析圖(B)Fig.5 Western blotting (A) and quantitative analysis (B) for the effect of Na3PO4on actomyosin dissociation
由圖5A可知,低濃度Na3PO4處理組條帶與對照組的肌動蛋白條帶濃度都很低,在Na3PO4濃度增加到25 mmol/L時,條帶濃度開始增大。由圖5B也得出相同結果,加入25 mmol/L Na3PO4處理的溶液中肌動蛋白含量高于對照組與低濃度的Na3PO4處理組,但與對照組無顯著差異(P>0.05),50 mmol/L處理組顯著高于對照組與低濃度處理組(P<0.05)。
2.1.6 CaCl2對鴨肉肌動球蛋白解離的影響
由圖6A可知,不同濃度CaCl2處理組與對照組的肌動蛋白條帶濃度相似,沒有明顯差別。由圖6B也得出相同結果,不同濃度CaCl2處理組與對照組中的肌動蛋白含量無顯著差異(P>0.05)。
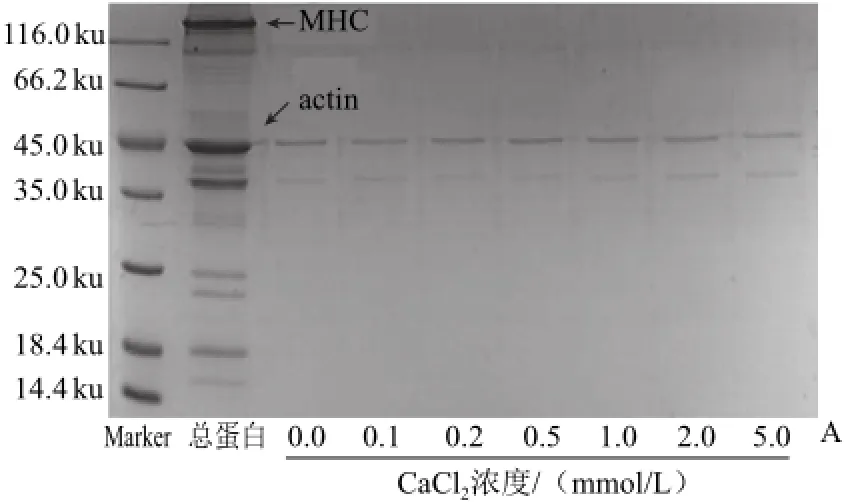
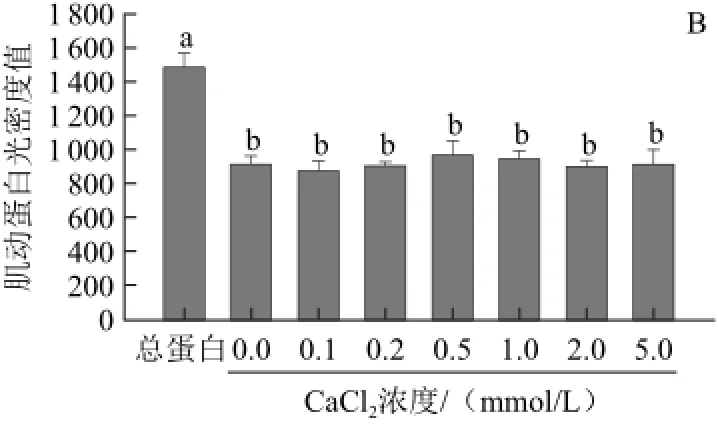
圖6 CaCCl2對肌動球蛋白解離影響的SDS-PAGGEE電泳圖(A)和定量分析圖(B)Fig.6 SDS-PAGE (A) and quantitative analysis (B) for the effect of CaCl2on actomyosin dissociation
2.2 外部環境影響因素
2.2.1 NaCl腌制對鴨肉肌動球蛋白解離的影響
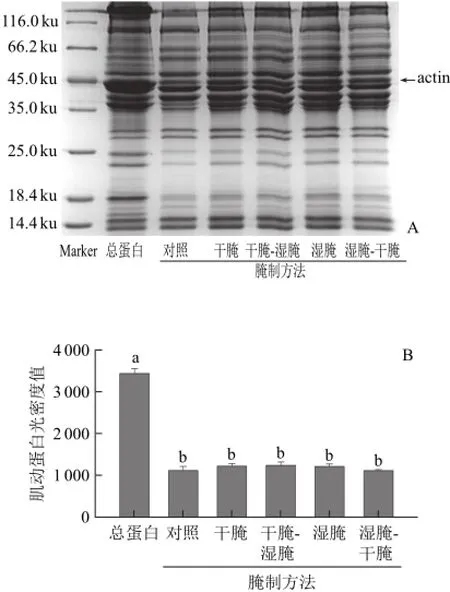
圖7 NaCl腌制對肌動球蛋白解離影響的SDS-PAGE電泳圖(A)和定量分析圖(B)Fig.7 SDS-PAGE (A) and quantitative analysis (B) for the effect of NaCl on actomyosin dissociation
由圖7A可知,腌制后的鴨肉肌動蛋白條帶濃度略高于對照組,不同腌制方法的條帶濃度沒有明顯的差別。由圖7B也得出相同結果,不同腌制方法與對照組中的肌動蛋白含量無顯著差異(P>0.05)。
2.2.2 磷酸鹽腌制對鴨肉肌動球蛋白解離的影響
由圖8A可知,不同的磷酸鹽腌制后的鴨肉,肌動蛋白條帶濃度相似。由圖8B也可得出此結果,不同磷酸鹽腌制的鴨肉中與對照組中的肌動蛋白含量無顯著差異(P>0.05)。
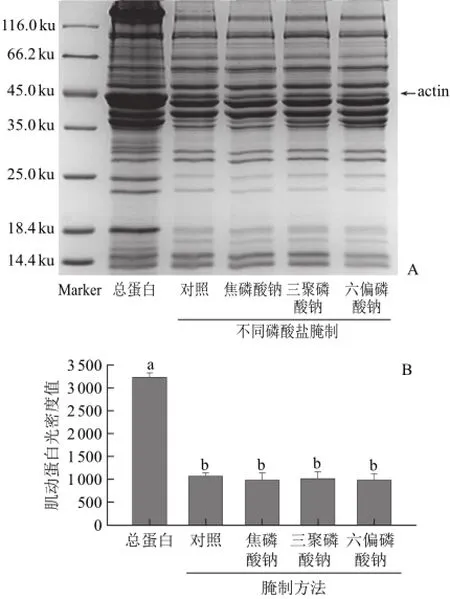
圖8 磷酸鹽腌制對肌動球蛋白解離影響的SDS-PAGE電泳圖(A)和定量分析圖(B)Fig.8 SDS-PAGE (A) and quantitative analysis (B) for the effect of phosphates on actomyosin dissociation
3 討 論
3.1 影響肌動球蛋白解離的內部因素
本實驗研究結果表明,鴨肉本身的內源物質,AMP、IMP和有助于肌動蛋白從肌動球蛋白上解離下來。而ADP、Ca2+和ATP對肌動球蛋白的解離沒有促進作用,反而ATP可以促進肌動蛋白和肌球蛋白結合生產肌動球蛋白。
實驗結果顯示,在較低溫度(4℃)條件下,用8 mmol/L和16 mmol/L的IMP和AMP處理的肌動球蛋白可以顯著的促進其解離,IMP和AMP的濃度越大,它對肌動球蛋白解離的促進作用就越明顯。這也與Okitani等[14]的研究結果相符,IMP和AMP是導致低溫貯存的骨骼肌中肌動球蛋白可逆解離的主要因素。
Benjakul等[15]研究發現,焦磷酸鹽與MgCl2共同作用可以導致肌動球蛋白發生自然解離,也就證明了是可以影響肌動球蛋白解離的因素之一。但是肉中雖然含有大量的礦物質,低濃度(<25 mmol/L)的對肌動球蛋白的解離仍然沒有促進作用。因此可以推測,鴨肉內源游離的可能達不到可以促進肌動球蛋白解離的程度,而本實驗中的25 mmol/L和50 mmol/L的高濃度促進了肌動球蛋白解離,可能是由于高濃度的離子,導致溶液的高強度的作用力將肌動蛋白從肌動球蛋白上分離下來。
沒有檢測出ADP和ATP對肌動球蛋白解離有促進作用,反而在ADP存在的情況下,肌動蛋白的含量低于對照組。由ATP處理后的肌動球蛋白無法檢測到肌動蛋白條帶,可以推測,在較低的溫度(4℃)條件下,肌動球蛋白的解離是可逆的,即溶液中的肌動蛋白與肌球蛋白在ATP的作用下重新結合生成肌動球蛋白。
肉成熟嫩化的機制——酶假說[16-17]與鈣理論[18-19],人們大多支持酶假說,認為Ca2+濃度升高激活鈣蛋白酶而改善了肉的嫩度,而Takahashi等[19-20]研究發現,在鈣蛋白酶不發揮作用的情況下,肌肉中Z盤的弱化就是Ca2+的作用。但是本實驗研究結果顯示,不同濃度的Ca2+對提取出來的肌動球蛋白解離沒有影響。這與鈣理論并不相符。
3.2 影響肌動球蛋白解離的外部因素
南京鹽水鴨以其肉質軟嫩而聞名,其制作過程的主要步驟之一就是用食鹽腌制,因此要考慮NaCl的腌制是否對肉的嫩度有影響。楊勇等[21]研究發現,各種鹽和酶都是具有嫩化效果的,焦磷酸鈉的嫩化效果是最好的。Benjakul等[15]研究發現,添加焦磷酸鹽與MgCl2可以引起肌動球蛋白發生自然解離。孫衛青等[22]也比較了混合磷酸鹽在鴨肉中的應用,并得到一定嫩度改善結果。因此NaCl與多種磷酸鹽對肉品的腌制是否影響肌動球蛋白解離有待研究。
但是實驗結果顯示,NaCl腌制與磷酸鹽腌制對鴨胸肉肌動球蛋白解離均沒有產生影響。最主要原因可能因為完整的鴨胸肉是完整的體系,而鹽溶液不能夠破壞肌纖維,更不能影響到肌肉的內部蛋白,即無法影響肌動球蛋白的解離。
4 結 論
本實驗對鴨肉中影響肌動球蛋白解離的多種因素進行研究,結果表明,IMP、AMP、高濃度對肌動球蛋白的解離有促進作用,但ADP、Ca2+、ATP、腌制對肌動球蛋白解離沒有明顯影響。由實驗結果看出,影響肌動球蛋白解離的小分子內部因素并不多,由此需要從另一角度進行更深入的研究,包括構成肌纖維的多種相關蛋白質和鴨肉內部的多種內源酶。這一研究成果將為今后建立肌動球蛋白解離的調控程序,探究肌動球蛋白解離與鴨肉嫩度之間的關系提供參考依據。
[1] BOLEMAN S J, BOLEMAN S L, MILLER R K, et al. Consumer evaluation of beef of known categories of tenderness[J]. Journal of Animal Science, 1997, 75(6): 1521-1524.
[2] 李超, 徐為民, 王道營, 等. 加熱過程中肉嫩度變化的研究[J]. 食品科學, 2009, 30(11): 263-265.
[3] LEE Y S, SAHA A, XIONG R, et al. Changes in broiler breast fillet tenderness, water-holding capacity, and color attributes during long-term frozen storage[J]. Journal of Food Science, 2008, 73(4): E162-E168.
[4] VASANTHI C, VENKATARAMANUJAM V, DUSHYANTHAN K. Effect of cooking temperature and time on the physico-chemical, histological and sensory properties of female carabeef (buffalo) meat[J]. Meat Science, 2007, 76(2): 274-280.
[5] LAAKKONEN E. Factors affecting tenderness during heating of meat[J]. Advances in Food Research, 1973, 20: 257-323.
[6] BOBACK S M, COX C L, OTT B D, et al. Cooking and grinding reduces the cost of meat digestion[J]. Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 2007, 148(3): 651-656.
[7] CHRISTENSEN M, PURSLOW P P, LARSEN L M. The effect of cooking temperature on mechanical properties of whole meat, single muscle fi bres and perimysial connective tissue[J]. Meat Science, 2000, 55(3): 301-307.
[8] POWELL T H, DIKEMAN M E, HUNT M C. Tenderness and collagen composition of beef semitendinosus roasts cooked by conventional convective cooking and modeled, multi-stage, convective cooking[J]. Meat Science, 2000, 55(4): 421-425.
[9] POWELL T H, HUNT M C, DIKEMAN M E. Enzymatic assay to determine collagen thermal denaturation and solubilization[J]. Meat Science, 2000, 54(4): 307-311.
[10] 董晗, 王道營, 張牧焓, 等. 不同加熱溫度對鴨肉肌動球蛋白解離的影響[J]. 食品工業科技, 2012, 33(20): 120-124.
[11] OKITANI A, ICHINOSE N, ITOH J, et al. Liberation of actin from actomyosin in meats heated to 65 ℃[J]. Meat Science, 2009, 81(3): 446-450.
[12] 周光宏. 肉品學[M]. 北京: 中國農業科技出版社, 1999.
[13] 李勝杰, 徐幸蓮, 周光宏. 宰后肌動球蛋白解離對肉品嫩度的影響研究進展[J]. 食品科學, 2010, 31(21): 442-445.
[14] OKITANI A, ICHINOSE N, KOZA M, et al. AMP and IMP dissociate actomyosin into actin and myosin[J]. Bioscience, Biotechnology, and Biochemistry, 2008,72(8): 2005-2011.
[15] BENJAKUL S, VISESSANGUAN W, AEWSIRI T, et al. Dissociation of natural actomyosin from kuruma prawn muscle induced by pyrophosphate[J]. Food Chemistry, 2007, 102(1): 295-301.
[16] KOOHMARAIE M, BABIKER A S, SCHROEDER A L, et al. Acceleration of postmortem tenderization in ovine carcasses through activation of Ca2+-dependent proteases[J]. Journal of Food Science, 1988, 53(6): 1638-1641.
[17] KOOHMARAIE M, BABIKER A S, MERKEL R A, et al. Role of Ca2+-dependent proteases and lysosomal enyzmes in postmortem changes in bovine skeletal muscle[J]. Journal of Food Science, 1988, 53(5): 1253-1257.
[18] HATTORI A, TAKAHASHI K. Calcium-induced weakening of skeletal muscle Z-disks[J]. Journal of Biochemistry, 1982, 92(2): 381-390.
[19] TAKAHASHI K, KIM O H, KOJI Y. Calcium-induced weakening of Z-disks in postmortem skeletal muscle[J]. Journal of Biochemistry, 1987, 101(3): 767-773.
[20] TAKAHASHI K, NAKAMURA F, OKAMOTO M. A myofibrillar component that modifies the actin-myosin interaction in postrigor skeletal muscle[J]. Journal of Biochemistry, 1982, 92(3): 809-815.
[21] 楊勇, 任健, 王存堂, 等. 鹽類和酶在鵝肉嫩化中的比較研究[J]. 食品研究與開發, 2010, 31(11): 34-39.
[22] 孫衛青, 吳冬. 混合磷酸鹽在鴨肉中的應用研究[J]. 食品科技, 2005(2): 64-66.
Factors Influencing the Dissociation of Duck Breast Muscle Actomyosin
DONG Han1,2, WANG Dao-ying1, ZHANG Mu-han1, ZHU Yong-zhi1, XU Wei-min1,*, LIU Fang1
(1. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210046, China)
This study illustrated multiple potential factors infl uencing actomyosin dissociation, including internal factors (AMP, IMP, ADP, ATP, Ca2+, andand external factors (marinated with NaCl or with different phosphate salts). Actomyosin was extracted from duck breast muscle and the protein composition was examined by sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) and western-blot analysis. Results: The density of actin bands was increased signifi cantly when the actomyosin was treated with 8, 16 mmol/L AMP or IMP or with 25–50 mmol/Lat 4 ℃, whereas treatment with 8, 16 mmol/L ADP or with 0.1–5 mmol/L Ca2+did not result in a signifi cant change in actin band densities. These results suggest that marinating duck muscle with different salts has no signifi cant effects on actomyosin dissociation.
duck; actomyosin; dissociation; affecting factors
TS251.68
A
1002-6630(2014)01-0023-06
10.7506/spkx1002-6630-201401005
2012-11-15
國家自然科學基金項目(31101312);江蘇省農業科技自主創新基金項目(CX(12)3082)
董晗(1987—),女,碩士研究生,研究方向為食品科學。E-mail:handong.2567@yahoo.com.cn
*通信作者:徐為民(1969—),男,研究員,博士,研究方向為肉品加工與質量控制。E-mail:weiminxu2002@yahoo.com.cn

