粗壯脈紋胞菌復合多菌種發酵茶粕產纖維素酶的研究
劉沛毅,鄧澤元,楊建遠,李 靜*
(南昌大學高等研究院,食品科學與技術國家重點實驗室,江西 南昌 330047)
粗壯脈紋胞菌復合多菌種發酵茶粕產纖維素酶的研究
劉沛毅,鄧澤元,楊建遠,李 靜*
(南昌大學高等研究院,食品科學與技術國家重點實驗室,江西 南昌 330047)
用粗壯脈紋胞菌分別復合東方伊莎酵母、里氏木霉、綠色木霉、乳酸桿菌固態發酵已去除茶皂素的茶粕,通過測定發酵產物中3種纖維素酶:外切葡聚糖酶(C1)、內切葡聚糖酶(Cx)、β-葡萄糖苷酶(β-G)及總酶濾紙酶(filter paper activity,FPA)的酶活力來探討其分解粗纖維素的協同作用。粗壯脈紋胞菌和綠色木霉混合發酵產生的C1酶酶活力較粗壯脈紋胞菌單菌發酵提高了51.09%,粗壯脈紋胞菌和綠色木霉復合發酵較單菌發酵延長了其纖維素酶分泌的周期,96 h時FPA酶活力達到2.782 U/g;粗壯脈紋胞菌復合里氏木霉、綠色木霉混合發酵組在發酵10 d后對茶粕粗纖維的最終降解率分別達到了64.19%和61.59%;接種量對單菌和混合菌發酵產纖維素酶影響總體趨勢是隨著接種量增加酶活力提高,但粗壯脈紋胞菌單菌發酵纖維素酶酶活力在接種量超過9 mL/100 g后開始下降。表明粗壯脈紋胞菌復合里氏木霉、綠色木霉混合發酵降解纖維素具有協同作用。
粗壯脈紋胞菌;纖維素酶;混合菌發酵;固態發酵;茶粕
近年來,隨著我國農業產業的快速發展,大量的各類農產品加工廢棄物堆積,如何高效利用農副產品成為研究熱點。茶粕是油茶籽經過壓榨提取茶油后剩下的殘渣,約為油茶籽質量的65%,是茶油生產過程中的一種營養價值較高的榨油工業副產品。我國年產茶油約15萬t,茶籽粕約50萬t[1]。由于茶粕含較高濃度的茶皂素、味苦,所以基本上用于水產養殖業的清塘劑和肥料,沒有高值化利用,造成了很大的資源浪費。由于茶皂素具有較大的抑菌作用[2-3],若利用微生物對茶粕進行發酵,須先將茶粕中的抑菌性物質茶皂素去除。因此,本實驗采用實驗室超聲波提取茶皂素專利技術將茶粕中的茶皂素去除;提取茶皂素后的茶粕,可溶性糖、蛋白質和礦物元素含量都較豐富[4],可作為動物飼料或食品的良好原料,但其含較高的纖維素,通過高產纖維素酶的微生物生長,降解纖維素,可大大提高其利用價值。
降解纖維素需要3種酶如內切、外切和/或β-糖苷酶的密切配合。自然界很難通過一種菌將纖維素徹底降解為纖維二糖或單糖,因此常采用產不同纖維素酶的復合菌進行降解。混合菌固體發酵產纖維素酶在菌株的選擇上,通常采用的是真菌,包括部分腐生菌、反芻動物瘤胃菌、青霉屬等,例如,當曲霉和酵母進行聯合發酵時,曲霉屬菌株常選用木霉,酵母則可用產朊假絲酵母[5]。本課題組篩選的粗壯脈紋胞菌(Neurospora crassa)所產內切葡聚糖酶活性較高[6],綠色木霉、里氏木霉產外切葡聚糖酶酶活力較高,在發酵產纖維素酶酶系上可以互補,使所產纖維素酶體系較全面,且它們均為絲狀真菌,適合固態發酵[7-8]。乳酸桿菌可以利用上述菌分解的低聚糖或纖維二糖,而產生有益動物健康的變化[9],酵母菌與產纖維素酶菌多是共生和互生關系[10]。此外,有報道稱固態發酵農副產品產纖維素酶的效果要優于液體發酵,所產酶系也較液體發酵更全面,固態發酵更適合產纖維素酶的絲狀真菌的生長[11]。因此,本研究試圖通過發酵過程中各纖維素酶活性的變化、發酵前后各粗纖維素組分的變化,篩選能與粗壯脈紋胞菌復合共生或協同作用的多種菌種,以降解茶粕中的纖維素來提高其利用價值。
1 材料與方法
1.1 材料與菌種
茶粕由江西省綠源油脂有限公司提供,原料粉碎過40目篩。
粗壯脈紋胞菌(Neurospora crassa)、東方伊莎酵母菌(Issatchenkia oriental)、乳酸桿菌(NCU116)和綠色木霉(Trichoderma vivide) 本實驗室篩選并保藏;里氏木霉(CICC 13052) 國家工業微生物菌種保藏中心。
1.2 培養基
1.2.1 液體種子培養基
東方伊莎酵母培養基:酵母浸粉0.5g/L、葡萄糖2g/L、蛋白胨1 g/L。
綠色木霉培養基:羧甲基纖維素鈉7.5 g/L、蛋白胨5 g/L、CaCl20.3 g/L、KH2PO44 g/L、MgSO40.3 g/L,pH值自然。
里氏木霉培養基:可溶性淀粉10 g/L、葡萄糖10 g/L、蛋白胨10 g/L、(NH4)2SO42 g/L、KH2PO43 g/L、MgSO45 g/L、CaCO35 g/L。
MRS培養基,用于乳酸桿菌培養。
Mandel Weber營養液[13]:(NH4)2SO41.4 g/L、KH2PO42.0 g/L、CaCl2·2H2O 0.3 g/L、MgSO4·7H2O 0.3 g/L、FeSO4·7H2O 5.0 mg/L、MnSO4·H2O 1.6 mg/L、ZnSO41.4 mg/L、CoCl2·6H2O 2.0 mg/L、蛋白胨0.1 g/L、吐溫-80 0.1 g/L。
1.2.2 固體種子培養基
取10g純豆渣,25mL無菌水,用于粗壯脈紋胞菌培養。
1.3 試劑與儀器
微晶纖維素、纖維二糖 美國Aladdin公司;羧甲基纖維素鈉 廣東西隴化工有限公司。
DFT-200粉碎機 溫嶺市大德中藥機械有限公司;KL-UP-III-10超純水制備機 臺灣艾柯(成都)實驗專業純水設備廠;HG101-5型電熱鼓風干燥箱 南京實驗儀器廠;RE52-99型旋轉蒸發儀 上海亞榮生化儀器廠;紫外-可見分光光度計 上海光譜儀器有限公司;DSX-280B型不銹鋼手提式滅菌器 上海申安醫療器械廠;HD-650桌上型超凈工作臺 蘇州安泰空氣技術有限公司;HWS-150型恒溫恒濕培養箱 上海精宏實驗設備有限公司;PHS-2酸度計 上海雷磁儀器廠;15R型高速冷凍離心機 江西省立康科技公司;SJC-Ⅱ多功能溢流循環超聲波生物萃取儀 無錫市上佳生物科技有限公司。
1.4 方法
1.4.1 茶粕中茶皂素殘留率的測定
采用本課題組超聲波提取茶皂素專利技術(公開號CN101289473A),采用香草醛硫酸法[12]對提取茶皂素后的茶粕進行殘留茶皂素量的測定,計算出其茶皂素殘留率。

1.4.2 種子培養
分別取100 mL上述液體種子培養基置于250 mL錐形瓶中,將經活化的綠色木霉、里氏木霉和東方伊莎酵母分別接種至錐形瓶中,28℃恒溫振蕩(180 r/min)培養,綠色木霉和里氏木霉培養時間為48 h,酵母菌培養時間為24 h,乳酸桿菌于28℃恒溫培養箱中靜置培養24 h;取10 g豆渣置于250 mL的發酵瓶中,接種粗壯脈紋胞菌,加入25 mL無菌水,30℃恒溫培養箱中培養72 h,取孢子配成約1×108CFU/mL的孢子懸浮液,備用。
1.4.3 混合菌固態發酵產纖維素酶
將10g經過預處理的茶粕置于250mL發酵瓶中,加入9mL Mandel Weber營養液,保持總接種量10mL/100g,粗壯脈紋胞菌與各菌種接種量體積之比均為2∶1,30℃恒溫培養,控制相對濕度70%,研究不同發酵時間48、60、72、84、96h對各種纖維素酶酶活性的影響。此外選擇發酵96h,改變菌種接種量,研究當粗壯脈紋胞菌和復合菌接種量為3、6、9、12 mL/100 g時對各種纖維素酶酶活性的影響。
1.4.4 粗酶液的提取
稱取發酵培養物1g,加入0.1mol/L HAc-NaAc(pH 5.2)緩沖液20 mL,加入玻璃珠,30℃搖床上振蕩提取1 h。4℃離心,取上清液(即為粗酶液),備用。
1.4.5 纖維素酶的測定[14-15]
還原糖標準曲線:取0.125 g葡萄糖溶于250 mL蒸餾水中,配成0.5 g/L的葡萄糖溶液,再分別取0、5、10、15、20、25 mL 0.5 g/L葡萄糖溶液于25 mL的容量瓶,定容后各取1 mL,加2.5 mL 3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS)試劑,5 min沸水浴后立即流水冷卻,加水至5 mL,于550 nm波長處測定吸光度。
1.4.5.1 濾紙酶(filter paper activity,FPA)酶活力
向試管中各加入1 cm×6 cm的Whatman No.1定性濾紙,2 mL酶液在50℃水浴中保溫30 min,取出后立即加入2.5 mL DNS試劑終止反應。加熱、檸檬酸-檸檬酸鈉緩沖液定容5 mL,在550 nm波長處測定吸光度。
1.4.5.2 外切葡聚糖酶(C1)酶活力
取0.5 mL粗酶液,加入10 mg微晶纖維素,50℃水浴中反應30 min后,加入2.5 mL DNS沸水浴5 min終止反應,檸檬酸-檸檬酸鈉緩沖液定容5.0 mL,在550 nm波長處測定吸光度。
1.4.5.3 內切葡聚糖酶(Cx)酶活力
取0.5 mL粗酶液,加入1.5 mL 1 g/100 mL羧甲基纖維素鈉鹽溶液,50℃水浴中反應30 min后,加入2.5 mL DNS沸水浴5 min終止反應,如上法測定吸光度。
1.4.5.4 β-葡萄糖苷酶(β-G)酶活力
取0.5 mL適當稀釋的粗酶液,加入1.0 mL 15.0 mmol/L纖維二糖溶液,50℃水浴中反應30 min后,加入2.5 mL DNS沸水浴5 min終止反應。如上法測定吸光度。
上述4種酶的酶活力單位定義:在50℃、pH 5.2,恒溫30 min的條件下,以反應中1 min水解底物形成1 μmol葡萄糖的酶量為一個酶活力單位,換算成每克干物料含有的酶活力,用U/g表示[16]。
1.4.6 粗纖維素組分的測定
將10 g經過預處理的茶粕置于250 mL發酵瓶中,加入9 mL Mandel Weber營養液,保持總接種量10 mL/100 g,各菌種與粗壯脈紋胞菌接種體積比均為2∶1,在經過96 h發酵后,用Soest法[17]測定各實驗組及原料中各粗纖維組分的含量,探尋纖維素酶酶活力與不同種類纖維素降解的關聯。
1.4.7 原料與發酵產物中粗纖維含量的測定
將10 g經過預處理的茶粕置于250 mL發酵瓶中,加入9 mL Mandel Weber營養液,保持總接種量10 mL/100 g,各菌種與粗壯脈紋胞菌接種體積比均為2∶1,在經過10 d發酵后,測定各組復合菌培養基中粗纖維含量(GB/T 6434—2006《飼料中粗纖維測定方法》),以期得到對茶粕纖維素降解效果最佳的復合菌搭配。
1.4.8 驗證實驗
為了證實乳酸桿菌和酵母菌對粗壯脈紋胞菌產纖維素酶的影響是由其次級代謝產物造成的,本研究設計以下驗證實驗。
1.4.8.1 乳酸桿菌復合厭氧實驗
將10 g經過預處理的茶粕置于250 mL發酵瓶中,加入9 mL Mandel Weber營養液,接種6 mL/100 g的粗壯脈紋胞菌,發酵72 h后接種3 mL/100 g,經過28℃恒溫培養72 h的乳酸桿菌,放置無氧環境中繼續培養24 h,測定各纖維素酶酶活力。
1.4.8.2 酵母菌復合實驗
將10 g經過預處理的茶粕置于250 mL發酵瓶中,加入9 mL Mandel Weber 營養液,接種6 mL/100 g的粗壯脈紋胞菌,發酵72 h后接種3 mL/100 g的同樣經過72 h培養的東方伊莎酵母,28℃培養箱中繼續培養24 h,測定各纖維素酶酶活力。
2 結果與分析
2.1 茶皂素殘留率
經過超聲波提取后的茶粕中茶皂素的殘留率達到0.917%,對微生物正常生長沒有影響[18]。
2.2 復合菌發酵中纖維素酶的酶活力
2.2.1 發酵時間對纖維素酶活力的影響
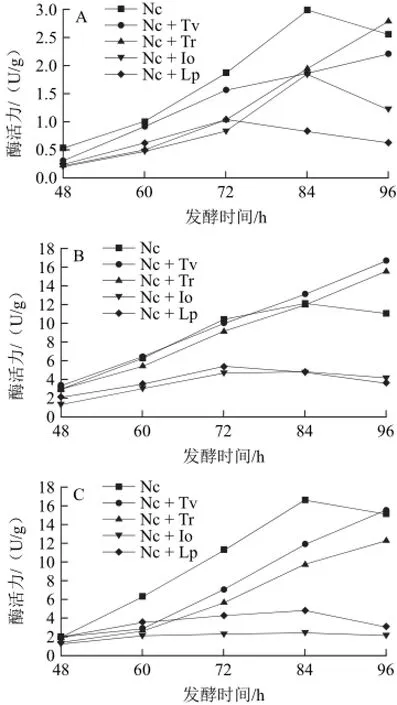
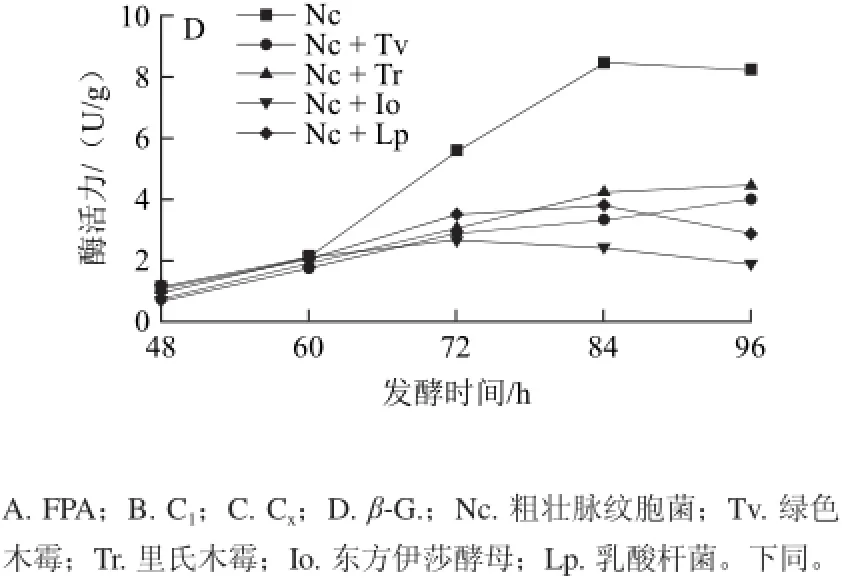
圖1 各種菌在不同復合方式下的發酵時間對纖維素酶活力的影響Fig.1 Effect of fermentation time on the cellulose activities
各種菌不同復合方式在不同發酵時間對纖維素酶酶活力的影響結果見圖1。發酵時間對混合菌發酵產纖維素酶影響較大。粗壯脈紋胞菌單菌發酵各纖維素酶酶活力隨著發酵時間的延長而提高,其總酶活力(FPA)、內切酶(Cx)及β-糖苷酶(β-G)在72~84 h時間段中酶活力迅速上升并達到峰值(分別為2.980、16.588、8.438 U/g),且均高于其他實驗組;里氏木霉+粗壯脈紋胞菌復合發酵組與粗壯脈紋胞菌+綠色木霉復合發酵組96h后4種纖維素酶酶活力仍處于上升趨勢,在粗壯脈紋胞菌+綠色木霉復合發酵組中C1酶的酶活力最高值出現在96h,達到16.688U/g,Cx酶的酶活力在96 h為15.548 U/g,超過同時期粗壯脈紋胞菌單菌發酵組。酵母菌和乳酸桿菌對粗壯脈紋胞菌發酵茶粕產纖維素酶有一定的抑制作用,各酶活在各個發酵時間段相比于粗壯脈紋胞菌單菌發酵均有較大幅度的下降,這兩個實驗組中各纖維素酶酶活總體趨勢是先升后降,基本上與粗壯脈紋胞菌單菌發酵同步。
2.2.2 各種復合菌接種量對纖維素酶活力的影響
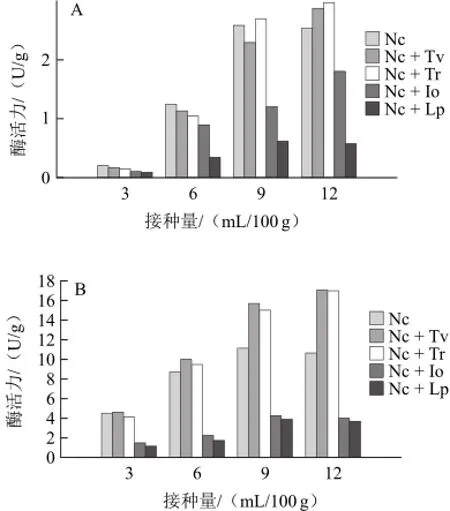

圖2 各種菌不同復合方式的接種量對各纖維素酶活力的影響Fig.2 Effects of inoculum size on the cellulose activities
各菌種不同復合方式在不同接種量時發酵96h后,纖維素酶測定結果如圖2所示。各實驗組中各種纖維素酶酶活基本上都隨著接種量的增加而提高,粗壯脈紋胞菌單菌發酵組中當接種量從9 mL/100 g增加至12 mL/100 g時,總酶酶活力(FPA)和C1酶酶活力都有一定程度的下降,分別從2.587 U/g和11.141 U/g下降至2.536 U/g和10.612 U/g。粗壯脈紋胞菌+綠色木霉復合發酵組和粗壯脈紋胞菌+里氏木霉復合發酵組在接種量達到12 mL/100 g時各纖維素酶酶活力均到達最高值,其中FPA酶、C1酶酶活力超過粗壯脈紋胞菌單菌相應接種量的酶活力,分別為2.881、2.979 U/g和17.033、16.965 U/g。
2.3 原料與發酵產物纖維素組分含量的對比
表1 不同復合菌發酵對產物粗纖維素各種組分的影響Table 1 Effect of single- and mixed-strain fermentation on lignin, cellulose and hemicelluloses in tea seed cake
由表1可知,粗壯脈紋胞菌單菌發酵對半纖維素降解效果比其他混合菌種發酵組要好,降解率達到45.05%,可能是由于半纖維素對粗壯脈紋胞菌產纖維素酶有一定的底物誘導作用或是粗壯脈紋胞菌所產纖維素酶酶系對半纖維素有特異性[19];東方伊莎酵母、綠色木霉、里氏木霉與粗壯脈紋胞菌復合發酵降解纖維素的能力均較粗壯脈紋胞菌單菌發酵高,可能是復合菌C1酶酶活力相比于粗壯脈紋胞菌單菌發酵有所提高,纖維素酶酶系更加完整,微生物菌群結構更合理等;由于該實驗所選用的不是產木質素酶顯著的微生物,所以各實驗組對木質素的降解效果均不理想,最好的是粗壯脈紋胞菌+里氏木霉復合發酵組,木質素含量從6.85%下降至5.30%。
2.4 原料與發酵產物粗纖維含量對比

表2 原料與發酵產物粗纖維含量的對比Table 2 Comparison of cellulose content between raw and fermented materials
由表2可知,粗壯脈紋胞菌和里氏木霉復合發酵組對茶粕中粗纖維降解效果最明顯,粗纖維降解率達到64.19%,其次是粗壯脈紋胞菌和綠色木霉發酵組、粗壯脈紋胞菌單菌發酵組、粗壯脈紋胞菌+東方伊莎酵母菌組,粗壯脈紋胞菌+乳酸桿菌組降解粗纖維效果最差。
2.5 驗證實驗結果
2.5.1 乳酸桿菌復合粗壯脈紋胞菌厭氧發酵對產纖維素酶的影響
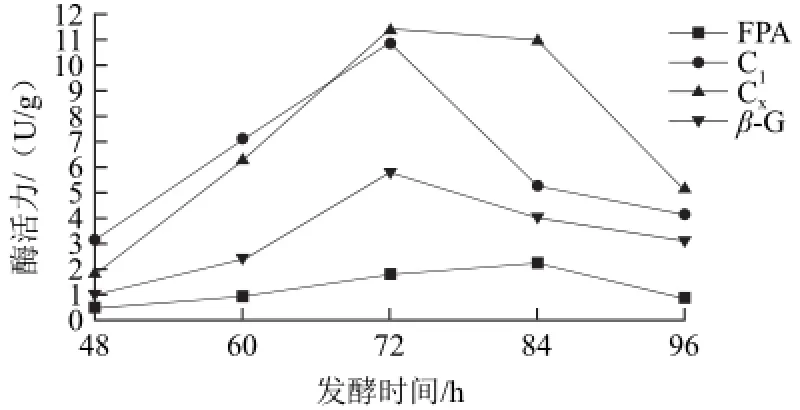
圖3 乳酸桿菌復合粗壯脈紋胞菌對產纖維素酶酶活力的影響Fig.3 Effect of co-fermentation with L. plantarum and Neurospora crassa on the cellulase activities
由圖1、3可知,48~72 h時間段,粗壯脈紋胞菌產纖維素酶酶活力正常,上升趨勢明顯,在72 h加入乳酸桿菌后,本應處于快速增長期的各纖維素酶酶活力卻在這時大幅下降,培養96 h后Cx酶活力相比于粗壯脈紋胞菌單菌發酵的同期下降了66.11%,其酶活變化趨勢與之前實驗結果契合。乳酸桿菌對粗壯脈紋胞菌產纖維素酶有抑制作用。
2.5.2 東方伊莎酵母復合粗壯脈胞菌發酵對產纖維素酶的影響
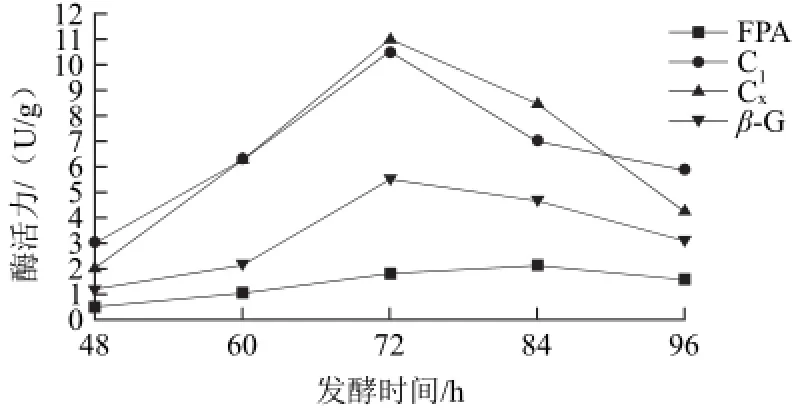
圖4 東方伊莎酵母復合粗壯脈紋胞菌對產纖維素酶酶活力的影響Fig.4 Effect of co-fermentation with Issatchenkia oriental and Neurospora crassa on the cellulase activities
由圖4可知,FPA、Cx和C1這3種酶活均在接種東方伊莎酵母后開始下降,且下降幅度較圖1中更為明顯。此外,發酵96 h后產物中酒精度達3.2 mL/100 g。β-糖苷酶下降趨勢較平緩,可能是由于乙醇不是其主要的競爭性抑制劑的緣故。
3 結論與討論
3.1 單菌發酵和混合菌發酵所產纖維素酶酶活力的變化
本實驗的目的是尋找能與粗壯脈紋胞菌協同降解纖維素或對粗壯脈紋胞菌生長有促進作用的復合菌,以便提高農副產物的利用價值。由于粗壯脈紋胞菌自身所產纖維素酶中Cx酶活力較高,而里氏木霉和綠色木霉產C1酶活力較高[20-21],但其相對于粗壯脈紋胞菌產酶高峰來的較晚,產酶周期長。粗壯脈紋胞菌單菌發酵達到產酶高峰一般在發酵后的60~84 h,而其與綠色木霉或里氏木霉復合后,產酶高峰出現延后,一般在96 h才達到較高水平。發酵84h時,粗壯脈紋胞菌單菌發酵的Cx(16.588U/g)、FPA(2.980U/g)、β-G(8.438U/g)酶活力均高于各復合菌發酵,但發酵96h后,粗壯脈紋胞菌單菌產各種纖維素酶酶活力均降低Cx(15.111U/g)、FPA(2.547U/g)、β-G(8.222 U/g),而各復合菌發酵產各纖維素酶酶活力保持增勢,粗壯脈紋胞菌+綠色木霉復合發酵組的C1酶活力在96 h達到了16.688 U/g(84 h時為13.125 U/g)。結合粗纖維素降解數據,經過10 d充分發酵后,本實驗觀察到菌體基本停止生長,這時基料中的營養物質基本上利用完全,粗壯脈紋胞菌+里氏木霉組和粗壯脈紋胞菌+綠色木霉組對茶粕中粗纖維的降解效果更好、更徹底。這可能是由于里氏木霉和綠色木霉的產酶周期長,C1酶活力較高(與Cx酶活基本一致),正好互補了粗壯脈紋胞菌所產C1酶活力較低這一不足。粗壯脈紋胞菌+里氏木霉組和粗壯脈紋胞菌+綠色木霉組對纖維素組分的降解效率要高于粗壯脈紋胞菌單菌組,可能是由于纖維素組分作為碳源對綠色木霉和里氏木霉的誘導效果優于對粗壯脈紋胞菌的誘導效果,導致纖維素酶水解效率提高;此外,還可能是綠色木霉、里氏木霉復合粗壯脈紋胞菌所產纖維素酶酶系更完整,C1酶活力高,對打斷纖維素復雜的結晶區有所幫助,導致其降解效果提高[22]。綜上所述,粗壯脈紋胞菌與綠色木霉和里氏木霉的混合發酵組相比于粗壯脈紋胞菌單菌發酵,其所產纖維素酶周期長,酶系更完整,酶效率更高,降解纖維能力更強。
3.2 接種量對復合菌各纖維素酶酶活力的影響
接種量的增加對粗壯脈紋胞菌+綠色木霉組和粗壯脈紋胞菌+里氏木霉組所產纖維素酶影響較大,當接種量達到9 mL/100 g后,粗壯脈紋胞菌+綠色木霉組C1(15.672 U/g)、Cx(15.569 U/g)酶活力超過粗壯脈紋胞菌單菌(分別為11.141 U/g和12.229 U/g);粗壯脈紋胞菌+里氏木霉組在接種量達到12 mL/100 g時,其FPA(2.979 U/g)和C1(16.965 U/g)酶活力優于同接種量的粗壯脈紋胞菌單菌發酵組(分別為2.536 U/g和10.612 U/g)。粗壯脈紋胞菌+酵母菌組隨著接種量的增加各纖維素酶酶活力均穩步上升,但總體酶活力較低,結合表1,可以發現雖然在酶活上沒有升高,但對纖維素的降解率相對于粗壯脈紋胞菌單菌發酵提高了12.15%,可能是由于酵母菌將無機氮轉換成菌體蛋白后,分泌B族維生素、生物活性物質等[23]促進了粗壯脈紋胞菌的生長的原因。粗壯脈紋胞菌單菌發酵的β-G酶活力高于其他各實驗組,并且隨著接種量的增加而提高,在接種量到12 mL/100 g時達到了8.742 U/g。可能是由于前期發酵產生的Cx和C1兩種纖維素酶的作用導致發酵物中纖維二糖含量劇增,通過反饋誘導機制刺激β-G大量分泌,而后期β-G酶活力呈現下降趨勢,是由于葡萄糖含量增加,競爭性抑制了β-G酶活力[24]。此外,β-G的變化趨勢和FPA變化趨勢是契合的,表明β-G可能是總酶活的一個關鍵控制酶。總體來說,當接種量達到12 mL/100 g時,粗壯脈紋胞菌單菌發酵所產酶酶活力呈下降趨勢,可能是過多的接種量導致基料消耗快,在未達到產酶高峰前,基料中的營養成分就耗盡,不能滿足如此大量的菌同時生長;而綠色木霉、里氏木霉對基料中營養成分要求更低,與粗壯脈紋胞菌復合,纖維素酶系更齊全,對纖維素的利用效率更高[25]。
通過本實驗可以得出如下結論:乳酸菌在發酵茶粕產纖維素酶上對粗壯脈紋胞菌沒有促進作用,在發酵后期,對粗壯脈紋胞菌的產酶還有抑制作用,導致該組在發酵96 h后FPA酶活力只有0.629 U/g,驗證實驗組中FPA酶活力只有0.85 U/g。可能是由于在發酵后期發酵瓶中的氧氣含量較低,乳酸桿菌大量生長,分泌對真菌生長有抑制作用的乳酸類、酚酸類物質[26-27],降低了粗壯脈紋胞菌的作用。有研究表明[28],酵母菌復配真菌發酵能產生較好的效果。但本實驗中,東方伊莎酵母對粗壯脈紋胞菌發酵茶粕產纖維素同樣沒有促進作用。結合驗證實驗,本研究認為可能是酵母菌在發酵中期開始利用粗壯脈紋胞菌降解纖維素產生的可溶性糖迅速生長并分泌次級代謝產物——酒精,對粗壯脈紋胞菌的生長產生了干擾,導致發酵后期纖維素酶酶活力顯著下降。
[1] 鄧桂蘭,魏強華. 利用茶粕生產菌體蛋白飼料的研究[J]. 糧食與食品工業, 2008(15): 31-38.
[2] 黃衛文, 敖常偉, 鐘海雁. 油茶皂素抑菌效果研究[J]. 經濟林研究, 2002, 20(1): 17-19.
[3] 黃冬梅, 香私, 李慶, 等. 茶皂素提取工藝的研究及應用前景[J]. 化工科技市場, 2003 (11): 11-13.
[4] 陳欽, 鄭清芳. 油茶餅綜合利用的研究[J]. 福建林學院學報, 2002, 20(2): 97-100.
[5] 羅永生, 常春. 固態混菌發酵產纖維素酶的研究進展[J]. 釀酒科技, 2010(1): 79-82.
[6] XIROS C, TOPAKAS E, KATAPODIS P, et al. Hydrolysis and fermentation of brewer’s spent grain by Neurospora crassa[J]. Bioresource Technology, 2008, 99(13): 5427-5435.
[7] 熊海燕, 王衛國, 王存文, 等. 混合菌培養及其在工業上的應用[J].貴州化工, 2004, 29(3): 16-19.
[8] RODRIGUEZ-COUTO S, SANROMAN M A. Application of solidstate fermentation to ligninolytic enzyme production[J]. Biochemical Engineering Journal, 2005, 22: 211-219.
[9] 考書娟, 張鋒, 張彬. 絲狀真菌YW-7與乳酸菌共同培養發酵豆粕的研究[J]. 家禽科學, 2008, 24(6): 16-19.
[10] 張昆, 王春維, 余岳, 等. 復合雜粕多菌種發酵工藝研究[J]. 糧食與飼料工業, 2012, 5(3): 49-52.
[11] AHAMED A, VERMETTE P. Enhanced enzyme production from mixed cultures of Trichoderma reesei RUT-C30 and Aspergillus niger LMA grown as fed batch in a stirred tank bioreactor[J]. Biochemical Engineering Journal, 2008, 42: 41-46.
[12] 肖玉娟, 鄧澤元, 范亞葦, 等. Neurospora crassa降解茶粕培養基粗纖維的發酵工藝研究[J]. 食品科學. 2010, 31(23): 243-247.
[13] OBEROI H S, CHAVAN Y, BANSAL S, et al. Production of cellulases through solid state fermentation using kinnow pulp as a major substrate[J]. Food Bioprocess Technology, 2010, 3(4): 528-536.
[14] BAILEY M J, BIELY P, POUTANEN K. Interlaboratory testing of methods for assay of xylanase activity[J]. Journal of Biotechnology, 1992, 23: 257-270.
[15] RODRIGUEZ-COUTO S, SANROMAN M A. Application of solidstate fermentation to ligninolytic enzyme production[J]. Biochemical Engineering, 2005, 22: 211-219.
[16] KIM S, KIM C H. Production of cellulase enzymes during the solidstate fermentation of empty palm fruit bunch fiber[J]. Bioprocess Biosystem Engineering, 2012, 35: 61-67.
[17] 陳賢情. 秸稈中纖維素/半纖維素和木質素的幾種測定方法對比[D].楊凌: 西北農林科技大學, 2006.
[18] 劉蓉, 張利蕾, 范亞葦, 等. 茶渣中粗茶皂素的純化及其抗氧化和抑菌活性[J]. 南昌大學學報: 工科版, 2013, 35(1): 17-21.
[19] BUNGAY H R, BUNGAY M L. Microbial interactions in continuous culture[J]. Advances in Applied Microbiology, 1986, 10: 269-312.
[20] 曹健, 郭德憲, 曾實, 等. 里氏木霉纖維素酶的純化和性質[J]. 食品科學, 2003, 24(5): 73-75.
[21] de VRIES R P, VISSER J. Aspergillus enzymes involved in degradation of plant cell wall polysaccharides[J]. Microbiology and Molecular Biology Reviews, 2001, 65(4): 497-522.
[22] 陳合, 余建軍, 舒國偉, 等. 復合酶降解高溫蒸煮玉米秸稈的飼料化研究[J]. 食品工業科技, 2010, 5(12): 176-178; 181.
[23] 戴四發, 賀淹才. 綠色木霉纖維素酶系分泌特性及酶解條件的研究[J]. 安徽技術師范學院學報, 2001, 15(4): 50-53.
[24] GALAS E, ROMANOWSKA I. Purification and some properties of beta-glucosidase from Aspergillus niger IBT-90[J]. Acta Microbiologica Polonica, 1997, 46(3): 241-252.
[25] BISARIAA V S, GHOSE T K. Biodegradation of cellulosic materials: substrates, microorganisms, enzymes and products[J]. Enzyme and Microbial Technology, 1981, 3(2): 90-104.
[26] PERALTAA E M, HATATE H, KAWABE D, et al. Improving antioxidant activity and nutritional components of Philippine saltfermented shrimp paste through prolonged fermentation[J]. Food Chemistry, 2008, 111: 72-77.
[27] PREMA P, SMILA D, PALAVESAM A, et al. Production and characterization of an antifungal compound (3-phenyllactic acid) produced by Lactobacillus plantarum strain[J]. Food Bioprocess Technology, 2010, 3: 379-386.
[28] MURADOA M A, PASTRANA L, V?ZQUEZ J A, et al. Alcoholic chestnut fermentation in mixed culture. Compatibility criteria between Aspergillus oryzae and Saccharomyces cerevisiae strains[J]. Bioresource Technology, 2008, 99: 7255-7263.
Cellulase Production from Tea Seed (Camellia oleifera) Cake Using Neurospora crassa Mixed with Other Bacteria
LIU Pei-yi, DENG Ze-yuan, YANG Jian-yuan, LI Jing*
(State Key Laboratory of Food Science and Technology, Institute for Advanced Studies, Nanchang University, Nanchang 330047, China)
The production of cellulaes from tea seed (Camellia oleifera) cake with a minimized content of residual tea saponin of 0.917% as obtained by ultrasonic extraction method was studied in solid-state fermentation by mixed strains of Neurospora crassa with Issatchenkia oriental, Trichoderma reesei, Trichoderma vivide or L. plantarum. The activities of cellobiohydrolase 1 (C1), β-1,4-endoglucanase (Cx) and β-glucosidase (β-G) and filter paper activity (FPA) in fermentation supernatants were determined to explore their synergistic action on enzymatic hydrolysis of cellulose. The enzyme activity of C1from Neurospora crassa combined with Trichoderma vivide was increased by 51.09% compared with that obtained from single-strain fermentation by Neurospora crassa; meanwhile, the combination of both strains resulted in prolonged secretion of cellulases, and the FPA activity reached 2.782 U/g after 96 h. The cellulose was degraded by 64.19% and 61.59% in tea seed cake fermented for 10 days by Neurospora crassa mixed with Trichoderma reesei and Trichoderma vivide, respectively. The overall tendency of the enzyme activities was an increase with increasing the inoculum size irrespective of fermentation with Neurospora crassa alone or combined with other strains. However, the cellulase activities were declined at higher inoculum sizes surpassing 9 mL/100 g of Neurospora crassa when inoculated alone. These results indicate that Neurospora crassa is able to cooperate with Trichoderma reesei and Trichoderma vivide respectively to degrade cellulose.
Neurospora crassa; cellulases; mixed-bacteria fermentation; solid-state fermentation; tea seed
TS209
A
1002-6630(2014)01-0174-06
10.7506/spkx1002-6630-201401034
2013-06-30
食品科學與技術國家重點實驗室基金項目(SKLF-QN-201105;SKLF-ZZA-201303);江西省自然科學基金項目(2010BN1301104)
劉沛毅(1990—),男,碩士研究生,研究方向為發酵工程。E-mail:602634617@qq.com
*通信作者:李靜(1982—),女,副教授,博士,研究方向為營養學。E-mail:jingjingbailu@hotmail.com

