食品中常見微生物對氧化三甲胺代謝差異的研究
吳 翔,韓偉偉,王世平
(中國農業大學食品科學與營養工程學院,北京 100083)
食品中常見微生物對氧化三甲胺代謝差異的研究
吳 翔,韓偉偉,王世平*
(中國農業大學食品科學與營養工程學院,北京 100083)
分析6種食品中常見微生物(金黃色葡萄球菌、產氣腸桿菌、糞腸球菌、大腸桿菌、單增李斯特菌、腸炎沙門氏菌)對含有氧化三甲胺(trimethylamine N-oxide,TMAO)培養基理化性質的影響,并根據微生物對TMAO的代謝利用情況,對這6種微生物進行分類;利用非抑制型離子色譜分析TMAO的分解產物,發現微生物可將TMAO分解為三甲胺(trimethylamine,TMA);最后通過繪制培養基不同理化指標(pH值、電導率、濁度、TMA質量濃度)隨培養時間的變化曲線,證明TMA的生成會對培養基電導率和pH值產生影響,且不同類型的微生物對這種影響的作用差異顯著。
氧化三甲胺;離子色譜;電化學分析;微生物;快檢技術
微生物污染是所有食品從業人員都需要重視的問題。平板計數、革蘭氏染色等傳統微生物檢測方法通常過程繁瑣、檢測時間長、需要大型實驗室的專業人員操作[1]。阻抗分析法作為一種新興的微生物快檢方法,具有快速、經濟、操作簡單、使用廣泛等諸多優點[2],能一定程度上彌補傳統方法的不足,具有良好的商業應用前景[3-4]。阻抗分析法依靠檢測培養基因微生物生長而逐漸改變的電化學參量,實現對微生物的快速測定[5]。微生物因生活環境不同,對同一種物質的代謝能力會存在差異[6],因此如果添加一種電惰性有機物,經特定種類微生物利用后,轉化為電解質,提高培養基的導電性[7],就能實現對特定類群微生物的檢測。
氧化三甲胺(t r i m e t h y l a m i n e N-o x i d e, T M A O),化學結構式為(C H3)3N O,是一種非電解質滲透調節物質[8],其分解產物三甲胺(t r i m e t h y l a m i n e,T M A)和二甲胺(dimethylamine,DMA)則是弱電解質[9],當TMAO被微生物降解代謝后,培養基的電導性將大幅提高,通過對培養基的電學特性進行檢測,即可間接實現對微生物的檢測。目前已有針對TMAO代謝相關菌的相關研究[6,10-11],但將TMAO用于微生物快速檢測的研究尚未見報道。本實驗通過對比研究6種常見食品腐敗微生物對TMAO的代謝能力及培養基電導、pH值和濁度等指標的影響,揭示不同微生物代謝TMAO對培養基理化性質的影響,期望能為TMAO用于微生物阻抗分析法提供依據。
1 材料與方法
1.1 菌種與試劑
金黃色葡萄球菌(Staphylococcus aureus)、產氣腸桿菌(Enterobacter aerogenes)、糞腸球菌(Enterococcus faecalis)、大腸桿菌(Escherichia coli)、單增李斯特菌(Listeria monocytogenes)、腸炎沙門氏菌(Salmonella enteritidis),中國農業大學食品科學與營養工程學院常規微生物檢測實驗室提供。
TMAO?2H2O(分析純) 天科生物科技有限公司;TMAO?2H2O標品、TMA-HCl標品、DMA-HCl標品美國Sigma公司;苦味酸、甲苯、氫氧化鉀、甲醛、三氯醋酸、葡萄糖、無水硫酸鈉 北京化工廠;胰蛋白胨、酵母浸粉、牛肉膏、瓊脂粉 北京奧博星生物技術責任有限公司。
1.2 培養基
PCA液體培養基:胰蛋白胨5 g/L、酵母浸粉2.5 g/L、葡萄糖1 g/L,pH 7.0,121℃滅菌15 min。PCA固體培養基:在PCA液體培養基中添加瓊脂15 g/L,滅菌。檢測培養基:向已滅菌的PCA液體培養基中添加過濾除菌的TMAO溶液,使其最終質量濃度達到2 g/L。
1.3 儀器與設備
FE20 pH計 梅特勒-托利多儀器(上海)有限公司;ICS-2000離子色譜儀 美國戴安公司;Synergy HT酶標儀 美國柏騰儀器有限公司;MP522型精密pH/電導率測量儀(2401-M電導電極) 上海三信儀表廠;UV-5200紫外分光光度計 北京愷欣世紀科技發展有限公司;TGL18M臺式高速冷凍離心機 鹽城市凱特實驗儀器有限公司。
1.4 方法
1.4.1 菌種活化
取斜面上保存的菌種,于PCA固體培養基平板上劃線活化分離2次,從平板上挑取單菌落,接種在裝有10 mL PCA液體培養基的試管中,37℃培養24 h,制成菌懸液。
1.4.2 分解TMAO菌種的篩選
分別吸取已活化的6種菌懸液各200 μL,按無菌操作分別接種到40 mL檢測培養基和PCA培養基中,每個處理3個重復,分別另取3瓶40 mL無菌培養基為空白。置于37℃培養箱中培養,分別在培養24 h后取樣,進行培養基pH值、電導率檢測。通過比較微生物生長引起的2種培養基理化性質變化情況和變化幅度差異,篩選獲得陽性菌株進行后續實驗。
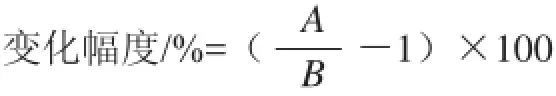
式中:A為微生物培養后培養基電導率或pH值平均值;B為空白培養基電導率或pH值平均值。
1.4.3 樣品前處理
取PCA液體培養基培養的菌懸液6 mL測量電導率和pH值后,在4℃、9 000 r/min離心10 min。移取4 mL上清液于另一離心管中,加入等體積7.5%三氯乙酸溶液后,再次在4℃、9 000 r/min離心10 min,取上清經0.45 μm纖維素膜過濾,取25 μL進樣于ICS-2000離子色譜儀。
1.4.4 非抑制型離子色譜定性分析水解產物[12]
分離柱:DionexIonpac CS17(4 mm×250 mm),柱溫:3 0℃;保護柱:D i o n e x I o n p a c G S 1 7(4 mm×50 mm);電導檢測器,電導池溫:35℃;流動相及流速:3 mmol/L的甲磺酸溶液,0.8 mL/min;程序時間及數據采集速率:20 min,5.0 Hz;柱壓設置:最低200 psi,最高3 000 psi;分析時間為20 min。
1.4.5 分解TMAO菌種生長曲線的檢測
按照1.4.1節活化具有分解TMAO能力的菌種,分別吸取已活化的菌懸液各1 mL,接種到500 mL檢測培養基中,取無菌檢測培養基為空白,靜置于37℃,從接菌后0.5 h開始,每隔1 h在無菌條件下移取菌懸液6 mL,進行電導率、pH值、濁度(OD600nm)的檢測,并按1.4.3節中所述方法離心取上清,保存于4℃冰箱中,檢測培養基中TMA的質量濃度。
1.4.6 TMA的定量測定
參照苦味酸比色法并略作修改[13],移取一定量上清液于10 mL比色管中,空白為無菌檢測培養基,去離子水定容至2 mL,依次加入0.5 mL 10%甲醛溶液、2.5 mL無水甲苯、1.5mL 25g/100mL KOH溶液,蓋上塞子,漩渦混合器混合3次。靜置分層后,將甲苯層移至干燥小試管,每管加入約0.2g無水硫酸鈉。準確移取100μL苦味酸工作液于96孔酶標板,依次加入上述用無水硫酸鈉脫水后的甲苯層100μL,每個質量濃度3個重復,15min后在酶標儀上用410nm波長處檢測吸光度。根據標準曲線計算TMA質量濃度。
1.4.7 數據處理
除定性的離子色譜實驗外,每個處理均做3次重復,每次實驗平行測定3次,結果以表示。利用SPSS V12軟件進行統計分析,采用多重比較和配對t檢驗的方法。
2 結果與分析
2.1 微生物生長24 h對培養基導電性和pH值的影響
由表1可知,檢測培養基在經過微生物24 h的生長后,與空白培養基相比電導率和pH值,均發生顯著變化(P<0.05),培養基的電導率在6種菌生長后均增加,而pH值則表現出多樣性變化,除大腸桿菌和單增李斯特菌外,其余4種菌均使檢測培養基pH值降低。PCA培養基的電導率和pH值則較空白組差異不大,但均表現出電導率升高和pH值的降低。以上結果說明,微生物可以將培養基中的非電解質轉化為具有導電能力的物質,改變培養基溶液的導電性,且這種變化與培養基溶液pH值的變化之間沒有相關性。
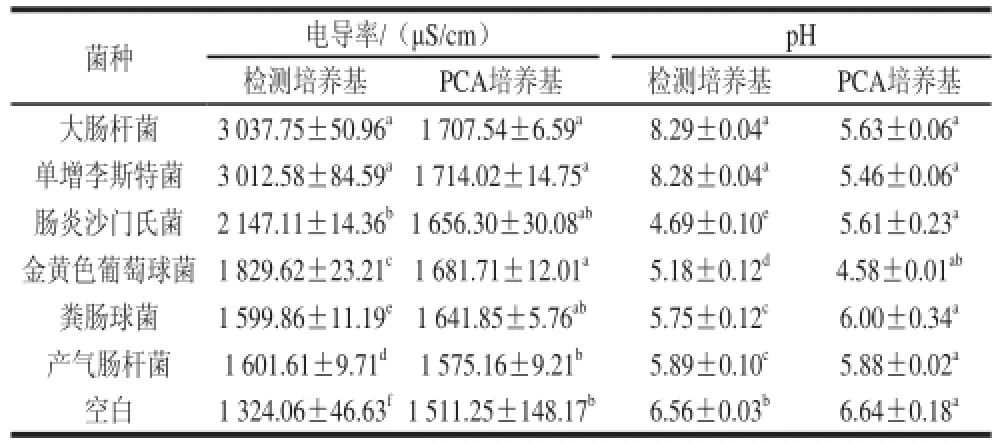
表1 兩種培養基在微生物生長24h后的電導率和pH值變化Table 1 Conductivity and pH after microorganisms were grown for 24 h in the assay medium and PCA medium
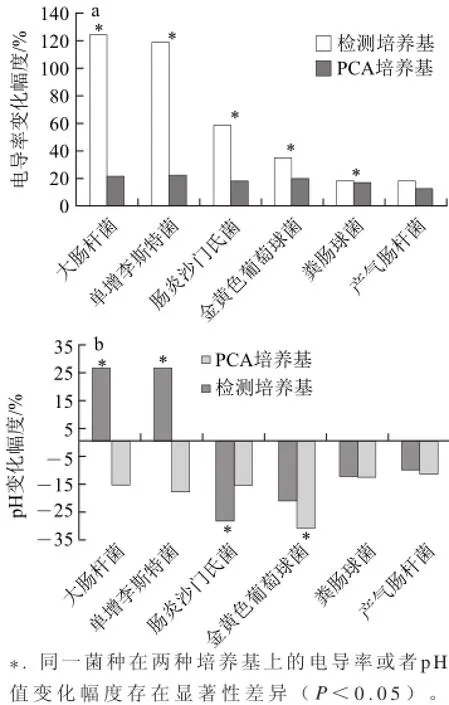
圖1 6種微生物生長24h后培養基的電導率和pH值變化Fig.1 Changes in conductivity and pH after microorganisms were grown for 24 h
如圖1a所示,微生物在含有TMAO的檢測培養基中生長引起電導率的變化幅度均高于PCA培養基。其中,大腸桿菌和單增李斯特菌引起的增加幅度達120%,腸炎沙門氏菌的電導率也有較大增長,增加率為60%,除產氣腸桿菌外,其余幾種菌在兩種培養基中引起的電導率變化均存在顯著性差異。除產氣腸桿菌和糞腸球菌外,其他微生物在兩種培養基中生長引起的pH值變化均存在顯著性差異,如圖1b所示,大腸桿菌和單增李斯特菌使檢測培養基pH值升高,而腸炎沙門氏菌在檢測培養基中引起的pH值降低幅度高于PCA培養基。
根據以上結果,可將上述6種微生物分為3類:1)大腸桿菌和單增李斯特菌,這兩種菌可能具有迅速分解TMAO產生導電性強小分子的能力,造成檢測培養基電導率和pH值的顯著升高;2)腸炎沙門氏菌,推測TMAO或其分解產物能促進其生長,導致培養基pH值下降幅度增加;3)金黃色葡萄球菌、糞腸球菌和產氣腸桿菌,該類菌生長引起的檢測培養基的電導率變化幅度小于50%,且其生長和代謝不受TMAO的影響。選擇大腸桿菌、單增李斯特菌和腸炎沙門氏菌進行后續實驗。
2.2 非抑制型離子色譜對TMAO分解產物的定性結果

圖2 TMAO分解產物離子色譜圖Fig.2 Ion chromatogram of degraded products from TMAO
圖2為2.1節中可能利用TMAO的3種微生物(大腸桿菌、單增李斯特菌和腸炎沙門氏菌)在檢測培養基培養后的離子色譜檢測結果,根據文獻[14],TMAO的可能分解產物包括TMA、DMA、甲醛、甲烷等小分子,其中是弱電解質的物質只有TMA(pKb=4.2)和DMA(pKb=3.23)[9]。參照圖2a中TMAO的兩種分解產物TMA(11.843 min)和DMA(9.857 min)的保留時間,結果表明這3種微生物分解TMAO后的產物均為TMA,沒有DMA,與國外文獻[15-17]報道相符。其中沙門氏桿菌的分解能力最弱(圖2d),與2.1節中培養基電導率結果相符。
2.3 電導率、pH值、濁度、TMA質量濃度隨微生物生長在檢測培養基中的變化
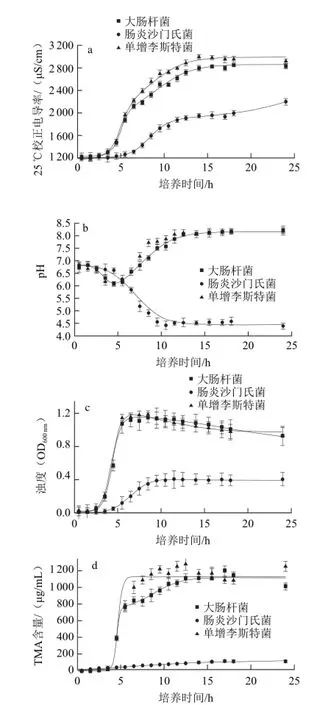
圖3 3種微生物生長引起的培養基物化指標變化Fig.3 Changes in physiochemical properties of the medium during cultivation of three bacterial species
如圖3所示,大腸桿菌和單增李斯特菌的各指標隨培養時間的變化曲線較為相似,大致都可分為4個階段。階段1(0~1.5 h),此階段為微生物的適應期,各指標均無明顯變化,TMA產量在該階段表現出滯后性,約延續到3.5 h,說明這兩種微生物代謝TMAO的酶是誘導酶。階段2(1.5~5.5 h),表示微生物數量的濁度曲線在該階段具有最大斜率,同時培養基的pH值曲線出現下降趨勢,該階段結束時這兩種菌的濁度達到最大值,pH值達到最低點,最低點處pH值為6.0,在此期間,微生物大量繁殖代謝培養基中的可溶性碳水化合物,導致培養基pH值下降。與之相應,培養基中TMA質量濃度在3~5.5 h起快速增高,由于TMA和培養基中酸性物質的增加,導致該階段培養基的電導率亦在整個培養階段具有最大斜率。第3階段(5.5~11.5 h),培養5.5 h以后,這兩種微生物進入穩定期,培養基濁度不再增加,菌體的產酸能力下降,并且隨著培養基中TMA質量濃度的繼續緩慢增加,培養基的pH值逐漸升高,此階段中培養基的導電能力的增加僅依靠TMA的生成,因而較第2階段電導率曲線的斜率減小。第4階段(11.5~24.5 h),此時微生物已進入衰亡期,培養基的濁度逐漸減小,而培養基pH值、電導率和TMA質量濃度均無顯著變化。由于腸炎沙門氏菌對TMAO的代謝能力不強,但具有較強的產酸能力,因此也能檢測到培養基電導率的較大變化,其培養基濁度、pH值和電導率的變化曲線可簡單分為3個階段(0~3.5 h,3.5~10.5 h,10.5~24.5 h),在整個培養過程中,腸炎沙門氏菌培養基中的TMA質量濃度,持續地緩慢變化,因此,推測腸炎沙門氏菌的TMAO代謝酶為一種組成酶類,Arguello等[18]的研究結果表明,腸炎沙門氏菌在厭氧條件下才將TMAO作為呼吸鏈上的電子受體加以利用,這可能是本實驗中腸炎沙門氏菌未能大量產生TMA的原因。
3 結 論
本實驗發現6種常見食品腐敗微生物對TMAO的代謝具有選擇性,TMAO的添加對微生物生長后培養基的電導率與pH值影響很大,根據電導率和pH值的變化,可將這6種菌分成3類:1)能分解TMAO的大腸桿菌和單增李斯特菌;2)TMAO促進產酸的腸炎沙門氏菌;3)添加TMAO后不受影響的金黃色葡萄球菌、糞腸球菌和產氣腸桿菌。這3類菌對添加TMAO培養基的電導率和pH值影響的差異顯著。通過離子色譜對TMAO降解產物分析后發現,引起培養基電導率和pH值變化的是TMA。而通過對第1、2類菌分別以電導率、pH值、濁度和TMA質量濃度為指標繪制的生長曲線,驗證TMA的生成對培養基電導率和pH值產生影響,并且這種影響對與不同類型的菌種差異顯著。本研究證明TMAO是一種可用于阻抗法微生物檢測的指示物質,為微生物阻抗法快速檢測提供理論基礎。
參考文獻:
[1] 盧智遠, 牛中奇, 劉啟, 等. 一種微生物檢測的生物電化學方法研究[J].傳感技術學報, 2005, 18(3): 481-483; 487.
[2] 胡珂文, 王劍平, 蓋鈴, 等. 電化學方法在微生物快速檢測中的應用[J].食品科學, 2007, 28(12): 526-530.
[3] RAMALHO R, CUNHA J, TEIXEIRA P, et al. Improved methods for the enumeration of heterotrophic bacteria in bottled mineral waters[J]. Journal of Microbiological Methods, 2001, 44(2): 97-103.
[4] FELICE C J, MADRID R E, OLIVERA J M, et al. Impedance microbiology: quantification of bacterial content in milk by means of capacitance growth curves[J]. Journal of Microbiological Methods, 1999, 35(1): 37-42.
[5] 張愛萍, 唐佳妮, 劉東紅. 阻抗法檢測食品中微生物的研究進展[J].食品工業科技, 2011, 32(2): 436-439.
[6] BARRETT E L, KWAN H S. Bacterial reduction of trimethylamineoxide[J]. Microbiology, 1985, 39: 131-149.
[7] 陳天壽. 微生物培養基的制造與應用[M]. 北京: 中國農業出版社, 1995: 11-27.
[8] GIBB S W, HATTON A D. The occurrence and distribution of trimethylamine-N-oxide in Antarctic coastal waters[J]. Marine Chemistry, 2004, 91: 65-75.
[9] 揭念云. 基礎化學Ⅰ[M]. 北京: 科學出版社, 2000: 517-518.
[10] ANSALDI M, BORDI C, LEPELLETIER M, et al. Torcapocytochrome negatively autoregulates thetrimethylamine N-oxide (TMAO) reductase operon in Escherichia coli[J]. Molecular Microbiology, 1999, 33: 284-295.
[11] 郭修娟. 氧化三甲胺代謝相關菌的研究[D]. 青島: 中國海洋大學, 2011.
[12] LI Feng, LIU Hongying, XUE Changhu, et al. Simultaneous determination of dimethylamine, trimethylamine and trimethylaminen-oxide in aquatic products extracts by ion chromatography with nonsuppressed conductivity detection[J]. Journal of Chromatography A, 2009, 1216(31): 5924-5926.
[13] DYER W J, MOUNSEY Y A. Amines in fish muscleⅡ. Development of trimethylamine and other amines[J]. Journal of the Fisheries Research Board of Canada, 1945, 30: 91-98.
[14] WZOREK B, MOCHALSKI P, SLIWKA I. Application of GC-MS with a SPME and thermal desorption technique for determination of dimethylamine and trimethylamine in gaseous samples for medical diagnostic purposes[J]. Journal of Breath Research, 2010, 4: 1-6.
[15] TIMM M, JORGENSEN B M. Simultaneous determination of ammonia, dimethylamine, trimethylamine and trimethylamine-noxide in fish extracts by capillary electrophoresis with indirect UV-detection[J]. Food Chemistry, 2002, 76: 509-518.
[16] SIMEONIDOU S, GOVARIS A, VARELTZIS K. Effect of frozen storage on the quality of whole sh and llets of horse mackerel (Trachurus trachurus) and Mediterranean hake (Merluccius mediterraneus)[J]. Zeitschrift fur Lebensmittel-Untersuchung und-Forschung A, 1997, 204: 405-410.
[17] 宋丹陽, 周德慶, 杜永芳, 等. 氧化三甲胺酶研究進展[J]. 食品科學, 2007, 28(1): 350-353.
[18] ARGUELLO Y M , PAIVA J B, PENHA R A , et al. Participation of genes involved in the process of anaerobic respiration of infection in chickens by Salmonella Typhimurium[J]. Brazilian Journal of Veterinary Pathology, 2010, 3(1): 2-8.
Difference in Trimethylamine Oxide Metabolism by Common Microorganisms in Food Products
WU Xiang, HAN Wei-wei, WANG Shi-ping*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Based on the metabolic utilization of trimethylamine oxide (TMAO), six common food spoilage microorganisms (S. aureus, E. aerogenes, E. faecalis, E. coli, L. monocytogenes and S. enteritidis) were classified by analyzing their effects on physicochemical properties of PCA medium containing TMAO. Subsequently, TMAO metabolites were analyzed by using non-suppressed ion chromatography and identified mainly as trimethylamine. Finally, different physical and chemical indicators (pH, conductivity, turbidity and TMA content) of the culture medium were plotted against culture time. The generation of TMA can affect the conductivity and pH of the medium, and this effect has a significant difference depending on the bacterial species.
trimethylamine oxide (TMAO); ion chromatography; electrochemical analysis; microorganism; rapid detection technology
TS207.4
A
1002-6630(2014)01-0189-05
10.7506/spkx1002-6630-201401037
2013-01-16
北京朝陽區食品安全監管體系構建及關鍵技術研究與應用項目(Z121100000312080)
吳翔(1988—),男,碩士研究生,研究方向為食品營養與安全。E-mail:791961508@qq.com
*通信作者:王世平(1959—),男,教授,碩士,研究方向為食品營養與安全。E-mail:wang744447@126.com

