多黏類芽孢桿菌JSa-9電轉(zhuǎn)化方法的優(yōu)化
高 玲,鄧 陽,陸兆新,呂鳳霞,別小妹*
(南京農(nóng)業(yè)大學食品科技學院,江蘇 南京 210095)
多黏類芽孢桿菌JSa-9電轉(zhuǎn)化方法的優(yōu)化
高 玲,鄧 陽,陸兆新,呂鳳霞,別小妹*
(南京農(nóng)業(yè)大學食品科技學院,江蘇 南京 210095)
為建立多黏類芽孢桿菌JSa-9菌株的高效電擊轉(zhuǎn)化體系,本實驗研究菌體培養(yǎng)時間、電場強度、電擊緩沖液、質(zhì)粒用量以及電擊后復蘇培養(yǎng)時間等因素對JSa-9菌株電轉(zhuǎn)化效率的影響。結(jié)果表明:Paenibacillus polymyxa JSa-9培養(yǎng)至OD595nm為0.3時,電轉(zhuǎn)化效率最高,為0.12×103CFU/μg DNA;用0.5 mol/L甘露醇、0.5 mol/L山梨醇以及10%甘油的電擊緩沖液洗滌細胞,在電場強度17.5 kV/cm、電阻200Ω,電容25 μF的電擊條件下,加入1.0 μg/100 mL質(zhì)粒DNA,復蘇培養(yǎng)時間18 h,電轉(zhuǎn)化效率達到約為0.36×103CFU/μg DNA;制備P. polymyxa JSa-9原生質(zhì)體,在電場強度5.0 kV/cm的電擊條件下,加入0.8 μg/100 mL質(zhì)粒DNA,電轉(zhuǎn)化效率較感受態(tài)電轉(zhuǎn)提高到約1.0×103CFU/μg DNA。
多黏類芽孢桿菌JSa-9;電轉(zhuǎn)化;轉(zhuǎn)化效率
電轉(zhuǎn)化的效率高于化學方法制備感受態(tài)細胞的轉(zhuǎn)化率,而且所需設(shè)備簡單,研究方法較方便、省時,是迄今為止將質(zhì)粒DNA導入芽孢桿菌的首選方法。目前已被成功的應用于Bacillus subtilis、B. cereus、B. licheniformis、B. pseudofimus、Paenibacillus polymyxa等的轉(zhuǎn)化中[1-6],但是由于不同菌株的生理生化特性、細胞壁構(gòu)造等的差異,轉(zhuǎn)化效率還因菌株而異。
1989年,Vehmaanper?[7]提出一種適用于芽孢桿菌如枯草芽孢桿菌和淀粉液化芽孢桿菌的電轉(zhuǎn)化方法。該法使用生長培養(yǎng)基為LBSP(LB含0.25 mol/L蔗糖和50 mmol/L鉀鹽緩沖液,pH 7.2),電擊洗液為SHMG(0.25 mol/L蔗糖含1 mmol/L HEPES,1 mmol/L MgCl2和10%甘油),恢復培養(yǎng)基是LBSPG(LBSP含10%甘油)。但該方法轉(zhuǎn)化效率很低,作為表達菌株是可以的,但作為建立分子基因庫則遠遠不夠,所以Xue Gangping等[8]于1999年在上述方法的基礎(chǔ)上作出改進,通過在電擊保護液中添加適量的高滲透劑如山梨醇和甘露醇,大大提高了轉(zhuǎn)化效率。前期的研究表明,多黏類芽孢桿菌JSa-9能產(chǎn)生兩大類抗菌脂肽LI-F和Polymyxin以及一種大分子抗菌糖蛋白,對細菌和真菌都具有廣譜的抑菌活性;在食品工業(yè)中,開發(fā)新型天然抗菌物質(zhì)將具有巨大應用潛能。本實驗通過將Paenibacillus polymyxa JSa-9培養(yǎng)到恰當?shù)膶?shù)生長期后,在電轉(zhuǎn)化過程中添加高滲透劑作為電擊保護液的基礎(chǔ)上摸索最適的P. polymyxa JSa-9的轉(zhuǎn)化條件以提高轉(zhuǎn)化效率的處理工藝。增加了電擊后的細胞存活率從而高效地使質(zhì)粒導入多黏類芽孢桿菌中,并能穩(wěn)定復制和傳遞,細胞存活率和電轉(zhuǎn)化效率均有很大程度的提高。為日后對菌株JSa-9進行基因工程研究及提高其抗菌物質(zhì)產(chǎn)量提供參考。
1 材料與方法
1.1 菌株和質(zhì)粒
P. polymyxa JSa-9 本實驗室分離并保藏于中國普通微生物菌種保藏管理中心(CGMCC4314);質(zhì)粒pHT43德國MoBiTec公司,質(zhì)粒片段大小為8.1 kb,含有氯霉素抗性基因,氯霉素片段大小約為1.2 kb;重組質(zhì)粒PMD-spooA∷Cm和PMD-abrB∷Cm 本研究室前期構(gòu)建。
1.2 培養(yǎng)基
LB培養(yǎng)基:蛋白胨1 g、酵母膏0.5 g、NaCl 1 g,蒸餾水100 mL,pH值調(diào)至7.0~7.2,121 ℃、20 min滅菌備用;生長培養(yǎng)基:LB+0.5 mol/L山梨醇;復蘇培養(yǎng)基:LB+0.5 mol/L山梨醇+0.38 mol/L甘露醇;高滲溶液SMM:蔗糖17.15 g、MgCl20.4273g、順丁烯二酸0.233 6 g,雙蒸水100 mL,pH 6.5,于115 ℃、30 min,滅菌備用;溶菌酶液:用SMM配制溶菌酶液,質(zhì)量濃度分別為10 mg/mL與50 mg/mL,再用孔徑為0.22 μm的無菌濾器過濾除菌,分裝成單次使用的小份,-20 ℃保存;再生培養(yǎng)基:牛肉膏 5.0 g、蛋白胨10.0 g、NaCl 5.0 g、葡萄糖 10.0 g、CaCl20.03 mol/L、MgCl20.02 mol/L、L-色氨酸0.2g/L、丁二酸鈉0.1 mol/L,蒸餾水1 000 mL,pH值調(diào)至7.0~7.2,于121℃、20 min滅菌備用。
1.3 試劑
UNIQ-10柱式質(zhì)粒小量抽提試劑盒、UNIQ-10柱式細菌基因組提取試劑盒、UNIQ-10柱式PCR產(chǎn)物純化試劑盒、UNIQ-10柱式膠回收試劑盒 生工生物工程(上海)股份有限公司;限制性內(nèi)切酶、連接酶 日本TaKaRa公司;氯霉素(4~5μg/mL) 美國Sigma公司。1.4 儀器與設(shè)備
凝膠成像系統(tǒng)、JS-380C全自動數(shù)碼凝膠成像分析儀 上海培清科技有限公司;核酸水平電泳儀、MicroPulserTM電擊轉(zhuǎn)化儀、PowerPacTMHC;DYY-6B穩(wěn)流穩(wěn)壓電泳儀 美國Bio-Rad公司;高效液相色譜儀、Agilent 1100 Series(VWD檢測器) 美國Agilent公司;LNG-T88臺式快速離心濃縮干燥器 江蘇太倉市華美生化儀器廠;UV-2450紫外-可見分光光度計 日本Shimadzu公司;WH-3微型旋渦混合儀 上海滬西分析儀器廠;JY98-III超聲波細胞粉碎機 寧波新芝科學儀器研究所;PTC-100TM和PTC-200TMPCR儀 MJ Research公司。
1.5 方法
1.5.1 感受態(tài)細胞的制備
將P. polymyxa JSa-9單菌落接入30 mL LB培養(yǎng)基中,30℃、180 r/min振蕩培養(yǎng)20 h,然后按1∶30的比例轉(zhuǎn)接至30 mL生長培養(yǎng)基中,30℃、180 r/min培養(yǎng)至一定濃度后,冰浴20 min使細菌停止生長,4℃、5 000×g離心20 min收集菌體細胞,用預冷的電擊緩沖液洗滌菌體3 次,培養(yǎng)物懸浮于適量的電擊緩沖液中使得細胞濃度約為1.0×108個/mL。
1.5.2 JSa-9菌株的電擊轉(zhuǎn)化及轉(zhuǎn)化子的驗證
取2 μL質(zhì)粒DNA(50 ng/μL)與50 μL冰冷的感受態(tài)細胞混勻,轉(zhuǎn)入至1 mm冰置電轉(zhuǎn)杯中,冰浴30 min后設(shè)定電擊參數(shù)電擊。電擊結(jié)束后立即加入1 mL復蘇培養(yǎng)基,菌液于30 ℃、120 r/min緩慢振蕩培養(yǎng)12 h后涂布于氯霉素抗性平板,培養(yǎng)24 h后觀察轉(zhuǎn)化子個數(shù)。
對含有氯霉素的LB平板上生長的單菌落先進行形態(tài)學判斷,然后隨機挑選形態(tài)上與JSa-9野生菌株一致的菌落接種于含氯霉素的LB液體培養(yǎng)基中,30 ℃、180 r/min搖床培養(yǎng)至OD600nm值約為0.6。用質(zhì)粒提取試劑盒從各轉(zhuǎn)化子培養(yǎng)物中提取出質(zhì)粒,并將其作為模板,通過氯霉素抗性基因上下游引物聚合酶鏈式反應(polymerase chain reaction,PCR)擴增氯霉素抗性基因。擴增產(chǎn)物以1%瓊脂糖凝膠電泳檢測分析,如在約1 200 bp處出現(xiàn)目的條帶,則證明P. polymyxa JSa-9能在抗性平板上生長是由于轉(zhuǎn)入氯霉素抗性基因所致;另外將提取得到的質(zhì)粒與原質(zhì)粒pHT43同時進行電泳檢測,如二者條帶位置相同則進一步證明質(zhì)粒pHT43已轉(zhuǎn)化入P. polymyxa JSa-9中,并且使其帶有氯霉素的篩選抗性。
PCR引物委托生工生物工程(上海)股份有限公司合成。上游引物:5’-ATGAACTTTAAT AAAATTGATTTAG-3’,下游引物:5’-TTATAAAAGCCAGTCATTAGGCC-3’。
1.5.3 JSa-9菌株不同生長時期對轉(zhuǎn)化率的影響
選擇不同生長階段的P. polymyxa JSa-9培養(yǎng)物制成感受態(tài)細胞,采用含0.5 mol/L山梨醇、0.5 mol/L甘露醇、10%甘油的電擊緩沖液,電場強度17.5 kV/cm、電阻200 Ω、電容25 μF,進行電擊轉(zhuǎn)化。
1.5.4 不同電場強度和不同電阻值對轉(zhuǎn)化率的影響
電場強度過高會造成細胞的大量死亡,而電場強度過低則不能形成細胞穿孔。本實驗測定10、12.5、15、17.5、20、22 kV/cm電場強度下JSa-9菌株的電擊轉(zhuǎn)化效率。用前述優(yōu)化后的最適生長時期的菌體做感受態(tài)細胞,采用含0.5 mol/L山梨醇、0.5 mol/L甘露醇、10%甘油的電擊緩沖液,電阻為200 Ω,電容25 μF,進行電擊轉(zhuǎn)化。
對芽孢桿菌的電擊轉(zhuǎn)化大多采用200 Ω[9],也有報道采用400 Ω[10]。因此,本實驗比較了200 Ω和400 Ω對JSa-9菌株電擊轉(zhuǎn)化效率的影響。用前述優(yōu)化后的最適生長時期的菌體制備感受態(tài)細胞,采用含0.5 mol/L山梨醇、0.5 mol/L甘露醇、10%甘油的電擊緩沖液,電場強度為1750 V/cm、電容25 μF,進行電擊轉(zhuǎn)化。
1.5.5 電擊緩沖液和不同質(zhì)粒質(zhì)量濃度對轉(zhuǎn)化率的影響
前期實驗結(jié)果證明,采用含0.5 mol/L山梨醇、0.5 mol/L甘露醇、10%甘油的電擊緩沖液能轉(zhuǎn)化成功,選擇前述已優(yōu)化的其他電擊條件,向基本電擊緩沖液中添加不同濃度的山梨醇和甘露醇,來研究電擊緩沖液對電轉(zhuǎn)化效率的影響[10]。
Rittich等[11]報道了革蘭氏陽性菌的電轉(zhuǎn)化效率與質(zhì)粒DNA質(zhì)量濃度的關(guān)系。因此,在已優(yōu)化的電擊條件下,用不同質(zhì)量濃度的質(zhì)粒DNA進行電擊轉(zhuǎn)化。
1.5.6 復蘇培養(yǎng)時間的優(yōu)化
使用前述已獲得的最優(yōu)轉(zhuǎn)化條件對復蘇培養(yǎng)時間進行優(yōu)化,選取不同復蘇培養(yǎng)時間分別為3、6、9、12、16、18、20 h,進行電擊轉(zhuǎn)化。
1.5.7 原生質(zhì)體電轉(zhuǎn)化研究
取P. polymyxa JSa-9新鮮斜面接種于LB液體培養(yǎng)基中,30 ℃振蕩培養(yǎng)22 h,取1.0 mL菌液轉(zhuǎn)入新鮮的30 mL液體培養(yǎng)基中繼續(xù)培養(yǎng)4~5 h,取8 mL菌液5 000 r/min離心10 min收集菌體,用SMM液洗滌2 次,用5 mL SMM重懸,加入溶菌酶液使酶終質(zhì)量濃度為0.1 mg/mL,混合均勻,置于溫水浴中保溫酶解7 min,酶解結(jié)束后立即加入4 mL SMM稀釋,2 500 r/min離心10 min,用SMM液洗滌2次以清除酶液,將原生質(zhì)體懸浮于SMM中使得細胞濃度約為1.0×108個/mL。
取100 ?L原生質(zhì)體與8 ?L質(zhì)粒DNA(100 ng/?L)混勻放置5 min,加入電擊杯內(nèi),設(shè)置電擊參數(shù)電擊。電擊完畢,加入600 ?L SMM,吸出培養(yǎng)液,30 ℃培養(yǎng)一定時間,涂布于含有氯霉素抗性的再生平板上30 ℃培養(yǎng)3 d,觀察轉(zhuǎn)化子數(shù),計算轉(zhuǎn)化效率。

2 結(jié)果與分析
2.1 P. polymyxa JSa-9的生長曲線及細胞生長狀態(tài)對轉(zhuǎn)化效率的影響
選擇不同生長階段的P. polymyxa JSa-9培養(yǎng)物制成感受態(tài)細胞,在電場強度17.5 kV/cm、電阻200 Ω、電容25 μF的條件下進行電擊。結(jié)果表明,不同種齡的菌體制成的感受態(tài)轉(zhuǎn)化率差別很大。由圖1可知,前2 h內(nèi)P. polymyxa JSa-9生長緩慢,菌體的轉(zhuǎn)化效率幾乎為0;從3 h起,進入生長旺盛的對數(shù)期,當OD595nm值為0.3時,菌體轉(zhuǎn)化效率最高,DNA的轉(zhuǎn)化效率約為0.12×103CFU/μg DNA;隨著培養(yǎng)時間的延長,轉(zhuǎn)化效率逐漸下降,當OD595nm值為0.86時,此時菌體處于對數(shù)生長末期,轉(zhuǎn)化效率已降至0,沒有得到轉(zhuǎn)化子。這可能是由于對數(shù)生長初期細胞生命力最旺盛,對電擊造成的損傷修復能力強,使得電擊后的細胞保持較高的存活率,因此相應的轉(zhuǎn)化效率也高。然而,某些芽孢桿菌培養(yǎng)至對數(shù)生長后期或穩(wěn)定期才最適合電擊轉(zhuǎn)化,因為此時期為芽孢形成前期,細胞壁較薄,容易接收外來DNA而發(fā)生遺傳轉(zhuǎn)化[12-13]。因此,有必要明確不同菌株轉(zhuǎn)化的最佳生長時期。
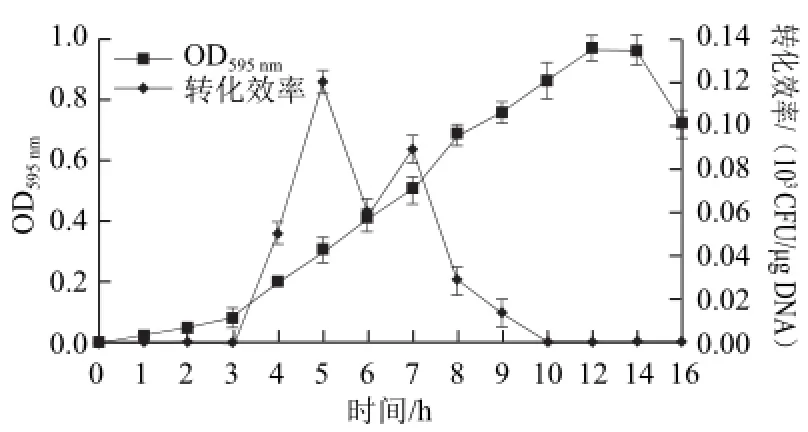
圖1 不同生長時期的多黏類芽孢桿菌JSa-9菌體細胞對轉(zhuǎn)化效率的影響Fig.1 Effect of cell growth phase on transformation efficiency of P. polymyxa strain JSa-9
2.2 電場強度對JSa-9菌株電轉(zhuǎn)化效率的影響
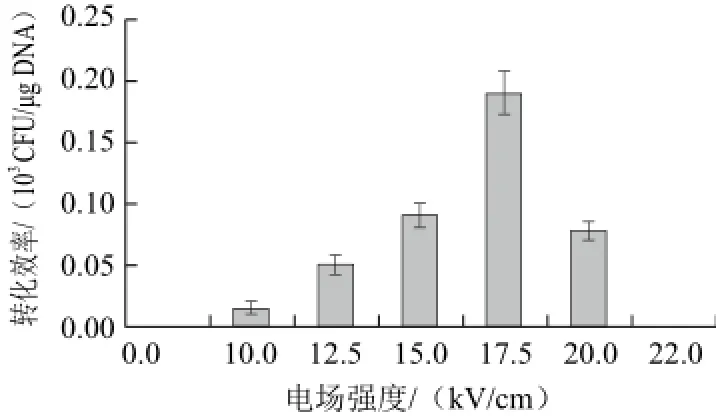
圖2 不同電場強度對多黏類芽孢桿菌JSa-9菌株電轉(zhuǎn)化效率的影響Fig.2 Effect of electric field intensity on transformation efficiency of P. polymyxa strain JSa-9
電場強度是影響電擊轉(zhuǎn)化效率的又一重要參數(shù)[14-15]。不同電場強度下JSa-9菌株的電擊轉(zhuǎn)化效率測定結(jié)果如圖2所示,在低場強時(如10 kV/cm和12.5 kV/cm),轉(zhuǎn)化效率低于0.1×103CFU/μg DNA;當場強為17.5kV/cm時,細胞的轉(zhuǎn)化效率達到最高,轉(zhuǎn)化效率為0.19×103CFU/μg DNA;但是,若進一步升高電場強度至22 kV/cm時,感受態(tài)細胞的轉(zhuǎn)化效率降至0。由于P. polymyxa JSa-9屬于革蘭氏陽性細菌細胞壁厚,場強低時轉(zhuǎn)化效率低,而過高的場強雖可以增強外源基因進入菌體細胞的機率,但同時也會增加細菌細胞的死亡概率,使得轉(zhuǎn)化效率下降。因此,最佳的轉(zhuǎn)化效率需要同時兼顧這兩方面。
2.3 不同電阻值對JSa-9菌株電轉(zhuǎn)化效率的影響

圖3 電阻值200 Ω(A)和440000 Ω(B)對多黏類芽孢桿菌JSaa--99菌株電轉(zhuǎn)化效率的影響Fig.3 Effect of electric resistance on transformation efficiency of P. polymyxa strain JSa-9
測試電阻值在200 Ω和400 Ω條件下JSa-9菌株的電擊轉(zhuǎn)化效率,結(jié)果見圖3,在電阻值為200 Ω和400 Ω的條件下獲得的電轉(zhuǎn)化效率差別不大,200 Ω時的轉(zhuǎn)化效率達到0.13×103CFU/μg DNA,略高于400 Ω時的0.1×103CFU/μg DNA。故后續(xù)實驗電擊過程采用200 Ω電阻值。
2.4 電擊緩沖液對JSa-9菌株電轉(zhuǎn)化效率的影響

表1 不同電擊緩沖液對多黏類芽孢桿菌JSa-9菌株電轉(zhuǎn)化效率的影響Table1 Effect of electroporation buffer on transformation efficiency ooff P. polymyxa strain JSSaa--99
選擇前述已優(yōu)化的最佳電擊條件,向基本電擊緩沖液中添加不同濃度的山梨醇和甘露醇,來研究電擊緩沖液對電轉(zhuǎn)化效率的影響[5,8,16-18]。前期用0.625 mol/L蔗糖作為電擊緩沖液,轉(zhuǎn)化效率為0.12×103CFU/μg DNA。表1結(jié)果表明,用甘油作為電擊緩沖液時,未得到轉(zhuǎn)化子;當加入0.5 mol/L的山梨醇或甘露醇時,轉(zhuǎn)化率略有提高;當山梨醇及甘露醇以等濃度(均為0.5 mol/L)加入時,電轉(zhuǎn)化效率最高,為0.21×103CFU/μg DNA,高于只加入蔗糖的電擊緩沖液條件。因此,確定電擊緩沖液的最佳組成為0.5 mol/L甘露醇、0.5 mol/L山梨醇以及10%甘油。由于用高滲透溶液作為電擊緩沖液來洗滌菌體細胞,可以降低細胞表面的離子強度;還可以平衡菌體內(nèi)高的膨壓,減少了電擊時高場強對細胞的損傷,提高了細胞的存活率,從而提高轉(zhuǎn)化效率。
2.5 質(zhì)粒DNA質(zhì)量濃度對JSa-9菌株電轉(zhuǎn)化效率的影響
在已優(yōu)化的電擊條件下,用不同濃度的質(zhì)粒DNA進行電擊,以得到最高的電轉(zhuǎn)化效率,結(jié)果見圖4。在0.5~1.0 μg/100 μL的質(zhì)粒質(zhì)量濃度范圍內(nèi),適當?shù)靥岣哔|(zhì)粒DNA的質(zhì)量濃度可以提高多黏類芽孢桿菌的轉(zhuǎn)化效率,轉(zhuǎn)化效率最高為0.3×103CFU/μg DNA;但是,當質(zhì)粒DNA質(zhì)量濃度繼續(xù)升高時,轉(zhuǎn)化效率反而降低。如當質(zhì)粒質(zhì)量濃度為2.0 μg/100 μL時,轉(zhuǎn)化效率僅為最高轉(zhuǎn)化效率的30%;若質(zhì)粒質(zhì)量濃度進一步升高至3.0 μg/100 μL時,將不能獲得轉(zhuǎn)化子。

圖4 不同質(zhì)粒質(zhì)量濃度對多黏類芽孢桿菌JSa-9菌株電轉(zhuǎn)化效率的影響Fig.4 Effect of plasmid DNA concentration on transformation efficiency of P. polymyxa strain JSa-9
2.6 陽性克隆子的篩選鑒定

圖5 質(zhì)粒pHT43P. polymyxa JSa-9轉(zhuǎn)化子的驗證Fig.5 Confirmation of the transformants from P. polymyxa JSa-9
為驗證電擊轉(zhuǎn)化P. polymyxa JSa-9后得到的轉(zhuǎn)化子,隨機選擇5株轉(zhuǎn)化子提取質(zhì)粒進行篩選鑒定。電泳結(jié)果顯示,所提取的質(zhì)粒與質(zhì)粒pHT43帶型大小均完全一樣(圖5A)。再以提取得到的質(zhì)粒為模板PCR擴增氯霉素抗性基因序列,結(jié)果表明這些質(zhì)粒DNA均能擴增得到1 200 bp的氯霉素抗性基因(圖5B)。因此,抗性平板上生長出的轉(zhuǎn)化子均為陽性轉(zhuǎn)化子,質(zhì)粒pHT43成功轉(zhuǎn)入宿主細胞,使得野生型P. polymyxa JSa-9菌株獲得氯霉素抗性。
2.7 復蘇培養(yǎng)時間的優(yōu)化

圖6 復蘇培養(yǎng)時間對菌株JSa-9電轉(zhuǎn)化效率的影響Fig.6 Effect of recovery time on transformation efficiency of P. polymyxa strain JSa-9
本實驗使用前述已獲得的最優(yōu)轉(zhuǎn)化條件對復蘇培養(yǎng)時間進行優(yōu)化,由圖6可知,復蘇培養(yǎng)時間僅為3~9 h內(nèi),均不能獲得轉(zhuǎn)化子;當復蘇培養(yǎng)時間延長至12 h,抗性平板上出現(xiàn)一定數(shù)量的轉(zhuǎn)化子,但篩選鑒定表明,其中只有約60%的轉(zhuǎn)化子為陽性轉(zhuǎn)化子,電轉(zhuǎn)化效率為0.12×103CFU/μg DNA;隨著時間的延長轉(zhuǎn)化效率隨之提高,當培養(yǎng)至18 h時獲得最高轉(zhuǎn)化效率,約為12 h時的3 倍;而再延長復蘇培養(yǎng)時間反而使得轉(zhuǎn)化效率有所降低。
2.8 原生質(zhì)體電轉(zhuǎn)化的研究

圖7 電場強度(A)和質(zhì)粒質(zhì)量濃度(B)對多黏類芽孢桿菌JSa-9菌株原生質(zhì)體電轉(zhuǎn)化效率的影響Fig.7 Effects of electric field intensity (A) and plasmid DNA concentration (B) on transformation efficiency of P. polymyxa strain JSa-9 protoplasts
推測革蘭氏陽性菌的細胞壁厚,密度高,很難被擊穿以使大分子通過膜穿孔進入細胞中。因此,企圖通過去除細胞壁,制備P. polymyxa JSa-9原生質(zhì)體進行電轉(zhuǎn),從而提高轉(zhuǎn)化效率。不同電場強度下JSa-9菌株原生質(zhì)體的電擊轉(zhuǎn)化效率測定結(jié)果如圖7A所示,原生質(zhì)體的轉(zhuǎn)化率隨著電場強度的升高逐漸降低;在電場強度為5 kV/cm時,原生質(zhì)體的轉(zhuǎn)化效率達到最高,轉(zhuǎn)化效率為1.25×103CFU/μg DNA;當電場強度升高到15 kV/cm或更高時,原生質(zhì)體的的轉(zhuǎn)化效率降至0。
在最適的電場強度5 kV/cm條件下,用不同質(zhì)量濃度的質(zhì)粒DNA進行電擊,以得到最高的電轉(zhuǎn)化效率,結(jié)果見圖7B。在0.5~1.2 μg/100 mL的質(zhì)粒質(zhì)量濃度范圍內(nèi),適當?shù)靥岣哔|(zhì)粒DNA的質(zhì)量濃度可以提高多黏類芽孢桿菌原生質(zhì)體的轉(zhuǎn)化效率,當質(zhì)粒DNA的質(zhì)量濃度為0.8 μg/100 mL時,轉(zhuǎn)化效率最高為1.0×103CFU/μg DNA;但是,當質(zhì)粒DNA質(zhì)量濃度繼續(xù)升高時,轉(zhuǎn)化效率反而降低。
利用上述原生質(zhì)體電轉(zhuǎn)條件,能夠?qū)⑽覀儤?gòu)建的重組質(zhì)粒(PMD-spooA∷Cm和PMD-abrB∷Cm)轉(zhuǎn)入P. polymyxa JSa-9中,結(jié)果如圖8所示,在電場強度為5.0 kV/cm時,重組質(zhì)粒的轉(zhuǎn)化效率分別為0.37×103CFU/μg DNA和0.25×103CFU/μg DNA,重復實驗,轉(zhuǎn)化效率較為穩(wěn)定。

圖8 不同的重組質(zhì)粒轉(zhuǎn)化多黏類芽孢桿菌JSa-9原生質(zhì)體Fig.8 Effect of recombinant plasmid on transformation efficiency of P. polymyxa strain JSa-9 protoplasts

圖9 重組質(zhì)粒轉(zhuǎn)化P. polymyxaJSa-9轉(zhuǎn)化子的驗證Fig.9 Confirmation of the transformants from P. polymyxa JSa-9
為驗證電擊轉(zhuǎn)化原生質(zhì)體P. polymyxa JSa-9后得到的轉(zhuǎn)化子,隨機選擇3~4株P(guān)CR擴增重組質(zhì)粒攜帶的氯霉素抗性基因序列,結(jié)果如圖9所示,從4株轉(zhuǎn)化子擴增重組質(zhì)粒PMD-spooA∷Cm攜帶的氯霉素抗性基因序列,2株得到1 200 bp的氯霉素抗性基因,2株為假陽性的轉(zhuǎn)化子;從3 株轉(zhuǎn)化子擴增重組質(zhì)粒PMD-abrB∷Cm攜帶的氯霉素抗性基因序列,3 株均能得到1 200 bp的氯霉素抗性基因。
3 討 論
電轉(zhuǎn)化法是用高壓脈沖電流擊破細胞膜或在細胞膜表面擊出小孔,從而使外源基因通過這些小孔進入細胞[19]。影響微生物細胞電轉(zhuǎn)化效率的因素主要有細胞的生長狀況、電擊緩沖液組成、電場強度、質(zhì)粒質(zhì)量濃度等[8]。
另外,以往文獻研究芽孢桿菌電轉(zhuǎn)化條件時,采用的電擊后菌液復蘇培養(yǎng)時間通常為3~6h,而Murray等[20]在轉(zhuǎn)化1株P(guān). larvae時,通過延長復蘇時間有效地提高了轉(zhuǎn)化效率。本研究發(fā)現(xiàn),適當延長電擊后復蘇培養(yǎng)時間可提高轉(zhuǎn)化效率,但同時也出現(xiàn)一定量的非陽性轉(zhuǎn)化子。可能的原因是由于較長時間的復蘇培養(yǎng)使得菌體在氯霉素誘導下逐漸獲得一定的抗性,而非質(zhì)粒pHT43成功轉(zhuǎn)入宿主細胞。優(yōu)化試驗結(jié)果顯示,電擊后復蘇培養(yǎng)17 h涂抗性平板可獲得最高的轉(zhuǎn)化效率,約為0.5×103CFU/μg DNA。
革蘭氏陽性細菌比陰性菌的電轉(zhuǎn)化效率要低,究其原因仍然沒有確切的證明,推測可能是革蘭氏陽性菌的細胞壁比陰性菌細胞壁厚,密度高,更難被擊穿以使大分子通過膜穿孔進入到細胞中。從增加電場強度并且保護細胞存活這兩方面來越過此瓶頸從而提高轉(zhuǎn)化效率。2009年,莫靜燕等[21]通過酶解法對地衣芽孢桿菌工業(yè)生產(chǎn)菌株Bacillus licheniformis 303原生質(zhì)體的制備及再生條件進行研究,在此條件下,采用聚乙二醇(polyethylene glycol,PEG)法將游離型質(zhì)粒pHY-P43-secQ轉(zhuǎn)化宿主菌B.licheniformis 303,轉(zhuǎn)化效率可達10~15 CFU/μg DNA。
但是,在已知的范圍還少有針對野生型多黏類芽孢桿菌進行原生質(zhì)體遺傳轉(zhuǎn)化研究的報道。因此,在已建立的P. polymyxa JSa-9高效電擊轉(zhuǎn)化體系的研究基礎(chǔ)上。本實驗仍以P. polymyxa JSa-9為研究對象,結(jié)合已有的原生質(zhì)體制備和再生的條件,針對pHT43目的質(zhì)粒,建立了P. polymyxa JSa-9原生質(zhì)體電轉(zhuǎn)化體系,電轉(zhuǎn)效率可達到1.25×103CFU/μg DNA,是制備感受態(tài)細胞直接電轉(zhuǎn)的轉(zhuǎn)化效率的2.5倍,并且能夠?qū)?gòu)建的重組質(zhì)粒(PMD-spooA∷Cm和PMD-abrB∷Cm)轉(zhuǎn)入P. polymyxa JSa-9中,轉(zhuǎn)化效率穩(wěn)定,為今后對菌株JSa-9進行基因工程研究及提高其抗菌物質(zhì)產(chǎn)量提供支持。
[1] TURGEON N, LAFLAMME C, HO J, et al. Elaboration of an electroporation protocol for Bacillus cereus ATCC 14579[J]. Journal of Microbiological Methods, 2006, 67(3): 543-548.
[2] 周天鴻, 李月琴, 劉飛鵬, 等. 枯草桿菌電擊法轉(zhuǎn)化[J]. 暨南大學學報, 1992, 13(1): 65-69.
[3] ITO M, NAGANE M. Improvement of the electro-transformation efficiency of facultatively alkaliphilic Bacillus pseudof rmus OF4 by high osmolarity and glycine treatment[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(12): 2773-2775.
[4] 劉敏勝, 邢新會. 專性嗜堿芽孢桿菌Bacillus pseudof rmus的基因?qū)敕椒╗J]. 化工學報, 2006, 57(4): 922-926.
[5] ROSADO A, DUARTE G F, SELDIN L. Optimization of electroporation procedure to transform B. polymyxa SCE2 and other nitrogen-fixing Bacillus[J]. Journal of Microbiological Methods, 1994, 19(1): 1-11.
[6] OHSE M, KAWADE K, KUSAOKE H. Effects of DNA topology on transformation efficiency of Bacillus subtilis ISW 1214 by electroporation[J]. Bioscience, Biotechnology, and Biochemistry, 1997, 61(6): 1019-1021.
[7] VEHMAANPER? J. Transformation of Bacillus amyloliquefaciens by electroporation[J]. FEMS Microbiology Letters, 1989, 61(1): 165-169.
[8] XUE Gangping, JOHNSON J S, DALRYMPLE B P. High osmolarity improves the electro-transformation efficiency of the gram-positive bacteria Bacillus subtilis and Bacillus licheniformis[J]. Journal of Microbiological Methods, 1999, 34(3): 183-191.
[9] PENG D, LUO Y, GUO S, et al. Elaboration of an electroporation protocol for large plasmids and wild-type strains of Bacillus thuringiensis[J]. Journal of Applied Microbiology, 2009, 106(6): 1849-1858.
[10] ROMERO D, PéREZ-GARC?A A, VEENING J W, et al. Transformation of undomesticated strains of Bacillus subtilis by protoplast electroporation[J]. Journal of Microbiological Methods, 2006, 66(3): 556-559.
[11] RITTICH B, ?PANOV? A. Electrotransformation of bacteria by plasmid DNAs: statistical evaluation of a model quantitatively describing the relationship between the number of electrotransformants and DNA concentration[J]. Bioelectrochemistry and Bioenergetics, 1996, 40(2): 233-238.
[12] 李艷琴, 申泉, 趙春貴, 等. 桓病生防菌成團泛菌電擊轉(zhuǎn)化條件的研究[J]. 微生物學通報, 2000, 27(4): 245-249.
[13] 陳乃用. 電穿孔法在細菌質(zhì)粒轉(zhuǎn)化中的應用[J]. 微生物學通報, 1991, 18(2): 97-103.
[14] CHANG D C, CHASSY B M, SAUNDERS J A, et al. Guide to electroportion and electrofusion[M]. New York: Academic Press, 1992: 1-8.
[15] McDONALD I, RILEY P, SHARP R, et al. Factors affecting the electroporation of Bacillus subtilis[J]. Journal of Applied Microbiology, 1995, 79(2): 213-218.
[16] ZHANG X Z, ZHANG Y H P. Simple, fast and high-efficiency transformation system for directed evolution of cellulase in Bacillus subtilis[J]. Microbial Biotechnology, 2011, 4(1): 98-105.
[17] RICHARDS A, KRAKOWKA S, DEXTER L, et al. Trehalose: a review of properties, history of use and human tolerance, and results of multiple safety studies[J]. Food and Chemical Toxicology, 2002, 40(7): 871-898.
[18] SMITH F D, HARPENDING P R, SANFORD J C. Biolistic transformation of prokaryotes: factors that affect biolistic transformation of very small cells[J]. Journal of General Microbiology, 1992, 138(1): 239-248.
[19] 杜連祥, 路福平. 微生物學實驗技術(shù)[M]. 北京: 中國輕工業(yè)出版社, 2005: 4-7.
[20] MURRAY K D, ARONSTEIN K A. Transformation of the Gram-positive honey bee pathogen, Paenibacillus larvae, by electroporation[J]. Journal of Microbiological Methods, 2008, 75(2): 325-328.
[21] 莫靜燕, 陳獻忠, 王正祥. 地衣芽孢桿菌原生質(zhì)體的制備, 再生及轉(zhuǎn)化研究[J]. 生物技術(shù), 2009, 19(5): 75-77.
Optimization of Electroporation Conditions for Paenibacillus polymyxa JSa-9
GAO Ling, DENG Yang, LU Zhao-xin, Lü Feng-xia, BIE Xiao-mei*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
To establish an electrotransformation method for Paenibacillus polymyxa strain JSa-9, the effec ts of different factors on the transformation efficiency of strain JSa-9 by electroporation were explored by evaluating cell growth phase, electric field intensity, electroporation buffer, plasmid DNA contentation and recovery time. The results showed that a transformation efficiency of 0.12 × 103CFU transformants per μg DNA was achieved when P. polymyxa JSa-9 cell culture reached an OD595nmof 0.3. Under the conditions of 17.5 kV/cm, 200 Ω and 25 μF for electric field strength, electric resistance and capacitance, respectively, the electroporation efficiency was roughly 0.5 × 103transformants per μg DNA when adding 1.0 μg/100 mL of plasmid DNA to an electroporation buffer containing 0.5 mol/L sorbitol, 0.5 mol/L mannitol, and 10% glycerol and recovering for 17 h. Moreover, the transformation efficiency of P. polymyxa JSa-9 protoplasts was increased to approximately 1.0 × 103CFU transformants per μg DNA under electric field strength of 5.0 kV/cm upon addition of 0.8 μg/100 mL plasmid DNA.
Paenibacillus polymyxa JSa-9; electroporation; transformation efficiency
Q785
A
1002-6630(2014)11-0089-06
10.7506/spkx1002-6630-201411018
2013-05-28
國家自然科學基金面上項目(31271828);“十二五”國家科技支撐計劃項目(2011BAD23B05)
高玲(1990—),女,碩士,研究方向為食品生物技術(shù)。E-mail:2008108010@njau.edu.cn
*通信作者:別小妹(1964—),女,教授,博士,研究方向為食品微生物及生物技術(shù)。E-mail:bxm43@njau.edu.cn

