重組環糊精葡萄糖基轉移酶溫控型工程菌的構建及其培養條件的優化
凡 寧,張洪斌*,凌 凱,凌國慶,胡雪芹
(合肥工業大學醫學工程學院,安徽 合肥 230009)
重組環糊精葡萄糖基轉移酶溫控型工程菌的構建及其培養條件的優化
凡 寧,張洪斌*,凌 凱,凌國慶,胡雪芹
(合肥工業大學醫學工程學院,安徽 合肥 230009)
采用聚合酶鏈式反應(polymerase chain reaction,PCR)法從蠟狀芽孢桿菌(Bacillus cereus)中擴增了β-環糊精葡萄糖基轉移酶(β-cyclodextrin glucanotransferase,β-CGTase)基因,將該基因克隆到pBV220質粒中,轉化E.coli DH5α,經氨芐青霉素抗性篩選和酶切驗證后,得到能表達β-CGTase的重組大腸桿菌E.coli DH5α/pBVcgt。通過對工程菌產酶條件的優化,得到最佳產酶條件為:OD600nm值達到1.0、初始培養溫度30℃、發酵培養基初始pH8.0、溫度梯度誘導39℃培養0.5h,40℃培養0.5h,41℃培養1h,42℃培養2h。酶活力由優化前的445U/mL提高到956U/mL,酶活力提高了1.15倍。溫度梯度誘導比直接誘導酶活力提高20%。該酶的克隆表達以及發酵條件的研究表明,該酶能在大腸桿菌原核表達體系中高效表達。
蠟狀芽孢桿菌;β-環糊精葡萄糖基轉移酶;工程菌;表達;培養條件
環糊精葡萄糖基轉移酶(cyclodextrin glucanotransferase,CGTase,EC2.4.1.19)是一種重要的工業用酶,不僅能催化淀粉、糖原、麥芽寡聚糖等α-1,4-葡萄糖聚合物合成環糊精(cyclodextrin,CD),也可用于一些糖類和配糖物的化學改性[1]。該酶屬于α-淀粉酶家族,是一種多功能型酶,除了具有環化作用,也具有耦合和歧化作用,同時還有弱的水解作用[2]。至今已從許多微生物中分離得到CGTase,如:Bacillus sp.[3],Paenibacillus sp.[4]和Thermoanaerobacter sp.[5],其中以Bacillus sp.為主。CD是由多個D-吡喃葡萄糖單元通過α-(1,4)糖苷鍵連接成的一類環狀低聚糖。目前常用的環糊精主要有3種,分別是由6、7、8個葡萄糖單元組成的α-、β-和γ-CD[6]。CDs是一種具有內疏水外親水的筒形結構,能與許多疏水客體化合物或功能基團形成包含物,從而改變其物理或化學性質,這種特殊的性質使環糊精在食品、醫藥、農業、化妝品、環保等領域具有廣泛的應用[7-11]。目前環糊精的工業化生產均采用酶法合成,但由于野生菌株的產酶能力普遍較低以及低的轉化率、加之生成的環糊精分離提純困難等原因,導致環糊精生產成本太高,限制了它們的擴大生產和應用。因此為了獲取適合工業化生產的CGTase產酶菌株,對CGTase進行分子生物學研究,構建工程菌株,獲得穩定性好、產量高、易于分離純化的重組CGTase越來越受到重視。Petrova[12]和Lee[13]等將CGTase基因克隆并轉入到E. coli體內獲得了表達,Takano等[14]將β-CGTase基因克隆并整合到B.subtilis體內,同樣獲得了表達。目前文獻報道的重組CGTase工程菌均為異丙基硫代-β-D-半乳糖(isopropy-β-D-thiogalactoside,IPTG)誘導型,IPTG價格昂貴且去除方法復雜,一些國家已經明文規定在生產人用重組蛋白的發酵工藝中不能使用IPTG;本實驗所使用的質粒pBV220是溫控型的,操作簡單且成本低,所以倍受人們的青睞。
本實驗室通過在篩選平板中加入酚酞的方法從土壤中分離出一株能產β-環糊精葡萄糖基轉移酶(β-CGTase)的芽孢桿菌Bacillus cereus strain LGQ01,將其基因克隆到質粒pBV220中,構建了溫控型工程菌株E.coli DH5α/pBV220-CGTase(pBVcgt),并對其發酵條件進行研究,這為今后環狀糊精的酶法制備及擴大工業化生產應用打下了技術基礎,使該酶能更好的應用在淀粉加工工業中。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒
Bacillus cereus strain LGQ01由本實驗室篩選;菌株E.coli DH5α由本實驗室保存;克隆質粒PUC57和表達質粒pBV220均購自生工生物工程(上海)股份有限公司。
1.1.2 酶與試劑
限制性內切酶、T4 DNA連接酶、DNA Marker、質粒提取試劑盒和膠回收試劑盒 日本TaKaRa公司;TaqDNA聚合酶、蛋白質Marker、考馬斯亮藍R-250、氨芐青霉素(Amp)、異丙基硫代-β-D-半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)、X-gal、PCR產物純化試劑盒 生工生物工程(上海)股份有限公司;其他化學試劑均為國產分析純級。普通LB培養基[15],需要時加入終質量濃度為100?g/mL的Amp。
1.2 方法
1.2.1 β-CGTase基因的克隆
基因克隆參考文獻[16],以Bacillus cereus strain LGQ01的基因組DNA為模板,依據GenBank公布的Bacillus sp.菌株CGTase基因序列設計合成PCR所需的引物為:上游引物:5’-CGCGGATCCATGATTCGCCA AGCTTTA-3’;下游引物:5’-AAAACTGCAGTTAC CAATTTGATATG-3’。上下游引物分別含有BamH I和Pst I限制性酶切位點。PCR反應條件:94 ℃,3 min;94 ℃,30 s;55 ℃,1 min;72 ℃,2 min,30 個循環;72 ℃,10 min。將擴增得到的β-CGTase基因與PUC57載體連接后轉化E.coli DH5α感受態,采用藍白斑篩選后挑白色菌落在含有Amp的LB培養基中培養過夜,提取質粒進行酶切電泳分析和序列鑒定。序列鑒定由生工生物工程(上海)股份有限公司完成。
1.2.2 表達載體的構建及工程菌的篩選
對測序鑒定后的質粒PUC57-cgt和載體pBV220分別用BamH I和Pst I雙酶切,凝膠電泳回收后,T4 DNA連接酶16℃連接過夜。產物轉化E.coli DH5α感受態細胞,在轉化平板上經Amp初步篩選,然后小量培養用酶切電泳分析方法篩選陽性克隆。
1.2.3 β-CGTase的表達和檢測
把含有重組質粒的工程菌接種到含Amp的LB中,37 ℃、250 r/min培養過夜,然后按1%接種量轉接到含50 mL新鮮LB的三角瓶中,按上述培養條件至OD600nm值達到1.0 時,42 ℃誘導6 h后,4 ℃、8 000×g離心20 min收集菌體進行破碎,取上清檢測其活力,并用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)電泳方法[17]分析表達產物。
1.2.4 酶水解活力的測定[18]
取10 μL適當稀釋的酶液,加入0.2 mol/L甘氨酸-NaOH緩沖液(pH 8.5)0.2 mL,再加入0.2 g/100 mL可溶性淀粉0.2 mL,振蕩,于40 ℃水浴10 min,立即加0.5 mol/L醋酸0.5 mL終止反應,然后加入0.005%碘液顯色3 min,同時以蒸餾水為空白,不加酶液為對照,在700 nm波長處測定吸光度(A),一個酶活單位定義為使吸光度下降10%的酶量。
2 結果與分析
2.1 重組β-環糊精糖基轉移酶工程菌的構建及表達
將PCR產物與PUC57載體連接后,挑白色菌落小量培養,提取其質粒用BamH I和Pst I雙酶切,1.0%瓊脂糖凝膠電泳,可在約2 100 bp處看到目的基因的條帶(圖1)。以測序確證的陽性克隆的質粒為模板擴增β-CGTase基因,將經BamH I和Pst I雙酶切后的目的基因與pBV220載體連接后,得到重組表達質粒pBVcgt(圖2)。然后將重組質粒轉入E.coli DH5α感受態中,經氨芐青霉素抗性篩選和雙酶切驗證后,得到表達β-CGTase的重組大腸桿菌。重組表達質粒雙酶切驗證如圖3所示。取上清測酶活,上清液中有明顯的酶活力,SDS-PAGE電泳圖如圖4所示。說明該酶在大腸桿菌中成功獲得表達。
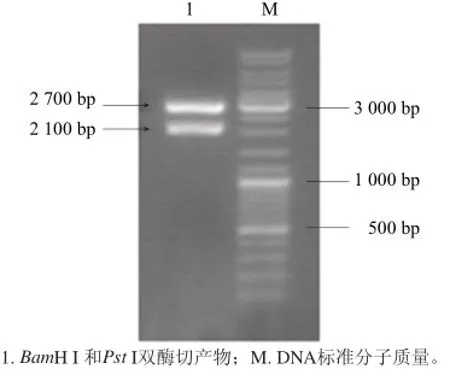
圖1 重組克隆載體PUC57-ccggtt酶切鑒定Fig.1 Restriction enzyme digestion analysis of the recombinant plasmid PUC57-cgt by agarose gel electrophoresis
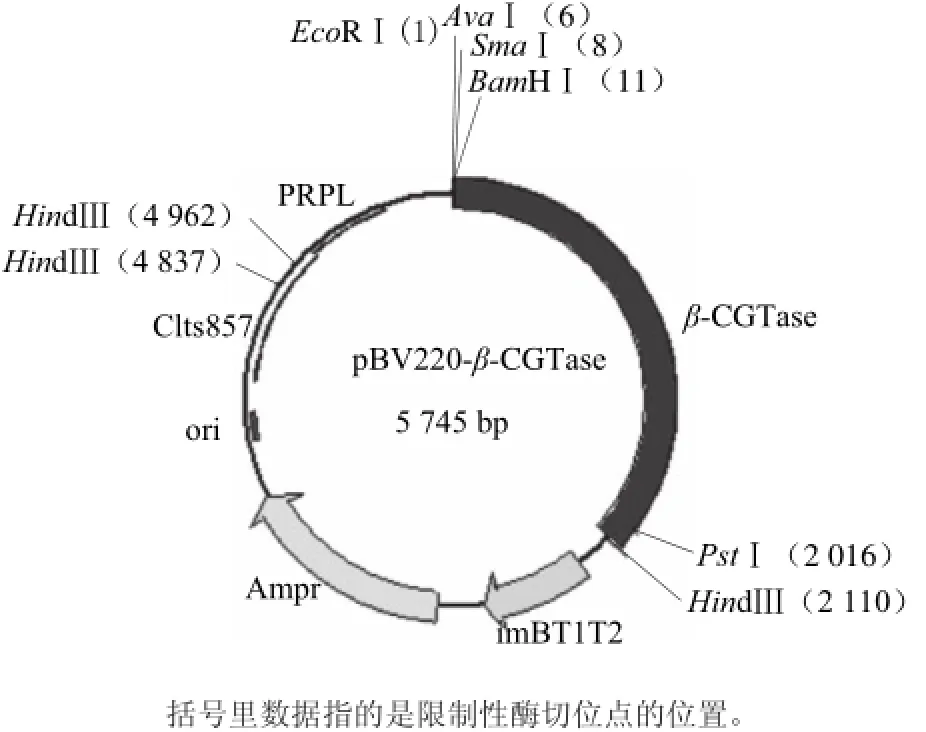
圖2 重組表達質粒pBV220--cgtFig.2 Expression plasmid pBV220-cgt
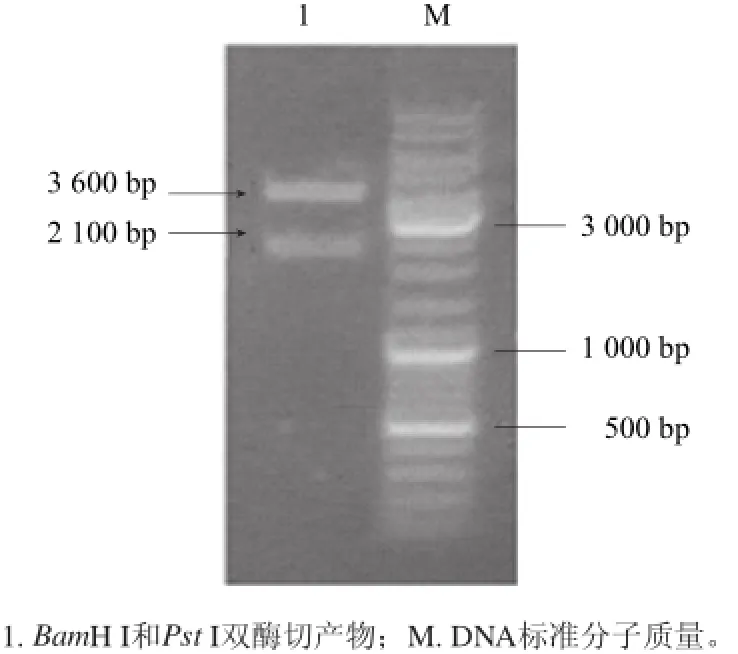
圖3 重組表達載體pBV220-cgt酶切鑒定Fig.3 Restriction enzyme digestion analysis of the recombinant plasmid BV220-cgt by agarose gel electrophoresis
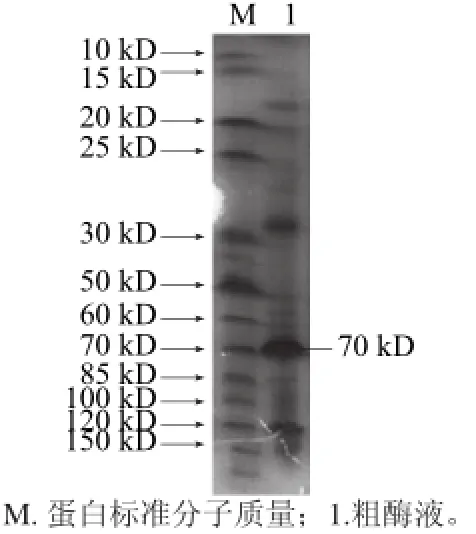
圖4 4 β-CGTase表達的SDS-PAGE分析AGEFig.4 SDS-PAGE analysis of the recombinant β-CGTase from E. coli DH5α (pBVcgt)
2.2 培養條件優化
2.2.1 誘導開始時菌濃(OD600nm)對β-CGTase酶活力的影響
在50mL含Amp的LB培養基(pH7.0)中按1%接種量接入種子液后,37 ℃、250 r/min培養到菌濃OD600nm值達到0.4、0.6、0.8、1.0、1.2、1.4、1.6時,42 ℃誘導6 h后取出培養液處理后測酶活,所得的工程菌菌濃與酶活力的關系如圖5所示。菌濃較低時,酶活力隨菌濃增加而增大,達到1.0時酶活力最高,之后酶活力降低。菌濃在1.0時,此時菌體處于對數生長期,易于誘導而合成外源蛋白,因此表現出較高的活力,之后隨著培養基中營養物質的消耗,菌體比生長速率下降,而導致產酶量下降。
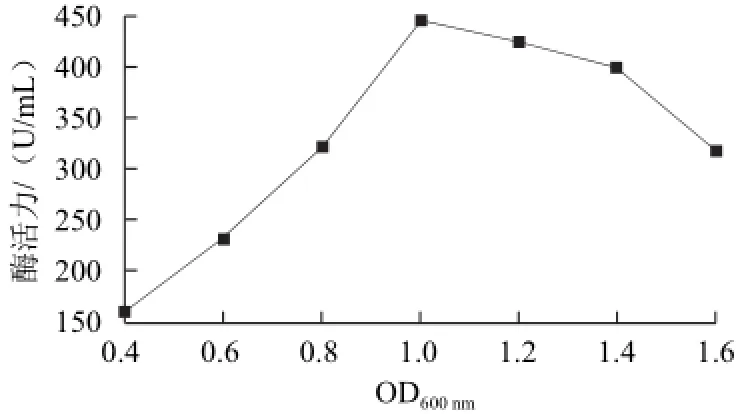
圖5 誘導開始時菌體濃度對β-CGTase酶活力的影響Fig.5 Effect of OD600nm(initial cell density) on the activity of β-CGTase
2.2.2 初始培養溫度對β-CGTase酶活力的影響
在50 mL含Amp的LB培養基(pH 7.0)中按1%接種量接入種子液后,菌體分別在28、30、32、35、37 ℃,250 r/min培養,當菌濃OD600nm值分別達到1.0 時,將溫度均調至42 ℃誘導6 h后取樣處理測定酶活力,結果如圖6所示。初始培養溫度在30 ℃時酶活力最高,之后隨著培養溫度升高酶活力迅速下降。可能是因為此時的培養溫度和誘導溫度之間溫差較大從而有利于重組酶的誘導合成所致;隨著初始培養溫度的升高,溫差逐漸減小,產酶量也隨之下降,較低的培養溫度不利于菌體的生長,所以酶的表達量不高。
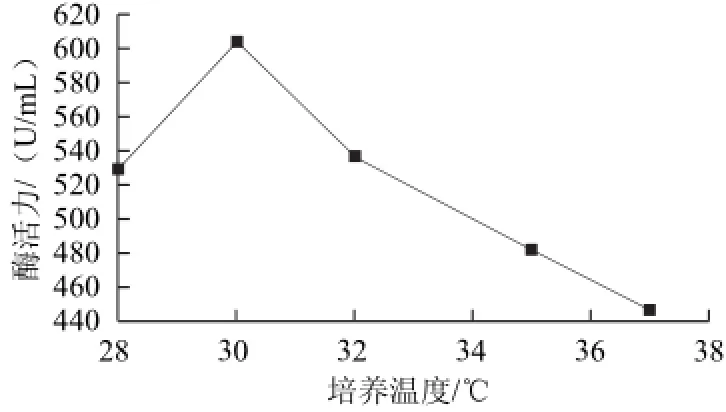
圖6 初始培養溫度對β-CGTase酶活力的影響Fig.6 Effect of initial culture temperature on the activity of β-CGTase
2.2.3 發酵培養基初始pH值對β-CGTase酶活力的影響
在50mL含Amp的LB培養基(pH 5.0、6.0、7.0、8.0、9.0)中按1%接種量接入種子液后,30 ℃、250 r/min培養,當菌濃OD600nm值均達到1.0時,將溫度調節到42 ℃繼續培養6 h后取樣處理測定酶活力,結果如圖7所示。在發酵培養基初始pH值較低時酶活力隨pH值的升高而增大,在pH 8.0時達到最大,之后降低。由此可知,偏堿性環境較適合工程菌產酶,強酸性和強堿性條件對工程菌產酶有抑制作用。
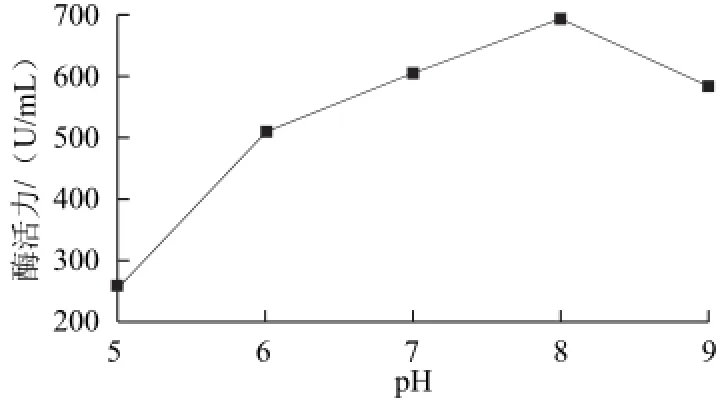
圖7 發酵培養基初始pHH值對β-CGTase酶活力的影響Fig.7 Effect of initial medium pH on the activity of β-CGTase
2.2.4 誘導溫度對β-CGTase酶活力的影響
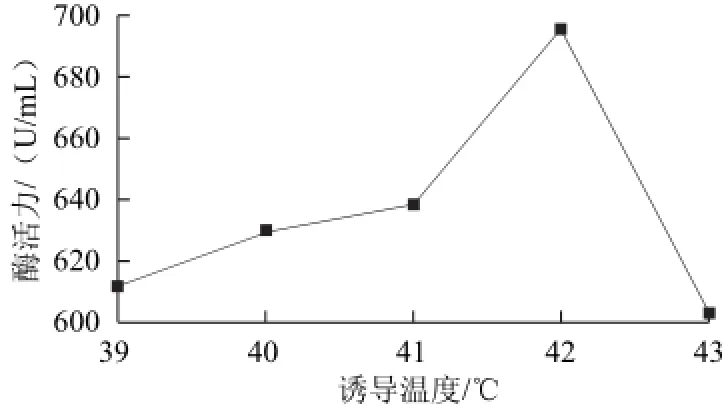
圖8 誘導溫度對β-CGTase酶活力的影響Fig.8 Effect of induction temperature on the activity of β-CGTase
在50 mL含Amp的LB培養基(pH 8.0)中按1%接種量接入種子液后,30 ℃、250 r/min培養到OD600nm值達到1.0 時,分別在39、40、41、42、43℃條件下誘導6h后取樣處理測定酶活力,結果如圖8所示。42℃誘導最適合工程菌產酶,較高溫度則不利于產酶。這與載體pBV220自身的結構有關,該載體含有編碼對PL啟動子有抑制作用而又對溫度敏感的cI蛋白基因cIts857,該基因在30 ℃時具有抑制啟動子的活性,而在42℃時失活從而失去抑制啟動子的活性,此時的啟動子具有極強的起始RNA轉錄的功能,因此,此溫度下誘導表現出較高的酶活力。
2.2.5 誘導時間對β-CGTase酶活力的影響
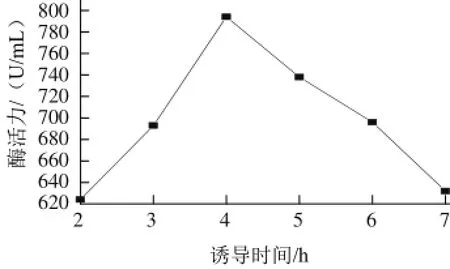
圖9 誘導時間對β-CGTase酶活力的影響Fig.9 Effect of induction time on the activity of β-CGTase
在50 mL含Amp的LB培養基(pH 8.0)中按1%接種量接入種子液后,30 ℃、250 r/min培養到OD600nm值達到1.0 時,42 ℃分別誘導2、3、4、5、6、7h后取樣處理測定酶活力,結果如圖9所示。誘導4 h時產酶量最高,延長誘導時間則不利于產酶。誘導時間與溫控啟動子有關,許多研究表明,該表達載體在42 ℃的最佳誘導時間是4 h。如徐礪瑜等[19]研究利用溫控表達載體pBV220,在42 ℃對外源基因dhaB及yqhD進行熱擊誘導表達4 h后,獲得了較高活力的酶。誘導時間較短,啟動子轉錄功能較低;延長誘導時間對工程菌生長不利,因此都表現出較低的酶活力。
2.2.6 溫度梯度誘導對β-CGTase酶活力的影響

表1 溫度梯度誘導對β-CGTase酶活力的影響Table1 Effect of induction at gradient temperatures on the activity of β-CGGTTaassee
在50 mL含Amp的LB培養基(pH 8.0)中按1%接種量接入種子液后,30 ℃、250 r/min培養到OD600nm值達到1.0 時,溫度梯度設為:39、40、41、42 ℃。誘導4 h后測酶活力。由表1可知,溫度梯度誘導有利于工程菌產酶。最佳誘導溫度的分配為:39 ℃誘導0.5 h,40 ℃誘導0.5 h,41 ℃誘導1 h,42 ℃誘導2 h。此時酶活力高于42 ℃直接誘導4 h的活力,是由于直接誘導時溫度的變化一是使得菌體的生長壓力突然增加不利于菌體生長;二是蛋白基因cIts857突然失活,導致啟動子的抑制作用突然消失,在短時間內合成大量的重組蛋白,由于合成速度太快導致重組蛋白未能正確折疊,形成較多的包涵體,所以表現出較低的酶活力。
3 討 論
本研究通過PCR擴增技術將從土壤中篩選的Bacillus cereus strain LGQ01的β-CGTase基因克隆到溫控型表達載體pBV220中,轉入E.coli DH5α,獲得表達β-CGTase的重組大腸桿菌。SDS-PAGE結果顯示,除了目的蛋白外,還含有一些其他雜蛋白,但目的蛋白表達量最多,分子質量為70kD,與Zhou Yi等[20]報道的一致,與Petrova[12]和Lee[13]等報道的相近。通過對其發酵條件的優化研究表明,該酶能在溫控原核表達體系中獲得高效表達。這對該酶的大規模發酵具有重要意義。
本研究所采用的表達載體pBV220長度為3 666 bp,選擇性標記為Amp抗性,不僅具有串聯的PL和PR啟動子,可以增強其啟動作用;而且含有編碼對PL啟動子有抑制作用而又對溫度敏感的cI蛋白基因cIts857調控基因cI,因此可用溫度對插入其中的外源基因的轉錄進行調控。與T7誘導啟動子相比,溫控誘導不需要額外添加IPTG誘導劑,不僅操作簡單,而且無毒無害,價格低廉,因此在本研究的基因工程產品工業化時,溫控啟動子比誘導啟動子有其明顯的優越性和現實意義。
通過對工程菌產酶條件的優化,酶活力由優化前的445 U/mL提高到956 U/mL,酶活力提高了1.15 倍,得到最佳產酶條件為:OD600nm值達到1.0,工程菌最初培養溫度30 ℃、發酵培養基初始pH 8.0、梯度誘導39 ℃培養0.5 h,40 ℃培養0.5 h,41 ℃培養1 h,42 ℃培養2 h。溫度梯度誘導比直接誘導效率高,酶活力提高了20%,原因是梯度誘導不利于包涵體的形成。本研究構建的溫控型工程菌在高溫誘導下表現出較高的水解酶活力,而目前報道的工程菌表達量都不高[21],并且大都是IPTG誘導產酶,生產成本高且IPTG不易去除;何飛燕等[22]建立以酚酞作指示劑,在瓊脂固態培養基上篩選環糊精糖基轉移酶高產突變株的平板快速篩選法,從土壤分離物中篩選到l株葡萄糖基轉移酶產生菌gxmfl,37 ℃、250 r/min搖床發酵3 d,產酶活力為1 524 U/mL。曹新志等[23]對l株產環糊精糖基轉移酶的嗜堿芽孢桿菌的發酵條件進行優化后,發酵液的酶活可達5 400 U/mL左右。本實驗構建的溫控型工程菌產酶活力雖然低于這些野生菌產酶活力,但由于該工程菌具有產酶周期明顯較短的優勢,因此該酶是有望在β-環糊精的酶法制備工業化生產中得到應用的。但還需進一步對異源高效表達的條件進行研究,提高重組酶活力,使該工程菌能夠產業化,真正為國民經濟服務。
[1] 張洪斌, 凌國慶, 胡雪芹, 等. N+注入誘變選育β-環狀糊精葡萄糖基轉移酶高產菌株及其發酵條件優化[J]. 食品科學, 2012, 33(15): 239-245.
[2] LI Zhaofeng, WANG Miao, WANG Feng, et al. γ-Cyclodextrin: a review on enzymatic production and applications[J]. Applied Microbiology Biotechnology, 2007, 77(2): 245-255.
[3] ATANASOVA N, PETROVA P, IVANOVA V, et al. Isolation of novel alkaliphilic Bacillus strains for cyclodextrin glucanotransferase production[J]. Applied Biochemistry and Biotechnology, 2008, 149(2): 155-167.
[4] CHAROENSAKDI R, MURAKAMI S, AOKI K, et al. Cloning and expression of cyclodextrin glycosyltransferase gene from Paenibacillus sp.T16 isolated from hot spring soil in Northern Thailand[J]. Journal of Biochemistry and Molecular Biology, 2007, 40(3): 333-340.
[5] AVCI A, DONMEZ S. A novel thermophilic anaerobic bacteria producing cyclodextrin glycosyltransferase[J]. Process Biochemistry, 2009, 44(1): 36-42.
[6] ONG R M, GOH K M, MAHADI N M, et al. Cloning, extracellular expression and characterization of a predominant β-CGTase from Bacillus sp.G1 in E.coli[J]. Journal of Industrial Microbiology and Biotechnology, 2008, 35(12): 1705-1714.
[7] 孫濤, 江波, 潘蓓蕾. 環糊精葡萄糖基轉移酶的生產及其在食品工業中的應用[J]. 食品工業科技, 2012, 33(16): 387-391.
[8] 王佳, 馮建國, 馬超, 等. 環糊精包合技術及其在農藥制劑加工中的應用[J]. 農藥學學報, 2013, 15(1): 23-31.
[9] SINGH M, SHARMA R, BANERJEE U C. Biotechnological applications of cyclodextrins[J]. Biotechnology Advances, 2002, 20(5): 341-359.
[10] MARTIN del VALLE E M. Cyclodextrins and their uses: a review[J]. Process Biochemistry, 2004, 39(9): 1033-1046.
[11] HIRANO K, ISHIHARA T, OGASAWARA S, et al. Molecular cloning and characterization of a novel γ-CGTase from alkalophilic Bacillus sp.[J]. Applied Microbiology and Biotechnology, 2006, 70(2): 193-201.
[12] PETROVA P, TONKOVA A, PETROV K. Sequence analysis, cloning and extracellular expression of cyclodextrin glucanotransferase gene from the alkaliphilic Bacillus pseudalcaliphilus 8SB in Escherichia coli[J]. Process Biochemistry, 2012, 47(12): 2139-2145.
[13] LEE Yongsuk, ZHOU Yi, PARK Dongju, et al. β-Cyclodextrin production by the cyclodextrin glucanotransferase from Paenibacillus illinoisensis ZY-08: cloning, purification and properties[J]. World Journal of Microbiology and Biotechnology, 2013, 29(5): 865-873.
[14] TAKANO T, FUKUDA M, MONMA M, et al. Molecular cloning, DNA nucleotide sequencing and expression in Bacillussubtilis cells of the Bacillus macerans cyclodextrin glucanotransferase gene[J]. Journal of Bacteriology, 1986, 166(3): 1118-1122.
[15] 張洪斌, 朱春寶, 胡又佳, 等. 右旋糖酐蔗糖酶工程菌株的構建及其培養條件的研究[J]. 微生物學報, 2008, 48(4): 492-497.
[16] DUEDAHL-OLESEN L, PEDERSEN L H, LARSEN K L. Suitability and limitations of methods for characterisation of activity of maltooligosaccharide-forming amylases[J]. Carbohydrate Research, 2000, 329(1): 109-119.
[17] 周峻沛, 潘璐, 李俊俊, 等. 黑頸鶴糞便分離菌Arthrobacter sp.GN14的α-半乳糖苷酶基因克隆表達與酶學特性[J]. 微生物學報, 2012, 52(5): 611-619.
[18] 方善康. 微生物試驗技術[M]. 濟南: 山東大學出版社, 1986: 35-46.
[19] 徐礪瑜, 唐雪明, 沈微, 等. 產1,3-丙二醇溫控重組大腸桿菌JMl09(pBV220-yqhD-dhaB)的構建[J]. 應用與環境生物學報, 2008, 14(1): 108-112.
[20] ZHOU Yi, LEE Y S, PARK I H, et al. Cyclodextrin glycosyltransferase encoded by a gene of Paenibacillus azotofixans YUPP-5 exhibited a new function to hydrolyze polysaccharides with β-1,4 linkage[J]. Enzyme and Microbial Technology, 2012, 50(2): 151-157.
[21] XU Bo, HUANG Zunxi, CHEN Baoying, et al. Review on study advances on cyclodextrin glucanotransferase function[J]. Journal Food Science, 2007, 28: 600-604.
[22] 何飛燕, 廖威, 莫于旺, 林華. β-環狀糊精葡萄糖基轉移酶菌株的雙重誘變育種[J]. 中國釀造, 2010, 29(4): 154-157.
[23] 曹新志, 金征宇. 嗜堿芽孢桿菌產環糊精糖基轉移酶發酵條件的優化[J]. 食品科學, 2005, 26(2): 122-126.
Construction of Temperature-Regulated Recombinant Escherichia coli for β-CGTase Expression and Optimization of Culture Conditions
FAN Ning, ZHANG Hong-bin*, LING Kai, LING Guo-qing, HU Xue-qin
(School of Medical Engineering, Hefei University of Technology, Hefei 230009, China)
The β-CGTase gene from Bacillus cereus was cloned in pBV220 plasmid after PCR amplification. The recombinant plasmid was transformed into E. coli DH5α. After ampicillin-resistance screening and restriction enzyme digestion analysis, we acquired recombinant E. coli DH5α/pBVcgt. The optimum fermentation conditions in shaking flask were acquired as follows: OD600nm= 1.0, initial culture temperature 30 ℃, initial medium pH 8.0, and gradient-temperature induction at 39 ℃ for 0.5 h followed by 40 ℃ for 0.5 h, 41 ℃ for 1 h and 42 ℃ for 2 h. The activity of β-CGTase under these fermentation conditions was increased from 445 to 956 U/mL, representing a 2.15-fold increase compared to that obtained before optimization. Cloning and expression of the β-CGTase gene showed that this enzyme could be expressed highly in E. coli expression system. Therefore, this study proves the possibility of protein engineering of β-CGTase for largescale production of β-CD.
Bacillus cereus; β-cyclodextrin glucanotransferase; engineered bacteria; expression; culture conditions
Q814
A
1002-6630(2014)11-0155-05
10.7506/spkx1002-6630-201411031
2014-02-13
安徽省自主創新專項(2013AKKG0391)
凡寧(1987—),女,碩士研究生,研究方向為生物化工。E-mail:fanning56789@163.com
*通信作者:張洪斌(1970—),男,教授,博士,研究方向為生物化工與酶工程。E-mail:hbzhang@hfut.edu.cn

