大鼠海馬神經元癲癇樣放電模型的構建
董長征 趙文清 李文玲 岳向勇 孔艷莉 康進生 梁傳棟 王蘊欣
大鼠海馬神經元癲癇樣放電模型的構建
董長征 趙文清 李文玲 岳向勇 孔艷莉 康進生 梁傳棟 王蘊欣
目的探討“無鎂細胞外液”誘導體外培養大鼠海馬神經元產生癲癇樣放電的可行性,以期建立難治性癲癇離體細胞模型。方法選取24 h內新生Wistar大鼠,分離海馬神經元后進行原代培養,體外培養至第12天時,用“無鎂細胞外液”處理3 h,應用全細胞膜片鉗技術記錄海馬神經元的放電情況。結果在培養第12天時,神經元突起間彼此接觸形成神經網絡。在“無鎂細胞外液”處理3 h后神經元產生穩定的放電,恢復正常細胞培養液培養24 h,神經元仍可檢測到自發的“癲癇樣放電”。結論體外培養第12天海馬神經元,在“無鎂細胞外液”處理后可形成穩定的自發性癲癇樣放電,為今后在細胞分子水平研究癲癇發病機制提供了一種理想模型。
海馬;神經元;膜片鉗;癲癇樣放電;動作電位;原代培養
藥物難治性癲癇是神經科常見病之一,其發病機制目前尚不十分清楚,既往研究多來源于完整腦組織切片,遺傳模型以及培養神經元模型,每一種癲癇模型都有其自身的優勢和不足;除非使用藥物或電刺激,否則很難形成一個反復自發性癲癇模型[1]。體外培養的單純神經元環路被認為適合用于進行復雜生物物理以及藥理遺傳學的研究來理解病理狀態下癲癇的傳播和維持。然而,盡管已經有能力在培養的微小神經元上誘發出藥理學意義上的癲癇樣活動[2],但在培養神經元中產生持久的自發性反復性癲癇發作尚困難重重。本研究擬將體外培養第12天的大鼠海馬神經元,用“無鎂細胞外液”處理3 h,用全細胞膜片鉗技術檢測神經元動作電位的變化,建立海馬神經元癲癇樣放電模型,為進一步研究癲癇發病機制以及神經肽Y藥物干預提供理想的細胞模型。
1 材料與方法
1.1 實驗動物 新生24 h內Wistar大鼠20只,由英國利茲大學生物系實驗動物中心提供。飼養環境溫度20~23℃,濕度45% ~50%,清潔級。
1.2 主要試劑 Neurobasal TM、胎牛血清(FBS)、胰蛋白酶、L-多聚賴氨酸、B27、D-Hanks液、胰蛋白酶為GIBCO公司制品;氯化鎂(MgCl2·6H2O)分析純為英國Fisher Scientific公司;正常細胞外液組成成分(mmol/L):NaCl 147,HEPES 10,Glucose 13,KCl2,CaCl2,MgC12;用 5 mmol/L NaOH 調節 pH 值至7.3,調整滲透壓為280~320 mmol/L。無鎂細胞外液組成成分(mmol/L):NaCl 147,HEPES 10,Glucose 13,KCl 2,CaCl22;用5 mmol/L Na0H調節pH值至7.3,調整滲透壓為280~320 mmol/L。
1.3 主要儀器設備 膜片鉗放大器(Axon 200B),模/數轉換器(Digidata 1320A 16-bit Aequisition System),灌流控制系統(BPS-8),CO2培養箱(Heraeus240),倒置相差顯微鏡(Olympus1 CK2),微電極拉制儀(Model P-97),微電極拋光儀(2002-C),一次性細胞塑料培養皿、培養瓶(Costra),AG135電子天平(Mettler Toled)。
1.4 方法
1.4.1 原代海馬神經元的分離、種植與培養:新生24 h Wistar大鼠,75%酒精消毒,斷頭取腦,移至盛有冷的事先配好的1×解剖液的培養皿中。在解剖顯微鏡輔助下,去除腦組織表面的血管和軟腦膜,分離雙側大鼠海馬組織。將分離好的月牙形狀的海馬組織放進盛有解剖液的1.5 ml eppendorf管中,移至細胞超凈臺。把500 μl 0.25%的胰蛋白酶-EDTA加到盛有500 μl的1×解剖液的eppendorf管中配置成2×解剖液備用;吸出盛有海馬標本的eppendorf管中的1×解剖液,加入配好的1 ml 2×解剖液,37℃ CO2培養箱中消化15 min。吸出消化液,加入1 ml NM5培養基,中和胰酶,輕輕搖晃均勻;再次吸出NM5培養基,再次搖勻,再次吸掉NM5培養基,加入1 ml NM5培養基,用手動單道可調式移液器輕輕吹打組織塊15次(不超過20次),制作成單細胞懸液。靜置3~5 min。向預先用0.1 mg/ml多聚賴氨酸過夜處理過的35 mm細胞培養皿中加入1.5 ml NM5培養基,每個培養皿中預先放入4個載玻片。吸出含有海馬神經元的上清液,勿吸入管底的細胞殘渣,用計數板進行細胞計數,用細胞培養液將細胞數調整為(2~5)×105cells/ml,然后將細胞分別接種于細胞培養皿中。將細胞放入5%CO2,37℃,95%濕度的CO2培養箱中進行培養,2~3 h后用NM5培養基全量換液;3 d后,用NM5培養基半量換液;自第6天起,用加入10 μmol/L阿糖胞苷(Ara-C)NM1培養基半量換液。每天在倒置相差顯微鏡下觀察神經元生長狀況,包括細胞突起、形態、輪廓及細胞密度等。培養第12天的細胞用于后續膜片鉗試驗。
1.4.2 膜片鉗記錄海馬神經元動作電位變化:將體外培養至第12天的海馬神經元分為2組:正常細胞外液組,無鎂細胞外液處理組。后者,在神經元換液后,改無鎂細胞外液培養3 h,恢復原維持液培養,然后,應用膜片鉗系統進行全細胞模式的電流鉗記錄。分別檢測2組神經元動作電位情況。設定參數:記錄模式為CClamp,C-fast 7.86 pF,C-Slow 50.00 pF,Amplitude 5.0 mV,length 5.0 ms,Gain 2 mV/PA。
2 結果
2.1 海馬神經元的形態學檢測 分離的海馬神經元培養12 h后大部分貼壁,24 h后細胞形態多樣,突起明顯增多。48 h后細胞突起不斷延長。培養第6天后,可見錐體形狀的神經元,有立體感,細胞核呈空泡狀,核仁清晰。培養第12天后,細胞周圍有光暈,胞體略突出飽滿、折光性良好,細胞突起長,細胞之間形成廣泛的突觸聯系,典型的神經網狀結構形成。16~18 d后神經元突起斷裂,部分細胞開始裂解。選取小形態一致的多角形,胞體飽滿,周圍帶光暈發育良好神經元用于后續膜片鉗試驗。見圖1。
2.2 海馬神經元癲癇樣放電的記錄 體外培養正常海馬神經元可見自發性興奮性突觸后電位,偶有動作電位發放;無鎂細胞外液處理神經元3 h后,可檢測到頻發的動作電位發放,頻率15~25個/s,波幅70~98 mV。改用正常培養基培養24 h,仍可檢測到較多的高波幅的異常放電,說明無鎂細胞外液處理神經元3 h,可以形成穩定的反復自發性癲癇樣放電模型,可以很好模擬人體內神經元癲癇樣放電狀態。見圖2~4。
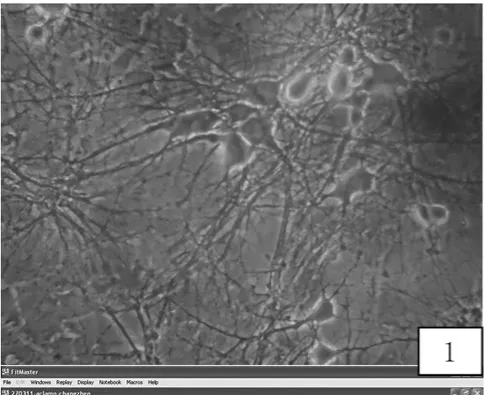
圖1 原代培養第12天海馬神經元形態
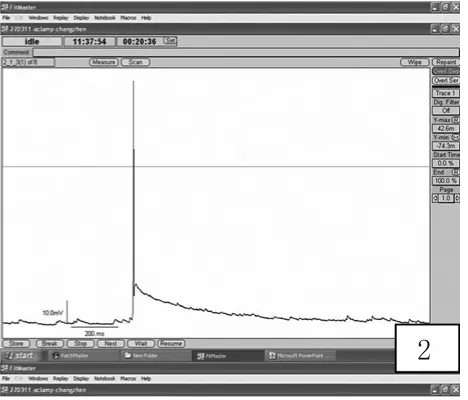
圖2 正常海馬神經元偶有動作電位發放
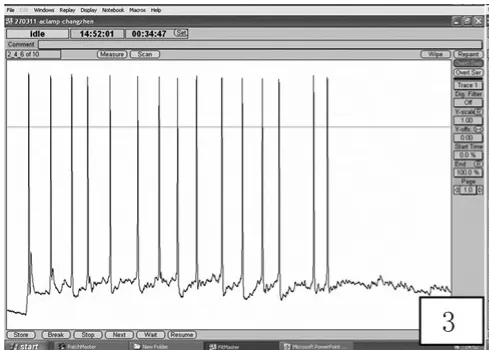
圖3 無鎂細胞外液處理神經元3 h頻繁動作電位發放
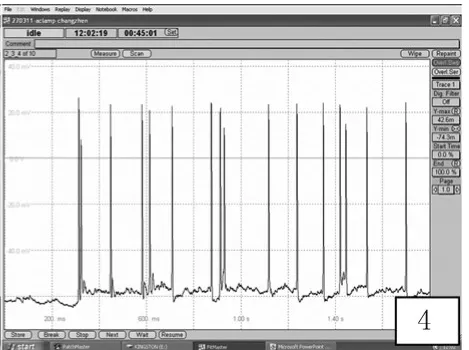
圖4 無鎂細胞外液處理神經元24 h較多的動作電位發放
3 討論
近年來,對大多數的有關癲癇的機制研究多采用臨床手術標本以及各種化學藥物或物理方法誘導的各種急慢性癲癇模型[3],為了從細胞水平研究癲癇的發病機制,構建一個能模擬人體內神經元放電的模型非常必要。
Mg2+在維持中樞神經系統正常電生理活動和神經元的突觸聯系中起著重要作用[4]。鎂離子在某些癲癇動物模型中顯示具有抑制癲癇發作和神經保護作用,表現在下列幾方面:抑制Caspase-3的表達,減少神經元凋亡;非競爭性阻斷NMDA受體,減少神經毒性作用;能競爭磷脂離子連接位點起到抗氧自由基作用,抑制了脂質過氧化。因此,移除細胞生存環境的鎂離子,可以誘發神經元的高興奮性狀態,模擬神經元異常放電[5]。Sombati等[6]研究提示無鎂誘發的神經元出現自發性反復性發放的動作電位與臨床癲癇發作時的電生理活動極為類似,抗癲癇藥物如苯妥英鈉能抑制這類動作電位的發生。本部分研究根據上述鎂離子的生理特性,移除細胞外液鎂離子來模擬“癲癇微環境”,誘導原代培養海馬神經元癲癇樣放電。結果顯示經無鎂細胞外液處理3 h后,100%神經元出現頻發的高波幅動作電位發放。與處理前相比,動作電位的幅度和頻率明顯增高和增多;換用正常細胞外液培養后24 h,監測90%以上的神經元仍然存在反復自發性癲癇樣放電,有利的證實了此癲癇神經元放電模型的穩定可靠性。試驗中我們發現培養的海馬神經元經無鎂細胞外液處理后易激惹,細胞活性較正常弱,但仍可進行膜片鉗記錄電活動,無鎂細胞外液處理5 h后的神經元活性較前減弱,較難用于膜片鉗封接,鑒于此,我們認為無鎂細胞外液處理3 h時的神經元最適合用來研究癲癇的細胞分子水平的電生理研究。
我們利用原代培養第12天的海馬神經元進行電生理研究,因為此時,培養的海馬神經元貼壁后形成許多突起,并且彼此之間形成了復雜的神經網絡,表明我們培養的海馬神經元在體外仍能形成廣泛的突觸聯系,具備突觸間生物信息傳遞的形態學基礎,能很好模擬在體神經元的生理狀態。這與既往文獻報道相吻合[7]。我們先前研究已經通過動物實驗觀察了神經肽Y對癲癇大鼠發作的影響[8];海馬神經元癲癇樣放電模型的成功建立,為我們下一步在細胞分子學水平上研究神經肽Y對癲癇神經元興奮性的影響打下堅實基礎。
1 Wong M.Epilepsy in a Dish:An In Vitro Model of Epileptogenesis.Epilepsy Curr,2011,11:153-154.
2 Keller CJ,Truccolo W,Gale JT,et al.Heterogeneous neuronal firing patterns during interictal epileptiform discharges in the human cortex.Brain,2010,133:1668-1681.
3 Raol YH,Brooks-Kayal AR.Experimental models of seizures and epilepsies.Prog Mol Biol Transl Sci,2012,105:57-82.
4 Igelstrm KM,Shirley CH,Heyward PM.Low-magnesium medium induces epileptiform activity in mouse olfactory bulb slices.J Neurophysiol,2011,106:2593-2605.
5 Tancredi V,Hwa GG,Zona C,et al.Low magnesium epileptogenesis in the rat hippocampal slice:electrophysiological and pharmacological features.Brain Res,1990,511:280-290.
6 Sombati S,DeLorenzo RJ.Recurrent spontaneous seizure activity in hippocampal neuronal networks in culture.J Neurophysiol,1995,73:1706-1711.
7 Molnár E.Long-term potentiation in cultured hippocampal neurons.Semin Cell Dev Biol,2011,22:506-513.
8 董長征,趙文清,李文玲,等.重組腺相關病毒介導人源性神經肽Y基因轉染對紅藻氨酸致癇大鼠行為及腦電圖的影響.第三軍醫大學學報,2010,32:2140-2142.
Establishment of the epileptiform discharge model in rat hippocampal neuron
DONG Changzheng,ZHAO Wenqing,LI Wenling,et al.Department of Functional Neurosurgery,,Hebei Procincial People's Hospital,Shijiazhuang 050051,China
ObjectiveTo explore the feasibility of epileptiform discharge of rat hippocampal neurons cultured in vitro and induced by magnesium-free extracellular fluid in order to establish refractory epilepsy model in cultured cells.MethodsThe neonatal Wistar rats within 24h were used to isolate hippocampal neuron to carry out primary culture in vitro.After 12d,the hippocampal neurons were treated with magnesium free extracellular fluid for 3h,then neuronal discharge activities were recorded by whole cell patch clamping technique.ResultsAfter 12 - day cell culture,neuronal dendrites touched each other to form neural network.After 3 - hour treatment by magnesium-free extracellular fluid,the neurons produced stable discharge,however,after 24 - hour treatment with normal cell culture fluid,the spontaneous epileptiform activity in neurons could still be observed.ConclusionThe stable spontaneous epileptiform activity can be formed in hippocanlpal neurons cultured in vitro for 12d,after exposed in magnesium free extracellular fluid for 3h,which provides an ideal model for pathogenetic research about epilepsy at cell and molecular level.
hippocampus;neurons;whole-cell patch-clamp technique;epileptiform discharges;action potential;primary culture
R 338
A
1002-7386(2014)14-2093-03
10.3969/j.issn.1002 -7386.2014.14.004
050051 石家莊市,河北省人民醫院功能神經外科(董長征、趙文清、李文玲、岳向勇、孔艷莉、康進生、梁傳棟),麻醉科(王蘊欣)
李文玲,050051 河北省人民醫院功能神經外科;E-mail:liwelling@163.com
2014-01-11)

