雞卵黃免疫球蛋白的糖基化及其構效關系研究進展
佟晨瑤,賀真蛟,耿 放,馬美湖,黃 茜,蔡朝霞*
(國家蛋品加工技術研發分中心,華中農業大學食品科學技術學院,湖北 武漢 430070)
雞卵黃免疫球蛋白的糖基化及其構效關系研究進展
佟晨瑤,賀真蛟,耿 放,馬美湖,黃 茜,蔡朝霞*
(國家蛋品加工技術研發分中心,華中農業大學食品科學技術學院,湖北 武漢 430070)
雞卵黃免疫球蛋白(egg yolk immunoglobulin,IgY)是雞卵黃中的一種免疫球蛋白。由于其具有原料易得、制備簡 單、不與類風濕因子以及哺乳動物的補體發生交叉反應等優點,IgY是一種頗具潛力的抗生素替代品,但由于IgY性質不穩定,易受溫度、pH值、酶的影響,從而限制了其實際應用。糖鏈在維持IgY理化性質、抗原特性等功能中扮演著重要角色。因此,對IgY進行糖基化修飾,從而改善其理化性質和抗原特性,不僅能使雞蛋資源得到充分利用,也為開發蛋黃保健食品、添加劑以及相應的醫藥產品提供科學依據。本文歸納幾種常見的IgY的糖基化方法,并論述IgY糖基化與其結構、理化性質之間的關系。
糖基化;雞卵黃免疫球蛋白;功能活性;構效關系
蛋白質糖基化是真核生物最重要的修飾之一,具體是指合成后的或正在合成的蛋白質在糖基轉移酶的作用下將活化的糖加到肽鏈上的過程[1]。蛋白質的糖基化不僅在維持空間構象、穩定糖蛋白結構、保護其免受某些蛋白酶裂解、增強蛋白質分子的溶解性以及增加蛋白質的生物半衰期等方面有重要作用,而且還能改變某些蛋白質的生物活性和抗原特性。因此對蛋白質進行糖基化修飾,具有十分重要的意義。
雞卵黃免疫球蛋白(egg yolk immunoglobulin, IgY)是一種在雞蛋黃里發現的免疫球蛋白,其結構類似于哺乳動物的免疫球蛋白IgG,但相較于IgG,IgY具有無需采血,不與類風濕因子、哺乳動物的補體發生交叉反應等優點,另外,特異性IgY在中和蛇毒,抗輪狀病毒等方面也有廣泛的應用[2-5]。一般情況下,當其他哺乳動物在對抗高度保守表位蛋白質無法產生免疫應答時,由于鳥類和哺乳動物物種間的隔離,IgY有可能可以產生應答[6]。對IgY進行糖基化修飾,可以改善其對熱、酸度、酶解的穩定性和免疫活性,從而拓展其應用領域,并為IgY代替哺乳動物的IgG提供一定的理論基礎。因此,IgY的糖基化修飾具有重要的研究意義和應用價值。
1 蛋白質的糖基化方法
蛋白質糖基化修飾的常用方法有3種,分別是隨機的會聚式糖基化反應、化學選擇性及位置專一性的糖基化反應、定點突變型的糖基化反應[7-8]。
1.1 隨機的會聚式糖基化反應
隨機的會聚式糖基化反應是通過化學反應,對蛋白質糖鏈上的某類官能團進行糖基化修飾,產生一組糖基化位點不確定的混合物。主要包括2-亞氨基甲氧基甲基硫苷法[9]、還原型胺化法[10]和美拉德反應[11]。前兩種方法都是通過將糖基連接到賴氨酸殘基上來實現的。2-亞氨基甲氧基甲基硫苷法,即把2-亞氨基甲氧基甲基硫苷連接到蛋白表面賴氨酸上[9]。還原型胺化法是在還原劑作用下,糖還原端醛基和蛋白中的氨基縮合形成希夫堿,生成穩定的擬糖蛋白的過程[10]。美拉德反應是隨機會聚式糖基化反應中的主要類型,在此反應中,蛋白質中的氨基與糖分子中的羧基發生共價結合,不需要添加任何化學試劑作為催化劑,僅加熱就可使反應自發進行。由于美拉德反應機理十分復雜,其反應歷程、產物的性質及組成受到多種因素的影響,糖基化位點不易確定,但正因如此,該方法糖基化類型豐富,對蛋白質的凝膠性、乳化性、過敏原性等多方面功能性質均可產生影響,故應用廣泛[11]。影響美拉德反應的因素非常多,除了反應物種類、反應pH值和溫度以外,研究發現在真空中進行糖基化比常壓下進行糖基化效果要好,這主要是由于在真空中避免了不完整糖化作用、美拉德反應末端終產物的生成、由于溶劑誘導使蛋白質變性以及酶失活等問題[12]。
1.2 化學選擇性及位置專一性的糖基化反應
化學選擇性及位置專一性的糖基化反應是通過化學或酶法進行糖基化修飾[7]。其中化學法是通過化學方法標記肽鏈中需要反應的位置或針對肽鏈的某個特異性基團進行糖基化[13]。該方法條件比較溫和,可以在不影響其他官能團的情況下確定反應位置[14],并且能夠在蛋白骨架中導入非天然的氨基酸,在擬糖肽/擬糖蛋白藥物改造研究領域有不可比擬的優勢,但是由于其是通過化學方法合成,所以肽鏈的長度受到限制[8]。酶法是糖基化工程研究中另一種重要的方法,具有高效、專一、條件溫和等優點,催化反應速度快,與化學法相比,所需酶量極其微小。但酶的價格昂貴,且很多酶法糖基化需要特定的識別序列,所以對很多蛋白質不太可能適用[15]。
1.3 定點突變型的糖基化反應
定點突變型的糖基化反應是指通過定點突變技術改變蛋白質的氨基酸序列,引入糖基化位點,從而改變蛋白質的糖鏈[8]。Davis等[16]將分離純化后的糖鏈化合物通過一鍋法合成用于生物體硒代謝中硫硒鍵連接的擬糖蛋白。通過突變技術控制反應位點,合成的糖蛋白和糖肽的長度不受限制,可以直接作用于天然蛋白質[17]。但由于很多蛋白質氨基酸結構和糖基化位點尚未清楚,蛋白質的構效關系也未得到闡明,所以定點突變型糖基化存在一定的盲目性。
2 雞卵黃免疫球蛋白的糖基化及其構效關系
2.1 雞卵黃免疫球蛋白和哺乳動物IgG結構比較
哺乳動物體內有5種免疫球蛋白,分別為IgG、IgA、IgM、IgD和IgE,其中IgG是含量最高,也是研究最多的一種免疫球蛋白。IgY是唯一存在于雞卵黃中的免疫球蛋白,其結構與IgG類似。
圖1A為IgG結構,圖1B為IgY結構[18]。IgG和IgY都是由4條鏈組成的,分別是兩條重鏈(H)和兩條輕鏈(L)。IgG分子質量約為150 kD,其中重鏈約為55~77 kD,輕鏈約為25 kD。IgY分子質量約為180 kD,其中重鏈約為67~70 kD,輕鏈約為22~30 kD[19]。IgG的重鏈由一個可變區(V)和3個恒定區(C)組成,而IgY的重鏈由一個可變區和4個恒定區組成。另外,IgY和IgG可分為兩個抗原結合片段(Fab)和一個可結晶片段(Fc)。
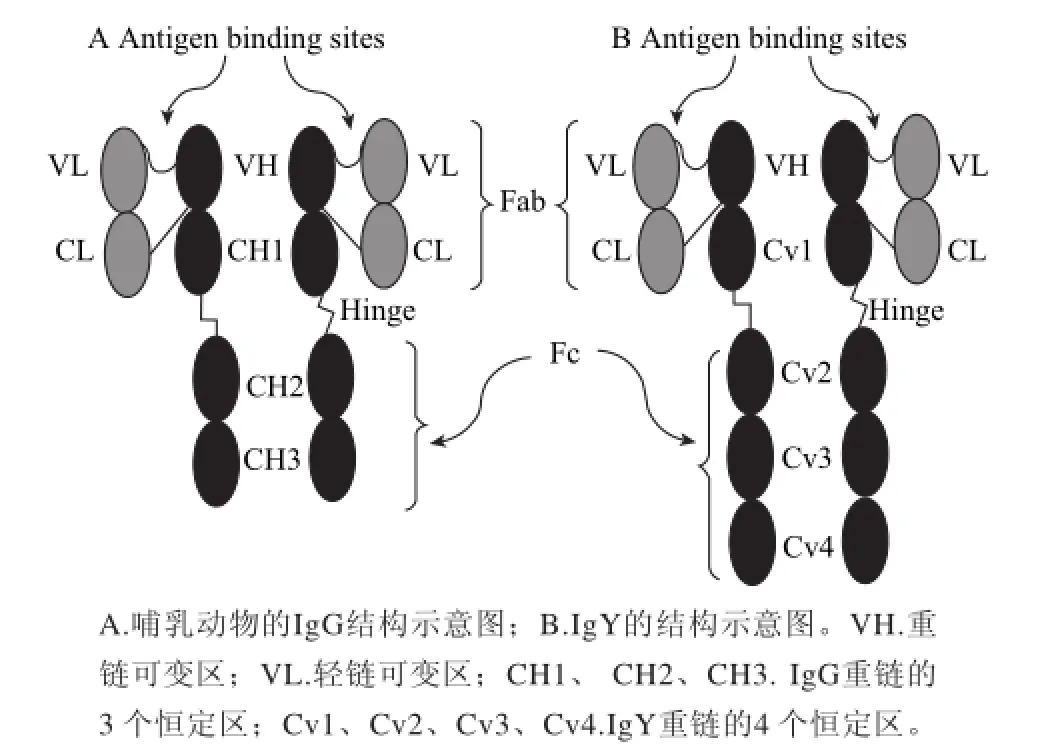
圖1 免疫球蛋白結構分析Fig.1 Structural analysis of immunoglobulins
2.2 雞卵黃免疫球蛋白的糖鏈結構分析
免疫球蛋白作為一種糖蛋白,其絕大部分的糖鏈存在于重鏈的穩定區[20]。糖鏈一般由甘露糖、半乳糖、N-乙酰氨基葡萄糖、N-乙酰氨基半乳糖、唾液酸等構成,此外還存在少量的巖藻糖。免疫球蛋白中的糖鏈數目、種類以及連接的位置都隨免疫球蛋白的種類而異。糖鏈一般連接在Ig的 Fab、Fc及絞鏈區。在IgG、IgA、IgD中,連結Fab與Fc的絞鏈區由二硫鍵形成;而IgE、IgM的絞鏈區含有N-聚糖和O-聚糖,這使得IgE和IgM的結構缺乏柔韌性[21]。IgG只含2~3條N-乙酰氨基葡萄糖的聚糖,其含糖量最少;IgA和IgE含4~5條N-乙酰氨基半乳糖的聚糖;IgM每一條重鏈上含5個糖基化位點,主要存在于Fab區[20]。雖然IgG、IgM、IgE、IgA結構相似,但是它們的糖基化位點各不相同。IgG其Fc區的Asn297含有唯一的N-糖基化修飾保守位點,其糖鏈由于核心七糖上連接的末端糖基不同而具有特異性[22]。位點突變實驗還推斷出在IgG重鏈的CH2/CH3表位,尤其是殘基362~365和550~553位點在IgG與受體交聯的反應中起著不可忽視的作用[23]。IgM在CH3的Asn394有N-糖基化修飾位點,此位點是IgM唯一的高甘露糖型[19]。
Suzuki等[24]通過高效液相色譜-質譜分析顯示IgY有單甘露糖化血紅蛋白、甘露糖寡糖、雙天線寡糖結構,前兩種結構是IgY不同于其他蛋白的主要糖型結構。其中甘露糖型占37.2%,而Glc1Man8-9GlcNAc2占整個甘露糖型的71.2%,且IgY在Cv2和Cv3區的Asn308和Asn407有兩個潛在的N-糖基化修飾位點。
2.3 雞卵黃免疫球蛋白的糖基化與結構、功能的關系
免疫球蛋白的糖基化在維持空間構象、穩定糖蛋白結構方面起著重要作用。首先是具有一定氨基酸排列順序的多肽鏈需要進一步折疊,形成一定空間結構的蛋白質分子,才能發揮生物學功能。另外,在蛋白質折疊的過程中,糖蛋白的糖基化位點起到關鍵作用。同時,Bechor等[25]在不影響蛋白質結構的條件下選擇6個糖基化位點進行糖基化,發現糖鏈的引入能夠增加蛋白的結構穩定性,并且這種穩定性與糖基的數量成正比,受糖鏈大小影響較小。
另外,有學者比較了不同來源的免疫球蛋白(人、山羊、兔、鼠、水牛、雞卵黃)對果糖基化的敏感程度[26]。結果表明雖然不同來源的免疫球蛋白的結構都十分相似,但它們對果糖基化的敏感性程度卻各不相同。其中卵黃來源的IgY對果糖基化最為敏感,而山羊IgG最不敏感,說明糖基化程度可能是與免疫球蛋白暴露的氨基酸基團有關。同時果糖基化后免疫球蛋白的活性發生了變化,推測原因是糖基化的位點會影響免疫球蛋白與抗原的結合能力。
蛋白質表面的糖鏈還可覆蓋蛋白質分子中的某些蛋白酶降解位點,從而增加了蛋白質對于蛋白酶的抗性[27]。在膜型Ig(mIg)中,mIg在參與體液免疫的B細胞膜上有著嚴格的立體構象,糖基化的程度不當會導致這種構象的改變,就會直接降低其識別和結合抗原的能力[28]。當糖基化程度較低時,會使mIg肽鏈缺乏剛性。而糖基化過度,就會遮住mIg的抗原結合位點,影響其與抗原的結合[29]。
2.4 雞卵黃免疫球蛋白的糖基化與理化性質的關系
目前已有大量研究表明糖基化可提高蛋白質的結構穩定性,防止蛋白質的相互聚集,主要是改善蛋白質的熱穩定性、對酶以及pH值的敏感性[30]。Pham等[31]于真空條件下將葡萄糖和酶進行孵育,將葡萄糖共價連接到了蛋白質的賴氨酸殘基上,發現糖基化的胰蛋白酶仍然具有活性,糖基化的糜蛋白酶也保持在45%的活性,而未糖基化的胰蛋白酶和糜蛋白酶都已完全失活,表明了糖基化可使蛋白質的熱穩定性顯著增強。Anbarasan等[32]發現經糖基化修飾的辣根過氧化物酶(horseradish peroxidase,HRP)具有8個N-連接的葡聚糖殘基,但是其熱穩定性、活性不變。另有文獻表明蛋白質的穩定性不僅和糖基化的狀態及種類有關,還和pH值有密切關系。Wang Wei等[33]發現在pH 4.0處糖基化,白介素2(interleukin 2,IL-2)突變蛋白其熱穩定性會下降,而在pH 5.5處糖基化其熱穩定性上升。這些研究成果證明糖基化對蛋白質的穩定性有重要的影響。
隨著有關免疫球蛋白研究報道的增多,IgY以其獨特的免疫功能引起了越來越多的國內外研究學者的廣泛重視。但是,作為一種非常有前景的抗生素替代物,IgY性質不穩定,易受溫度、酸堿、酶的影響,從而限制了IgY的實際應用領域。IgY與哺乳動物體內的IgG相比,其酸堿穩定性遠不如IgG,原因是IgY分子結構中的二硫鍵較少[34],且缺乏靈活的鉸鏈區域,這個不靈活的結構也在哺乳動物的IgE里被發現。因此,IgY表現出哺乳動物體內IgE和IgG共有的結構特征,IgY的Fc區域的結構分析也支持這一說法[35]。
3 結 語
我國雞蛋資源豐富,因此充分利用雞卵黃資源提取出免疫活性成分并使其穩定性得到保護具有重大的經濟及現實意義,不僅使雞蛋資源得到了充分利用,拓寬雞蛋的利用渠道,提高雞蛋的附加值,開拓市場,給雞殖業帶來巨大的經濟和社會效益,同時也為保健品市場提供功能性食品基料,為禽蛋功能性食品的開發打下堅實的基礎。目前對卵黃來源IgY的研究主要集中在制備、分離純化及其應用上;而研究修飾結構,結構與穩定性以及免疫活性關系尚少。由于IgY和IgG的相似性,隨著對IgG研究的深入,人們越來越清楚地意識到免疫球蛋白糖鏈在維持其自身的結構、理化性質、抗原特性等功能中扮演重要角色。在實際應用方面,雞卵黃免疫球蛋白的糖基化研究,在科學研究的基礎上為開發蛋黃深加工保健食品、添加劑以及醫藥產品提供了一定的科學依據,從而使我國蛋品資源的原料優勢轉化為產品優勢,資源優勢轉化為經濟優勢。
參考文獻:
[1] 嚴欽, 俞慧清, 成國祥. 蛋白糖基化與免疫研究進展[J]. 現代免疫學, 2008, 28(2): 165-168.
[2] XU Fanxing, XU Yongping, JIN Liji, et al. Effectiveness of egg yolk immunoglobulin (IgY) against periodontal disease-causing Fusobacterium nucleatum[J]. Journal of Applied Microbiology, 2012, 113(4): 983-991.
[3] LI Xiaoyu, HE Liu, XU Yongping, et al. Chicken egg yolk antibody (IgY) controls solobacterium moorei under in vitro and in vivo conditions[J]. Applied Biochemistry and Biotechnology, 2012(6): 1448-1458.
[4] WANG Linhui, LI Xiaoyu, JIN Liji, et al. Characterization of chicken egg yolk immunoglobulins (IgYs) specific for the most prevalent capsular serotypes of mastitiscausing Staphylcoccus aureus[J]. Veterinary Microbiology, 2011, 149(3/4): 415-421.
[5] ZHEN Yuhong, JIN Liji, LI Xiaoyu, et al. Efficacy of specific egg yolk immunoglobulin (IgY) to bovine mastitis caused by Staphylococcus aureus[J]. Veterinary Microbiology, 2009, 133(4): 317-322.
[6] EDZARD S, INGKE B, KERSTIN G. A vian IgY antibodies and their recombinant equivalents in research, diagnostics and therapy[J]. Biologicals, 2012, 40(5): 313-322.
[7] GAMBLIN D P, SCANLAN E M, DAVIS B G. Glycoprotein synthesis: an update[J]. Chemical Reviews, 2009, 109(1): 131-163.
[8] 連高焱, 俞飚. 蛋白質的化學糖基化研究進展[J]. 中國科學: 化學, 2012, 42(12): 1746-1759.
[9] LEE Y C, STOWELL C P, KRANTZ M J. 2-Imino-2-methoxyethyl-1-thioglycosides: new reagents for attaching sugars to proteins[J]. Biochemstry, 1976, 15(18): 3956-3963.
[10] GRAY G R. The direct coupling of oligosaccharides to proteins and derivatized gels[J]. Archives of Biochemistry and Biophysics, 1974, 163(1): 426-428.
[11] MA Xiaojuan, CHEN Hongbing, GAO Jinyan, et al. Conformation affects the potential allergenicity of ovalbumin after heating and glycation[J]. Food Additives and Containants, 2013, 30(10): 1684-1692.
[12] WERNER R G, KOPP K, SCHLUETER M. Glycosylation of therapeutic proteins in different production systems[J]. Acta Paediatrica, 2007, 96: 17-22.
[13] HANG H C, BERTOZZI C R. Chemoselective approaches to glycoprotein assembly[J]. Accounts of Chemical Research, 2001, 34(9): 727-736.
[14] van BERKEL S S, van ELDIJK M B, van HEST J. Staudinger lig ation as a method for bioconjugation[J]. Angewandte Chemie International Edition, 2011, 50(38): 8806-8827.
[15] HALTIWANGER R S, LOWE J B. Role of glycosylation in development [J]. Annual Review of Biochemistry, 2004, 73(1): 491-537.
[16] BOUTUREIRA O, BERNARDES G J L, FERN?NDEZ-GONZ?LEZ M, et al. Selenenylsulfide-linked homogeneous glycopeptides and glycoproteins: synthesis of human "hepatic Se metabolite A"[J]. Angewandte Chemie, 2012, 124(6): 1461-1465.
[17] van KASTEREN S I, KRAMER H B, GAMBLIN D P, et al. Siteselective glycosylation of proteins: creating synthetic glycoproteins[J]. Nature Protocols, 2007, 2(12): 3185-3194.
[18] WILMAR D S, DENISE V T. IgY: a promising antibody for use in immunodiagnostic and in immunotherapy[J]. Veterinary Immunology and Immunopathology, 2010, 135(3/4): 173-180.
[19] ARNOLD J N, WORMALD M R, SIM R B, et.al. The impact of glycosylation on the biological function and structure of human immunoglobulins[J]. Annual Review of Immunology, 2007, 25(1): 21-50.
[20] RAMSLAND P A, FARRUGIA W. Crystal structures of human antibodies detailed and unfinished tapestry of immunoglobulins gene products[J]. Journal of Molecular Recognition, 2002, 15(5): 248-259.
[21] MENINI T, GUGLIUCCI A, STAHL A J C. Polyclonal immunoglobulin M: location of glycation sites[J]. Clinica Chimica Acta, 1992, 213(1/3): 23-35.
[22] HUHN C, SELMAN M H J, RUHAAK L R, et al. IgG glycosylation analysis[J]. Proteomics, 2009, 9(4): 882-913.
[23] MORRISON S L, MOHAMMED M S, WIMS L A, et al. Sequences in antibody molecules important for receptor-mediated transport into the chicken egg yolk[J]. Molecular Immunology, 2002, 38(8): 619-625.
[24] SUZUKI N, LEE Y C. Site-speci c N-glycosylation of chicken serum IgG[J]. Glycobiology, 2004, 14(3): 275-292.
[25] BECHOR D S, LEVY Y. Effect of glycosylation on protein folding: a close look at thermodynamic stabilization[J]. Proceedings of the National Academy of Sciences, 2008, 105(24): 8256-8261.
[26] DEEBA S J, SHAMILA F, SALEEMUDDIN M. Immunoglobulin glycation with fructose: a comparative study[J]. Clinica Chimica Acta, 2007, 378(1): 86-92.
[27] 朱立平. 蛋白質糖基化與B細胞免疫[J]. 現代免疫學, 2001, 21(4): 193-194.
[28] SALA R J, GRIBINOW K. Effects of glycosylation on the stability of protein pharmaceuticals[J]. Journal of Pharmaceutical Sciences, 2009, 98(4): 1223-1245.
[29] SPERANDIO M, GLEISSNER C A, LEY K. Glycosylation in immune cell trafficking[J]. Immunological Reviews, 2009, 230(1): 290-293.
[30] SPIRO R G. Protein glycosylation: nature, distribution, enzymatic formation and disease implications of glycopeptide bonds[J]. Glycobiology, 2002, 12(4): 43-56.
[31] PHAM V T, EWING E, KAPLAN H, et al. Glycation improves the thermostability of trypsin and chymotrypsin[J]. Biotechnology and Bioengineering, 2008, 101(3): 452-459.
[32] ANBARASAN S, JENIS J, PALOHEIMO M, et al. Effect of glycosylation and additional domains on the thermostability of a family 10 xylanase produced by Thermopolyspora fl exuosa[J]. Applied and Environmental Microbiology, 2010, 76(1): 356-360.
[33] WANG Wei, ANTONSEN K, WANG Y J, et al. pH dependent effect of glycosylation on protein stability[J]. European Journal of Pharmaceutical Sciences, 2008, 33(2): 120-127.
[34] SHIMIZU M, NAGASHIMA H, SANO K, et al. Molecular stability of chicken and rabbit immunoglobulin G[J]. Bioscience, Biotechnology and Biochemistry, 1992, 56(2): 270-284.
[35] TAYLOR A I, FABIANE S M, SUTTON B J, et al. The crystal structure of an avian IgY-Fc fragment reveals conservation with both mammalian IgG and IgE[J]. Biochemistry, 2009, 48(3): 558-562.
Research Progress in the Glycosylation and Structure-Function Relationship of Chicken Egg Yolk Immunoglobulin
TONG Chen-yao, HE Zhen-jiao, GENG Fang, MA Mei-hu, HUANG Xi, CAI Zhao-xia*
(National R&D Center for Egg Processing, College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Egg yolk immunoglobulin (IgY) is an antibody existing in the egg yolk. It is easy to be obtained and produced. Also, it does not interact with rheumatoid factors or activate mammalian complement. Therefore it has become a potentially promising alternative to antibiotics. However, the application of IgY is limited due to its susceptibility to temp erature, pH and enzymatic degradation. The glycan structure of IgY plays an important role in maintaining the structure, physicochemical properties, antigenic properties and other functions of IgY. Glycosylation in IgY can improve its physical and chemical properties, which not only makes egg resources to be fully utilized but also provides a scientific basis for the development of egg yolk as health food, additives and other pharmaceutically relevant products. This article reviews several approaches for IgY glycosylation and discusses the relationships between glycosylation and the structures and physicochemical properties of IgY.
glycosylation; chicken egg yolk immunoglobulins; functional activity; structure-function relationship
Q51
A
1002-6630(2014)05-0230-04
10.7506/spkx1002-6630-201405045
2013-09-12
國家自然科學基金面上項目(31371810);中央高校基本科研業務費專項資金優秀人才培育項目(2013PY036)
佟晨瑤(1990—),女,碩士研究生,研究方向為食品科學。E-mail:tongchenyaoyy@163.com
*通信作者:蔡朝霞(1979—),女,副教授,博士,研究方向為食品科學。E-mail:caizhaoxia@mail.hzau.edu.cn

