Hedgehog信號通路成分SHH和Gli-1及血管內皮生長因子在人肺癌中的表達
鄭曉文,陳一強,孔晉亮,張劍鋒,經慶玲
目前,肺癌仍是癌癥導致的死亡中的首要原因,是一種具有高轉移潛能的高侵襲性惡性腫瘤,有很大一部分的肺癌明確診斷的時候已經處于晚期,錯過最佳的治療時機。異常激活的Hedgehog信號通路已經在很多腫瘤中發現,如基底細胞癌、胰腺癌、肝癌、前列腺癌、胃癌等[1-5]。Hedgehog信號通路有SHH、DHH、IHH 3個配體,其中最常見的是SHH,通過與ptch1結合,解除對SMO的抑制,啟動Gli-1核轉錄,激活HH靶基因的轉錄。Hedgehog信號通路成分的異常高表達常與腫瘤增強的遷移和侵襲能力相關[6]。Hedgehog信號通路的靶基因常是生長因子或生長因子受體,包括胰島素樣生長因子2(IGF-2)、血管內皮生長因子(VEGF)和血小板衍生生長因子受體α(PDGFRα)[7]。本研究通過檢測人肺癌組織中的Hedgehog信號通路主要成分SHH、Gli-1及靶基因VEGF的表達,分析其與不同臨床病理特征的相關性。
1 材料與方法
1.1 臨床資料 選取2013年3—10月廣西醫科大學第一附屬醫院臨床病理明確診斷為肺癌,并行外科手術治療的患者72例為研究對象,取癌組織及癌旁組織(距離癌組織5 cm)。其中男40例,女32例;年齡33~84歲,平均(57.7±13.1)歲;腺癌50例,鱗癌12例,小細胞癌4例,其他6例。有吸煙史36例,術前有化史4例。另選取同時期良性肺病變組織30例為對照組,其中男18例,女12例;年齡39~67歲,平均(45.8±10.3)歲;包括支氣管擴張12例,肺結核球9例,肺炎性假瘤5例,肉芽腫性炎3例,肺氣腫1例。本研究取得廣西醫科大學第一附屬醫院倫理審查委員會的審查批準。
1.2 實驗材料 RNA樣品保存液(TIANGEN,DP408);反轉錄試劑盒〔寶生物工程(大連)有限公司〕;定量PCR試劑盒(Roche);SHH抗體(Santa Cruz,sc-1194),Gli-1抗體(Santa Cruz,sc-20687),VEGF單克隆抗體(Origene,TA500042)。
1.3 實時熒光定量PCR引物序列 在美國國立生物技術信息中心(NCBI)基因庫查到相應的基因序列,采用Oligo 5.0進行引物設計,然后在NCBI上進行Primer-BLAST,采用評分最高的引物序列。引物序列的合成由北京六合華大基因科技股份有限公司合成(見表1)。
1.4 免疫組織化學法檢測肺癌組織SHH、Gli-1、VEGF的表達 將取得的癌組織、癌旁組織、良性肺病變組織經甲醛溶液固定后,石蠟包埋切片,熱修復后磷酸鹽緩沖液(PBS)沖洗3次,3%過氧化氫(H2O2)室溫孵育20 min,PBS沖洗3次,滴加一抗(SHH 1∶50,Gli-1 1∶75,VEGF 1∶100),4 ℃孵育過夜。PBS沖洗3次,加入酶標二抗,室溫孵育20 min,PBS沖洗3次,二氨基聯苯胺(DAB)顯色3~5 min,鏡下監控顯色程度。蒸餾水沖洗3次,Mayer蘇木素10~20 s,分化,返藍。梯度乙醇脫水,二甲苯透明,中性樹脂封片。光鏡下觀察結果并拍照。鏡下可見相應定位區域出現明顯棕黃色顆粒為陽性,按陽性細胞數和染色強度進行半定量:0分:無陽性細胞,1分:陽性細胞≤25%,2分:陽性細胞26%~50%,3分:陽性細胞>50%;按染色強度:0分:無著色,1分:淺棕色,2分:棕黃色,3分:棕褐色。每張切片兩項得分相乘:0分為陰性,1~2分為弱陽性,3~4分為中陽性,>4分為強陽性。3分以上定為陽性表達。

表1 引物序列及產物長度Table 1 Primer sequences and the length of amplified products
注:VEGF=血管內皮生長因子
1.5 實時熒光定量PCR檢測肺癌組織的SHH、Gli-1、VEGF mRNA的表達 將癌組織、癌旁組織、良性肺病變組織用0.9%氯化鈉溶液清洗后放入至RNA樣本保存液中,存至-80 ℃冰箱中。肺癌組織在研缽中碾碎后,用RNA提取試劑盒提取組織總RNA,電泳判斷總RNA的完整性,反轉錄試劑盒獲得cDNA,進行實時熒光定量PCR反應,反應體系20 μl〔Mix 10 μl,上游引物(10 μmol/L)0.6 μl,下游引物(10 μmol/L)0.6 μl,cDNA 1 μl,雙蒸水7.8 μl〕。反應條件95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min(40個循環)。60 ℃收集熒光。軟件生成的標準曲線R2均大于0.99,擴增效率為90%~110%。按以上體系以及條件分別測定待測樣本目的基因及內參的Ct值,2-ΔΔCt法計算基因表達的差異。
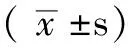
2 結果
2.1 SHH、Gli-1、VEGF在肺癌組織、癌旁組織、良性肺病變組織的表達情況 SHH、Gli-1、VEGF陽性染色均呈棕黃色,SHH主要表達在肺癌組織的腫瘤細胞中,定位在胞質。Gli-1和VEGF在肺癌組織中主要表達在胞質中(見圖1)。
肺癌組織中SHH陽性表達率為73.6%(53/72),癌旁組織為16.7%(12/72),良性肺病變組織為6.7%(2/30),差異有統計學意義(χ2=64.819,P<0.05);其中肺癌組織和癌旁組織SHH陽性表達率高于良性肺病變組織,肺癌組織SHH陽性表達率高于癌旁組織,差異均有統計學意義(P<0.01)。肺癌組織中Gli-1陽性表達率為30.6%(22/72),癌旁組織為8.3%(6/72),良性肺病變組織為6.7%(2/30),差異有統計學意義(χ2=15.300,P<0.05);其中肺癌組織和癌旁組織Gli-1陽性表達率高于良性肺病變組織,肺癌組織Gli-1陽性表達率高于癌旁組織,差異均有統計學意義(P<0.01)。肺癌組織中VEGF陽性表達率為75.0%(54/72),癌旁組織為69.4%(50/72),良性肺病變組織為16.7%(5/30),差異有統計學意義(χ2=34.530,P<0.05);其中肺癌組織和癌旁組織VEGF陽性表達率高于良性肺病變組織,差異均有統計學意義(P<0.01)。
2.2 SHH、Gli-1、VEGF陽性表達率與肺癌患者臨床病理特征的關系 不同性別、年齡、吸煙史、分化程度、術前放化療肺癌患者Gli-1陽性表達率比較,差異均有統計學意義(P<0.05);不同淋巴結轉移、遠處轉移、TNM分期、早晚期、分化程度、病理類型、術前放化療肺癌患者VEGF陽性表達率比較,差異均有統計學意義(P<0.05,見表2)。
2.3 SHH、Gli-1、VEGF mRNA在肺癌組織、癌旁組織、良性肺病變組織的表達情況 肺癌組織中SHH mRNA相對表達量為(60.857±5.446),癌旁組織為(10.848±1.600),良性肺病變組織為(25.763±2.178),差異有統計學意義(F=110.982,P<0.05)。肺癌組織中Gli-1 mRNA相對表達量為(9.804±1.054),癌旁組織為(5.661±0.612),良性肺病變組織為(3.551±0.545),差異有統計學意義(F=59.183,P<0.05)。肺癌組織中VEGF mRNA相對表達量為(0.574±0.051),癌旁組織為(0.495±0.027),良性肺病變組織為(0.357±0.030),差異有統計學意義(F=6.061,P<0.05)。
2.4 SHH、Gli-1、VEGF mRNA相對表達量與肺癌患者臨床病理特征的關系 不同性別、吸煙史、TNM分期、分化程度、病理類型、術前放化療肺癌患者Gli-1 mRNA相對表達量比較,差異均有統計學意義(P<0.05);不同分化程度、術前放化療肺癌患者VEGF mRNA相對表達量比較,差異均有統計學意義(P<0.05,見表3)。

表2 SHH、Gli-1、VEGF陽性表達率與肺癌患者臨床病理特征的關系〔n(%)〕Table 2 Correlations of SHH,Gli-1,VEGF expression with clinicopathologic characteristics in human lung cancer
注:-為Fisher確切概率法
2.5 肺癌組織中SHH、Gli-1和VEGF的表達與mRNA相對表達量的相關性分析 肺癌組織中SHH、Gli-1和VEGF的表達與mRNA相對表達量均呈正相關(P<0.05,見表4)。
3 討論
Hedgehog信號通路在脊柱動物中呈保守狀態,在哺乳動物的發育過程中高度激活,特別是神經管和骨骼中,但是隨即沉默在大多數成熟組織中。然而,一些生后成熟的器官,比如中樞神經系統、肺臟,在損傷后依靠持續的Hedgehog信號通路來維持組織的內環境穩定和修復[8]。異常調節的Hedgehog信號通路在腫瘤一系列關鍵生物過程中起作用,如細胞增殖、細胞周期的調節、抗凋亡蛋白的下調、EMT形成和干細胞信號途徑[9]。
表4 肺癌組織中SHH、Gli-1和VEGF的表達與mRNA相對表達量的相關性分析
Table4 Correlation analysis of protein and mRNA level of SHH,Gli-1 and VEGF

r值P值SHH0 7180 000Gli-10 7960 000VEGF0 8740 000

表3 SHH、Gli-1、VEGF mRNA相對表達量與肺癌患者臨床病理特征的關系Table 3 Correlations of SHH,Gli-1 and VEGF mRNA expression with clinicopathologic characteristics in human lung cancer
注:*為F值
呼吸道損傷修復期上皮組織內Hedgehog信號通路被廣泛激活,通過調控干細胞/祖細胞的增殖分化,促進組織修復[10]。目前Hedgehog信號通路在肺癌中表達的研究結果不盡相同。Watkins等[10]用7個小細胞肺癌(SCLC)細胞系和7個非小細胞肺癌(NSCLC)細胞系在體外培養,這些肺癌細胞系均表達SHH,7個SCLC有5個同時表達SHH和Gli-1;NSCLC中SHH表達下降,均無Gli-1表達。有學者用免疫組織化學法檢測40例SCLC組織中Gli-1表達率為34例(85%),其中26例為中陽性或強陽性,同時檢測18種SCLC細胞系,僅有一種表達Gli-1,提示Gli-1在體內的表達高于體外[11]。
本研究中72例肺癌中腺癌50例,鱗癌12例,小細胞癌4例。其中36例腺癌、8例鱗癌、3例SCLC SHH表達陽性,14例腺癌、6例鱗癌Gli-1表達陽性,40例腺癌、10例鱗癌VEGF表達陽性。SHH及Gli-1的陽性表達率與病理類型無關,VEGF在腺癌中的表達率高于鱗癌和小細胞癌。在研究中共納入4例有化療史的患者,術前均進行3或4次化療,病理類型為腺癌,具體的化療方案不詳,Gli-1陽性表達率明顯高于未化療的肺癌組織,VEGF的表達卻低于化療后肺癌組織。這與目前的肺癌化療的耐藥性形成有關,肺癌組織在藥物的作用下產生了某些適應性的變化,可導致多種分子和信號通路異常,當激活Hedgehog信號通路則異常表達Gli-1。而VEGF的變化則是多種因素共同作用下的結果。
持續激活的Hedgehog信號通路成分——SMO可以在促進人SCLC細胞的克隆形成,促進鼠SCLC的發生和發展,藥理阻斷Hedgehog信號通路則可以抑制人和鼠SCLC的生長,尤其是化療后更加明顯,顯示Hedgehog信號通路在SCLC的發展和維持中起著重要的細胞內作用[12]。本研究在72例肺癌組織中檢測到SHH、Gli-1、VEGF的陽性表達率均高于良性肺病變組織,表明人肺癌組織有異常激活的SHH信號通路,高表達的SHH配體啟動SHH信號通路傳導,導致Gli-1的轉錄,作用于靶基因VEGF,發揮其在腫瘤發生、發展中的調控作用。SHH、Gli-1、VEGF在蛋白水平和基因水平表達呈一致性,表明其在基因水平后翻譯修飾表達至蛋白水平,整個過程呈連續一致性。Raz等[13]的研究結果同樣表明Hedgehog信號通路下游成分以SHH為主,并且在NSCLC中主要以SHH配體依賴的方式發揮作用。
肺癌組織中SHH、Gli-1陽性表達率高于癌旁組織,VEGF陽性表達率在肺癌組織和癌旁組織無差異。具有高轉移傾向的器官表現出明顯的血管生成傾向,高表達VEGF,從而可以刺激巨噬細胞產生金屬基質蛋白酶(MMPs),降解局部細胞外基質(ECM),從而使腫瘤細胞增殖[14]。VEGF還可以作為重要成分激活內皮細胞中的αvβ3整合素,在腫瘤的轉移和侵襲中發揮著重要的作用[15]。本研究中VEGF肺癌組織和癌旁組織中同樣高表達,VEGF在伴有遠處轉移、淋巴轉移的肺癌組織中高表達,與其在腫瘤發生過程中促進血管生成的重要作用相關。
Hedgehog信號通路抑制劑GDC-0449可以抑制肺腺癌和SCLC細胞系的細胞生長,增加順鉑的細胞毒效應[16]。Hedgehog信號通路主要成分SHH、Gli-1及VEGF在肺癌中高表達,與腫瘤的發展密切相關,提示基于抑制Hedgehog信號通路及VEGF抑制劑的聯合治療是肺癌分子靶向治療的一項有效措施,可以提高肺癌生物綜合治療的有效性。

注:A為SHH陰性,B為SHH弱陽性,C為SHH中陽性,D為SHH強陽性,E為Gli-1陰性,F為Gli-1弱陽性,G為Gli-1中陽性,H為Gli-1強陽性,I為VEGF陰性,J為VEGF弱陽性,K為VEGF中陽性,L為VEGF強陽性
圖1 肺癌組織、癌旁組織、良性肺病變免疫組織化學法染色(×400)
Figure1 Immunohistochemical staining of human lung cancer tissue,cancer adjacent tissue and benign lung lesions
1 Yoo YA,Kang MH,Lee HJ,et al.Sonic hedgehog pathway promotes metastasis and lymphangiogenesis via activation of Akt,EMT,and MMP-9 pathway in gastric cancer[J].Cancer Research,2011,71(22):7061-7070.
2 Datta S,Datta MW.Sonic Hedgehog signaling in advanced prostate cancer[J].Cellular and Molecular Life Sciences,2006,63(4):435-448.
3 Chen JS,Huang XH,Wang Q,et al.Sonic hedgehog signaling pathway induces cell migration and invasion through focal adhesion kinase/AKT signaling-mediated activation of matrix metalloproteinase(MMP)-2 and MMP-9 in liver cancer[J].Carcinogenesis,2013,34(1):10-19.
4 Schveigert D,Cicenas S,Bruzas S,et al.The value of MMP-9 for breast and non-small cell lung cancer patients′ survival[J].Advances in Medical Sciences,2013,58(1):73-82.
5 Yang L,Xie G,Fan Q,et al.Activation of the hedgehog-signaling pathway in human cancer and the clinical implications[J].Oncogene,2010,29(4):469-481.
6 Ok CY,Singh RR,Vega F.Aberrant activation of the hedgehog signaling pathway in malignant hematological neoplasms[J].The American Journal of Pathology,2012,180(1):2-11.
7 Xie J.Hedgehog signaling pathway:development of antagonists for cancer therapy[J].Current Oncology Reports,2008,10(2):107-113.
8 Beachy PA,Karhadkar SS,Berman DM.Tissue repair and stem cell renewal in carcinogenesis[J].Nature,2004,432(7015):324-331.
9 Weiss GJ,Von Hoff DD.Hunting the hedgehog pathway[J].Clinical Pharmacology and Therapeutics,2010,87(6):743-747.
10 Watkins DN,Berman DM,Burkholder SG,et al.Hedgehog signalling within airway epithelial progenitors and in small-cell lung cancer[J].Nature,2003,422(6929):313-317.
11 Vestergaard J,Pedersen MW,Pedersen N,et al.Hedgehog signaling in small-cell lung cancer:frequent in vivo but a rare event in vitro[J].Lung Cancer,2006,52(3):281-290.
12 Park KS,Martelotto LG,Peifer M,et al.A crucial requirement for Hedgehog signaling in small cell lung cancer[J].Nature Medicine,2011,17(11):1504 -1508.
13 Raz G,Allen KE,Kingsley C,et al.Hedgehog signaling pathway molecules and ALDH1A1 expression in early-stage non-small cell lung cancer[J].Lung Cancer,2012,76(2):191-196.
14 Mehlen P,Puisieux A.Metastasis:a question of life or death[J].Nat Rev Cancer,2006,6(6):449-458.
15 Tzima E,Irani-Tehrani M,Kiosses WB,et al.A mechanosensory complex that mediates the endothelial cell response to fluid shear stress[J].Nature,2005,437(7057):426-431.
16 Tian F,Mysliwietz J,Ellwart J,et al.Effects of the Hedgehog pathway inhibitor GDC-0449 on lung cancer cell lines are mediated by side populations[J].Clinical and Experimental Medicine,2012,12(1):25-30.

