慢性腎衰竭模型中透明質酸和CD44對骨髓間充質干細胞歸巢及修復作用的影響
邊曉慧,何 平,孫廣萍,孫 立,李德天,馮江敏
骨髓間充質干細胞(MSC)的歸巢是其在各種腎臟疾病中發揮作用的第一步。目前,大量證據表明,當特定的組織器官受損后,外源性的MSC能夠優先定位于受損靶器官的受損部位,包括心[1]、腦[2]、腎[3]等,并且與MSC進入體內的方式無關。目前,對于MSC歸巢的機制并不明確,假說認為在受損的部位某種特異性的化學趨化因子或細胞因子較正常組織明顯升高,而MSC表達不同的黏附分子或趨化因子,其之間的相互作用促使MSC定向性地移動、黏附、定植于受損部位,從而發揮對靶器官的保護作用。透明質酸(HA)在很多腎臟疾病中都出現表達升高[4-6],而其特異性配體是MSC的表面特異性受體CD44。Zhu等[7]在體外實驗中發現HA能劑量依賴性地刺激MSC的遷移,Herrera等[4]在甘油誘導的急性腎衰竭模型中發現MSC的確能夠遷移至HA表達明顯的區域。所以目前提出了新的觀點,即CD44和HA之間的相互作用可能是外源性MSC在體內歸巢于受損腎臟的關鍵因素。本課題組前期實驗已經發現在大鼠5/6腎切除后的第8周給予尾靜脈注射MSC,不僅歸巢的數量較多,而且能夠修復受損的腎臟[8]。故本實驗擬在該模型中進一步研究MSC的歸巢是否也與CD44和HA之間的相互作用有關以及是否影響MSC修復腎臟的能力。
1 材料與方法
1.1 實驗材料 實驗用細胞株:穩定轉染綠色熒光蛋白的大鼠MSC/GFP購自賽業(廣州)生物科技有限公司(RASMX-01101)。實驗動物:成年健康清潔級雄性SD大鼠36只,體質量200~250 g,鼠齡7~8周,由中國醫科大學附屬盛京醫院動物室提供。主要試劑:SD大鼠MSC基礎培養基(RASMX-03011-440,廣州賽業),10% MSC專用胎牛血清(RASMX-05001-50,廣州賽業)。兔抗大鼠透明質酸結合蛋白(HABP)多克隆抗體(lifespan,USA);小鼠抗大鼠HABP單克隆抗體(Bio-World,USA);小鼠抗大鼠α平滑肌肌動蛋白(α-SMA)單克隆抗體(武漢博士德試劑有限公司);兔抗大鼠CD68多克隆抗體(武漢博士德試劑有限公司);抗CD44抗體(OX50,Becton Dickinson,San Jose,CA,USA);小鼠抗綠色熒光蛋白標簽單克隆抗體(Earth OX,LLC,San Francisco,CA,USA)。
1.2 實驗方法
1.2.1 MSC的培養和CD44的表達 MSC/GFP在SD大鼠MSC基礎培養基中,37 ℃ 5%CO2恒溫箱中進行常規細胞培養。MSC能夠持續表達綠色熒光(見圖1A),流式細胞儀分析MSC明顯表達CD44(圖1B)。

注:A為綠色熒光蛋白標記的MSC;B為CD44在MSC的表達;MSC=間充質干細胞
圖1 綠色熒光蛋白標記的MSC表達CD44
Figure1 Expression of CD44in MSC labled by GFP
1.2.2 建立大鼠慢性腎衰竭模型 所有大鼠的實驗步驟都經過中國醫科大學附屬盛京醫院動物倫理委員會批準。應用兩步法[9]建立大鼠慢性腎衰竭模型,適應性飼養1周后,先行右腎全切,1周后左腎切除2/3。假手術組只進行麻醉和腎被膜剝離,而不進行腎切除術。
1.2.3 MSC的治療 選取第二次術后8周仍存活的大鼠,根據體質量由小到大編號,從隨機數字表上抄錄隨機數字,每個隨機數目除以4,利用完全隨機設計法分為4組:假手術組(假手術大鼠尾靜脈注射1×107/ml MSC,n=8)、模型組〔5/6腎切除大鼠尾靜脈注射1 ml磷酸鹽緩沖液(PBS),n=8〕、MSC組(5/6腎切除大鼠尾靜脈注射1×107/ml MSC,n=8)和MSC/抗CD44組(5/6腎切除大鼠尾靜脈注射1×107/ml提前用抗CD44抗體OX50預孵的MSC,n=8)。治療4周后處死大鼠,留取血標本和腎組織。
1.3 腎功能指標 處死大鼠后收集血標本,分離上清液,于中國醫科大學附屬盛京醫院檢驗科應用常規方法檢測血清肌酐和尿素氮,進行腎功能的評估。
1.4 組織形態學分析 過碘酸雪夫(PAS)染色和Masson染色后觀察病理改變。采用半定量方法計算腎小球硬化指數[10]和腎小管間質損傷指數[11],其中腎小球硬化定義為局灶或球性毛細血管袢的閉塞或玻璃樣變,腎小管間質損傷的定義為炎性細胞浸潤、小管萎縮/代償性擴張和間質纖維化。
1.5 免疫熒光法 應用免疫熒光法進行腎組織MSC追蹤,雙熒光法觀察MSC與HA的定位關系。冷凍切片10 μm,熱修復,5%脫脂奶粉封閉30 min,滴加小鼠抗綠色熒光蛋白標簽單克隆抗體(1∶5 000)或兔抗大鼠HA結合蛋白抗體(1∶50),PBS替代一抗作為陰性對照,4 ℃過夜,避光滴加對應的熒光二抗,4′,6-二脒基-2-苯基吲哚(DAPI)復染核5 min,甘油封片,共聚焦顯微鏡觀察。
1.6 免疫組化法 腎組織石蠟包埋,切片,脫蠟,熱修復,5%脫脂奶粉封閉,分別加入一抗:兔抗大鼠HA結合蛋白抗體(1∶50),小鼠抗大鼠α-SMA抗體(肌成纖維細胞標記,1∶320)和兔抗大鼠CD68抗體(巨噬細胞標記,1∶150)按ABC免疫酶染色(ABC)法進行免疫組化染色,二氨基聯苯胺(DAB)顯色;PBS替代一抗作為陰性對照。每張切片隨機取10個高倍視野(×400),計算積分光密度值(IOD),取平均值。
1.7 免疫印跡法 稱取100 mg腎皮質,提取總蛋白,應用BCA法測定蛋白濃度,變性,聚丙烯酰胺凝膠電泳,轉膜,封閉。不同的轉移膜分別加入不同一抗〔小鼠抗大鼠HA結合蛋白抗體(1∶300)和兔抗大鼠β-actin單克隆抗體1∶2 000〕4 ℃過夜,加入相應的二抗,ECL顯色發光,電腦掃描拍照,圖像分析系統測定光密度值。計算目的蛋白與β-actin光密度比值作為半定量指標。
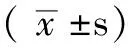
2 結果
2.1 4組腎功能、腎小球硬化指數、腎小管間質損傷指數比較 4組肌酐、尿素氮、腎小球硬化指數、腎小管間質損傷指數比較,差異均有統計學意義(P<0.05);其中與假手術組比較,模型組、MSC組、MSC/抗CD44組肌酐、尿素氮、腎小球硬化指數、腎小管間質損傷指數均升高,差異有統計學意義(P<0.05);與模型組比較,MSC組、MSC/抗CD44組肌酐、尿素氮、腎小球硬化指數、腎小管間質損傷指數均降低,差異有統計學意義(P<0.05);MSC組、MSC/抗CD44組比較,差異均無統計學意義(P>0.05,見表1)。

Table1 Comparasion of renal function,glomerulosclerosis index and renal tubular mesenchymal damage index among 4 groups

組別例數肌酐(μmol/L)尿素氮(mmol/L)腎小球硬化指數腎小管間質損傷指數假手術組842 95±5 236 81±1 130 83±0 090 07±0 07模型組891 98±6 32?17 48±2 05?1 75±0 18?2 87±0 16?MSC組881 00±9 33?△10 36±1 73?△1 41±0 09?△2 59±0 29?△MSC/抗CD44組884 56±6 41?△11 51±1 81?△1 48±0 09?△2 62±0 29?△F值78 7553 58135 61351 94P值 0 00 0 00 0 00 0 00
注:與假手術組比較,*P<0.05;與模型組比較,△P<0.05
2.2 MSC對腎組織病理的影響 PAS染色和Masson染色結果發現,與假手術組相比(見圖2A、圖3A),模型組的腎臟病理改變主要為腎小球肥大、腎小管上皮細胞濁腫變性,局灶系膜細胞增生,系膜基質增寬,局灶性腎小球毛細血管袢玻璃樣變、間質細胞炎性細胞浸潤,灶性間質纖維化(見圖2B、圖3B)。MSC治療后上述病理改變均有所改善(見圖2C、圖3C),提前用抗CD44抗體孵育的MSC治療4周后,上述病理改變亦得到改善(見圖2D、圖3D)。
2.3 腎組織中MSC追蹤 治療4周后,假手術組未發現有歸巢的MSC(見圖4A),而在MSC組的殘腎組織中發現較多的MSC,主要定位于腎小管上皮細胞、血管周圍、腎間質和部分腎小球內(見圖4B),而MSC/抗CD44組歸巢的MSC減少,尤其是腎小管上皮細胞內(見圖4C)。雙免疫熒光結果顯示較多MSC歸巢HA表達豐富的區域(見圖4D)。
2.4 腎組織中HA的表達 HA在假手術組大鼠的腎皮質幾乎不表達(見圖5A),而髓質有部分表達(見圖5B),模型組大鼠受損腎小管上皮細胞胞質中明顯分泌HA,在腎小球和腎間質也有少量HA的表達(見圖5C)。免疫印跡法也證實模型組大鼠腎皮質HA蛋白表達水平明顯增高(見圖5D)。
2.5 MSC對腎組織巨噬細胞和肌成纖維細胞的影響 與假手術組相比(見圖6A、圖7A),模型組大鼠的腎小球和間質內有大量巨噬細胞(CD68陽性的細胞)浸潤(見圖6B),同時有明顯的肌成纖維細胞(α-SMA陽性的細胞)堆積(見圖7B),而提前用或不用抗CD44抗體預孵的MSC治療后均能明顯減少巨噬細胞(圖6C、D)和肌成纖維細胞(見圖7C、D)。
3 討論
目前研究證實無論是甘油[4]、順鉑[12]或缺血-再灌注[13]誘導的急性腎受損、還是免疫介導的[3]或非免疫介導的[14]慢性腎臟損傷中,外源性MSC均能歸巢于受損部位。Kunter等[3]給抗Thy1.1腎炎大鼠的左腎動脈注入標記的MSC,第4~10天20%~50%的腎小球都能夠發現標記的MSC,而將標記的系膜細胞用同樣的方法注入,結果雙腎均未發現標記的MSC。本課題組在慢性馬兜鈴腎病大鼠實驗中發現,尾靜脈注射MSC后發現在損傷較為明顯的皮髓質交界部位的腎小管和腎間質內有標記的MSC[14-16]。類似的,本實驗發現在5/6腎切除術后第8周尾靜脈注射MSC,治療4周后也發現標記的MSC歸巢于殘腎組織,主要定位于受損的腎小球、腎小管、腎間質和管周毛細血管叢。

注:A為假手術組,B為模型組,C為MSC組,D為MSC/抗CD44組
圖2 腎組織的PAS染色(×400)
Figure2 PAS staining in kidney tissue
注:A為假手術組,B為模型組,C為MSC組,D為MSC/抗CD44組
圖3 腎組織的Masson染色(×400)
Figure3 Masson staining in kidney tissue
注:A為假手術組,B為MSC組,C為MSC/抗CD44組,D為MSC與HA在MSC組的共表達
圖4 免疫熒光法追蹤腎組織中MSC(×400)
Figure4 Tracking MSC in remnant kidney tissue by immunofluorescence

注:A為假手術組腎皮質,B為假手術組腎髓質,C為模型組腎皮質,D為免疫印跡法;HA=透明質酸
圖5 腎臟HA免疫組化染色(×400)和腎皮質HA免疫印跡法
Figure5 Expression of HA by immunohistochemical staining in kidney tissue and by Western blotting in renal cortex
注:A為假手術組,B為模型組,C為MSC組,D為MSC/抗CD44組
圖6 腎組織中CD68的免疫組化染色(×400)
Figure6 Expression of CD68by immunohistochemistry staining in kidney tissue
注:A為假手術組,B為模型組,C為MSC組,D為MSC/抗CD44組
圖7 腎組織中α-SMA的免疫組化染色(×400)
Figure7 Expression of α-SMA by immunohistochemistry staining in kidney tissue
目前,對于MSC歸巢的機制并不明確,認為類似于炎性細胞向炎癥部位以及造血干細胞(HSC)向骨髓腔內的趨化運動,是一個高度選擇的過程,在受損的組織存在某種特異性的化學趨化因子或細胞因子較正常組織明顯升高,通過與MSC表達的某種趨化因子的相互作用促使MSC定向性地移動、黏附和定植于受損部位。既往研究已經證實SDF-1-CXCR4的相互作用是目前已知的HSC歸巢最強大的趨化劑[17],但史明霞等[18]研究發現大部分的MSC表面幾乎檢測不到CXCR4的表達,故提示MSC和HSC的歸巢機制可能不一樣。HA為一種線性非硫酸化糖胺聚糖,是細胞外基質的主要成分之一,其在正常腎髓質內含量豐富,而在腎皮質中幾乎完全缺乏,但是在很多急慢性腎臟損傷中都發現腎臟皮質大量表達HA[4-6]。相似的,本實驗中發現5/6腎切除術后的腎皮質中大量表達HA,主要由擴張的腎小管上皮細胞和炎性細胞浸潤的腎間質分泌,提示與腎臟受損密切相關。大多數MSC表面均表達HA的特異性配體CD44,本研究所用的MSC經過流式細胞儀分析表面標記也證實了這一點。體外實驗發現HA能劑量依賴性地刺激MSC的遷移,這種遷移能力可以被單克隆抗CD44抗體所抑制[7]。Herrera等[4]在甘油誘導的急性腎衰竭模型研究中發現MSC遷移至HA表達明顯的區域,能夠促進受損部位的形態學和功能的恢復,但如果給予用抗CD44抗體預處理的MSC或CD44-/-的MSC或只表達CD44但無CD44功能的MSC則都不能遷移至受損組織,結果證實HA-CD44的相互作用是MSC歸巢于急性腎臟損傷的主要原因。本實驗發現應用抗CD44特異性的抗體阻斷與HA的結合能力后,歸巢于殘腎組織的MSC也明顯減少,同時雙熒光分析大部分歸巢的MSC位于HA表達豐富的區域,所以本研究結果提示HA-CD44的相互作用在慢性腎衰竭模型中也參與了MSC的歸巢。
與Herrera等[4]研究結果不同的是,應用抗CD44抗體雖然阻斷了HA與CD44的相互作用,但并不能完全阻斷MSC的歸巢,同時還依然能夠改善殘腎功能,減少巨噬細胞的浸潤和延緩腎纖維化的發生,解釋這些現象可能的原因有:(1)本研究雙熒光結果顯示并不是所有歸巢的MSC都定位于HA表達豐富的區域,這說明HA-CD44的相互作用并不是惟一引起MSC在慢性腎衰竭模型中歸巢的趨化劑。近期研究發現人的MSC表面還存在其他一系列的趨化因子的受體,如CCR-CXCL1、CCR7-CX3CL1 和CXCR6-CXCL6等[19],它們之間的相互作用都具有潛在的MSC歸巢趨化能力,但可能存在組織特異性或者相互影響。(2)阻斷MSC的部分歸巢后并未影響MSC修復受損腎臟的能力,與既往研究一致[20-21],說明MSC修復受損腎臟主要是來自于旁分泌的機制[8]。(3)本實驗中應用MSC治療后4周觀察治療效果,如果延長觀察時間,用或不用抗CD44抗體提前孵育MSC可能會因歸巢的數量差別而表現出不同的治療效果。
綜上所述,在大鼠腎衰竭模型中,MSC表面的受體CD44與受損腎臟組織大量表達的HA之間的相互作用是影響外源性MSC歸巢于受損腎臟組織的原因之一,但是在觀察期內并未影響MSC修復受損腎臟的能力。
1 Kraitchman DL,Tatsumi M,Gilson WD,et al.Dynamic imaging of allogeneic mesenchymal stem cells afficking to myocardial infarction[J].Circulation,2005,112(10):1451-1461.
2 Ji JF,He BP,Dheen ST,et al.Interactions of chemokines and chemokine receptors mediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossal nerve injury[J].Stem Cells,2004,22(3):415-427.
3 Kunter U,Rong S,Djuric Z,et al.Transplanted mesenchymal stem cells accelerate glomerular healing in experimental glomerulonephritis[J].J Am Soc Nephrol,2006,17(8):2202-2212.
4 Herrera MB,Bussolati B,Bruno S,et al.Exogenous mesenchymal stem cells localize to the kidney by means of CD44following acute tubular injury[J].Kidney Int,2007,72(4):430-441.
5 Goransson V,Johnsson C,Jacobson A,et al.Renal hyaluronan accumulation and hyaluronan synthase expression after ischaemia-reperfusion injury in the rat[J].Nephrol Dial Transplant,2004,19(4):823-830.
6 馮江敏,吳靖川.慢性間質性腎炎炎癥細胞浸潤的特點[J].中華腎臟病雜志,1999,15(6):372-375.
7 Zhu H,Mitsuhashi N,Klein A,et al.The role of the hyaluronan receptor CD44in mesenchymal stem cell migration in the extracellular matrix[J].Stem Cells,2006,24(4):928-935.
8 Bian X,Zhang B,Guo W,et al.Effects of mesenchymal stem cells transplanted at different time points in a rat remnant kidney model[J].Am J Nephrol,2014,39(1):75-84.
9 Schaefer F,Chen Y,Tsao T,et al.Impaired JAK-STAT signal transduction contributes to growth hormone resistance in chronic uremia[J].Journal of Clinical Investigation,2001,108(3):467-475.
10 Aoyama I,Shimokata K,Niwa T.Combination therapy with benazepril and oral adsorbent ameliorates progressive renal fibrosis in uremic rats[J].Nephron,2002,90(3):297-312.
11 Tanaka T,Kojima I,Ohse T,et al.Cobalt promotes angiogenesis via hypoxia-inducible factor and protects tubulointerstitium in the remnant kidney model[J].Laboratory Investigation,2005,85(10):1292-1307.
12 Imberti B,Morigi M,Tomasoni S,et al.Insulin-like growth factor-1 sustains stem cell mediated renal repair[J].J Am Soc Nephrol,2007,18(11):2921-2928.
13 T?gel F,Weiss K,Yang Y,et al.Vasculotropic,paracrine actions of infused mesenchymal stem cells are important to the recovery from acute kidney injury[J].Am J Physiol Renal Physiol,2007,292(5):F1626-1635.
14 鄒杰,馮江敏,李維,等.同種異體骨髓間充質干細胞對腎小管周毛細血管叢修復影響的研究[J].中國中西醫結合雜志,2008,28(2):146-151.
15 李維,馮江敏,鄒杰,等.骨髓源性干細胞干細胞移植對慢性馬兜鈴酸腎病大鼠的治療作用[J].中華腎臟病雜志,2007,23(5):336-337.
16 Li W,Jiang H,Feng JM.Isogenic mesenchymal stem cells transplantation improves a rat model of chronic aristolochic acid nephropathy via upregulation of hepatic growth factor and downregulation of transforming growth factor β1[J].Molecular and Cellular Biochemistry,2012,368(1/2):137-145.
17 Juarez J,Bendall L,Bradstock K.Chemokines and their receptors as therapeutic targets:the role of the SDF-1/CXCR4 axis[J].Curr Pharm Pcs,2004,10(11):1245-1259.
18 史明霞,李靜,廖聯明,等.胎兒骨髓源 FIk1+間充質干細胞的歸巢機制[J].中國組織工程研究與臨床康復,2009,13(14):2673-2679.
19 Sordi V,Malosio ML,Marchesi F,et al.Bone marrow mesenchymal stem cells express a restricted set of functionally active chemokine receptors capable of promoting migration to pancreatic islets[J].Blood,2005,106(2):419-427.
20 Semedo P,Correa-Costa M,Antonio Cenedeze M,et al.Mesenchymal stem cells attenuate renal fibrosis through immune modulation and remodeling properties in a rat remnant kidney model [J].Stem Cells,2009,27(12):3063-3073.
21 Abdel Aziz MT,Wassef MA,Ahmed HH,et al.The role of bone marrow derived-mesenchymal stem cells in attenuation of kidney function in rats with diabetic nephropathy [J].Diabetol Metab Syndr,2014,6(1):34.

