急性缺血性卒中患者小腦和腦橋白質病變及其危險因素分析
高天理,劉春潔
腦小血管病(cerebral small vessel disease,CSVD)是最常見的神經系統疾病,指內徑為50~400 μm的腦小動脈、微動脈、小靜脈和毛細血管的一組病理過程,主要累及皮質下結構,表現為腔隙性腦梗死、白質病變(white matter lesion,WML)、擴大的周圍血管間隙和腦微出血,是導致卒中、殘障和癡呆的重要因素[1]。磁共振成像(MRI)技術為了解CSVD的發病機制提供了很大幫助,并作為臨床診斷的替代標志物。MRI上見到多發腔隙性腦梗死、彌漫性WML被認為是CSVD的特征性表現[2]。幕上WML是缺血性卒中或血管性死亡的預測指標,但是對于幕下結構,如小腦和腦橋WML的研究較少,其臨床意義仍然不太清楚。故本研究通過對206例缺血性卒中患者的顱腦MRI和臨床資料進行分析,探討小腦和腦橋WML的發生率及其危險因素。
1 資料與方法
1.1 一般資料 選取2011年10月—2012年10月在我院住院、資料完整的急性缺血性卒中〔腦梗死和短暫性腦缺血發作(TIA)〕患者206例,其中男119例,女87例;年齡為55~76歲,平均(67.8±7.1)歲。患者的臨床表現及顱腦MRI檢查均符合1995年全國第四次腦血管病學術會議建議的急性缺血性卒中診斷標準。排除:多發性硬化、遺傳性血管病、反復腦葉出血、一氧化碳中毒、腫瘤、放射治療、嚴重的睡眠呼吸暫停綜合征等特定原因所引起的影像學改變。
1.2 方法 回顧性分析患者的性別、年齡等一般資料,顱腦MRI檢查結果,卒中和TIA病史,糖尿病、高血壓、冠心病等卒中危險因素。顱腦MRI:采用3.0 T超導磁共振成像系統(Verio;Siemens,Erlangen,Germany),8通道相控陣頭顱線圈。所有患者進行軸位自旋回波(SE)T1加權像(T1WI)、快速自旋回波(FSE)T2加權像(T2WI)、T2液體衰減反轉恢復(FLAIR)檢查。掃描參數:軸位FSE T2WI〔重復時間(TR)4 300 ms,回波時間(TE)120 ms〕,SE T1WI〔TR 450 ms,TE 140 ms〕,FLAIR〔TR 8 000 ms,TE 140 ms,反轉時間(TI)2 100 ms〕,有效視野(FOV)24 cm×24 cm,矩陣256×256,掃描層厚5.0 cm,層間距1.0 cm。
顱腦MRI由不了解臨床資料的兩位神經放射醫生判讀,根據以下病變特征判定顱腦病變:(1)小腦和腦橋WML:小腦和腦橋T2WI和FLAIR上無明顯邊界的高信號病灶,T1WI上無或只有輕微的相應表現為低信號表現。(2)幕上WML:幕上腦室周圍和皮質下深部WML。根據年齡相關性腦白質改變評分(ARWMC):患者每側大腦半球均劃分為額葉、枕葉、顳葉、皮質下和基底核5 個區域,病變程度>2級,即初始融合及彌漫性融合性損害。(3)腔隙性腦梗死:T1WI上局灶性低信號和T2WI高信號,直徑<15 mm。腔隙性腦梗死數≥2為多發腔隙性腦梗死。(4)腦梗死:MRI上彌散加權圖像(DWI)為高信號、T1WI上局灶性低信號和T2WI高信號,直徑>3 mm、皮質或皮質下病變。
1.3 卒中危險因素相關定義 (1)糖尿病,空腹血糖≥7.0 mmol/L(126 mg/dl)或餐后2 h血糖≥11.1 mmol/L(200 mg/dl);隨機血糖≥11.1 mmol/L(200 mg/dl),糖化血紅蛋白(HbA1c)≥ 6.5%。(2)高血壓,患者已在進行降壓治療或2次不同日收縮壓>140 mm Hg(1 mm Hg=0.133 kPa),舒張壓>90 mm Hg。(3)既往卒中和TIA,卒中為符合國立神經疾病和卒中研究所(NINDS)標準的連續的卒中相關癥狀并被影像檢查證實;TIA根據NINDS標準,24 h內有卒中相關癥狀而影像學正常。
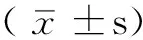
2 結果
2.1 小腦和腦橋WML發生率 206例患者中,有65例(31.6%)小腦和腦橋有T2WI高信號,即WML。其中42例(64.6%)的WML是雙側,23例(35.4%)的WML是單側。39例(60.0%)小腦和腦橋WML患者也可見幕上皮質下、側腦室旁和基底核T2WI高信號,提示合并幕上WML。
2.2 小腦和腦橋WML的MRI表現 小腦深部WML可見>1個小-中等大小(直徑2~5 mm)的病變(見圖1),而且多位于小腦后下動脈供血區。腦橋WML為單側或雙側對稱性分布在腦橋接近被蓋部,近似于三叉神經穿出水平(見圖2)。
2.3 小腦和腦橋WML危險因素分析 小腦和腦橋WML組患者的性別構成,卒中和TIA病史,糖尿病、冠心病、腦梗死的發生率與無小腦和腦橋WML組比較,差異均無統計學意義(P>0.05);而兩組患者的年齡及高血壓、幕上皮質下WML、多發腔隙性腦梗死的發生率比較,差異均有統計學意義(P<0.05,見表1)。
多因素Logistic回歸分析結果顯示,幕上皮質下WML〔OR=2.3,95%CI(1.4,7.5)〕、多發腔隙性腦梗死〔OR=2.1,95%CI(1.9,5.6)〕是小腦和腦橋WML的獨立影響因素。
3 討論
隨著神經影像技術的改良、人口老齡化、飲食和生活方式的改變,CSVD的診斷率越來越高,但確切原因仍不清楚。CSVD的臨床表現是多方面的,包括步態障礙、排尿障礙、情感障礙和認知功能下降(尤其是執行功能和處理速度),與之相關的卒中風險增加[3]。由于CSVD是一組異質性疾病,當出現上述某些癥狀時,臨床醫師可能不會考慮此診斷,錯過重要的干預時機。因此,研究CSVD的影像學表現和危險因素很有必要。

圖1 女性,66歲,MRI掃描顯示T2WI上雙側小腦WML(左圖),T2 FLAIR顯示同時合并幕上皮質下WML(右圖)
Figure1 Female,aged 66,MRI scans showed bilateral cerebellum WML(left) on T2WI,and simultaneously combined with subcortical WML(right) on T2 FLAIR

表1 小腦和腦橋WML組與無小腦和腦橋WML組卒中危險因素比較
注:TIA=短暫性腦缺血發作,WML=白質病變;*為t值

圖2 女性,60歲,MRI掃描顯示T2 FLAIR上腦橋對稱性WML(左圖),同時合并幕上皮質下WML(右圖)
Figure2 Female,aged 60,MRI scans showed pontine symmetric WML(left) on the T2 FLAIR,concomitant supratentorial subcortical WML(right)
3.1 WML的發病機制 顱腦MRI已在臨床上廣泛使用,臨床醫生在診治時偶然發現患者T2WI白質高信號(即WML)、T1WI等或稍低信號,在普通人群中的發生率:64歲左右的成年人為11%~21%,82歲左右為94%,高齡是其危險因素之一。白質高信號區域病理結果包括髓鞘蒼白、組織疏松伴髓鞘和軸突損傷及輕度膠質增生。這些病變位于深部腦白質,為小血管病變影響的區域。白質區域血管的特殊供血模式為長距離的穿支動脈,病變血管引起深部白質慢性低灌注;血-腦脊液屏障破壞,導致血漿慢性滲出到腦白質[4]。白質高信號在有心血管危險因素和癥狀性腦血管病患者中比較常見。隨著影像定量測量技術的開展和樣本量的增加,MRI白質高信號已作為卒中預測的替代標志物和新的危險因素,并可能在臨床試驗中作為觀察終點[5]。
3.2 小腦和腦橋WML的發病機制 本研究中,31.6%的急性缺血性卒中患者在小腦和腦橋有T2WI高信號,其中64.6%的WML是雙側的。60.0%的小腦和腦橋WML患者還可在幕上皮質下、側腦室旁和基底核見到T2WI高信號,提示合并幕上皮質下WML。
研究表明,卒中后患者的小腦和腦干WML最可能的原因是腦橋缺血性白質疏松和交叉纖維的華勒變性,也可累及同側大腦腳和內囊。腦橋雙側對稱WML常累及腦-小腦纖維、腦橋核團、腦橋被蓋網狀核、部分皮質腦橋束(錐體束)或內側丘系纖維,其由基底動脈的前內側和外側組供血。華勒變性是指軸突進行性變性的過程,其髓鞘與細胞體連接被破壞。在中樞神經系統中,華勒變性最經常發現在腦梗死后的皮質脊髓束,但也可能發生在其他WML時,如多發性硬化、進行性多灶性白質腦病、中樞神經系統腫瘤、外科手術、動靜脈畸形和出血。MRI上華勒變性隨時間的變化為發病后約4周,可以觀察到在同側腦干T2WI或質子加權成像(PDWI)信號強度降低。在70~80 d所有脈沖序列,此低信號接近等信號階段。81 d后,在T2WI上華勒變性可以被檢測為高信號,伴或不伴T1WI信號強度減低。此高信號強度在T2WI上是持續的,可維持到腦梗死后29年[6]。
3.3 小腦和腦橋WML的危險因素 本研究結果顯示,小腦和腦橋WML患者的年齡及高血壓、幕上皮質下WML、多發腔隙性腦梗死的發生率均高于無小腦和腦橋WML患者。
高血壓可以引起腦出血或缺血性病變,小血管病變所致的腦微出血常發生在小腦深部。研究表明,小腦深部周圍的區域齒狀核、腦橋、丘腦和基底核是腦微出血的好發部位。高血壓腦微出血病灶的分布及病理表現與缺血性小血管病變有共同模式,高血壓患者腔隙性腦梗死、WML與微出血的嚴重程度相關。動脈解剖證實,達到小腦深部白質的動脈逐步變細,小腦齒狀核和附近的白質易發生缺血性損害。小腦深部WML未受到足夠重視且此方面的研究較少,其原因是大多無癥狀,難以在急性期檢測到;顱腦CT不可能發現這些小病灶;慢性小腦深部區的小病灶可能被臨床醫生忽略,因為他們的臨床意義是未知的[7]。
年齡對WML嚴重程度的影響,<65歲的患者多數表現出1級(局灶性)為主的病變,而3級(彌漫性)病變幾乎沒有;而在高齡患者中(76~85歲),這種情況逆轉為全部病例上升至嚴重級別(2級融合病變和3級彌漫性病變)。說明年齡是一個主要的且可以預期的危險因素,這也預示著65歲是從低度到重度WML或腔隙性腦梗死進展的轉折點,在此之前危險因素治療可能產生積極的影響[8]。
多因素Logistic回歸分析顯示,幕上皮質下WML和多發腔隙性腦梗死均是小腦和腦橋WML獨立影響因素。以往的研究揭示了WML是構成卒中后康復和適應過程的一個組成部分。本研究結果顯示,卒中危險因素與小腦和腦橋WML有一定的相關性。在缺血性卒中患者中,小腦和腦橋WML很少作為一個孤立的現象發生,常合并嚴重的幕上缺血性損害,包括腔隙性腦梗死和WML。小腦和腦橋WML的臨床意義和預后價值應與幕上缺血性損害一起評估。對于患者來說,較差的臨床結果與相應較重的彌漫性WML有關。其治療原則應最大限度地控制危險因素,如糖尿病、高血壓等,以改善患者生活質量和減少殘疾[9]。
腔隙性腦梗死與小腦和腦橋WML有著共同的發病機制,慢性低灌注引起進行性白質變薄和膠質增生,可以造成腔隙形成、細胞外間隙擴大、星形細胞腫脹。所以,腔隙性腦梗死和WML可以同時出現在MRI上,二者均為CSVD的表現形式[10]。
1 Pantoni L.Cerebral small vessel disease:from pathogenesis and clinical characteristics to therapeutic challenges[J].Lancet Neurol,2010,9(7):689-701.
2 Patel B,Markus HS.Magnetic resonance imaging in cerebral small vessel disease and its use as a surrogate disease marker[J].Int J Stroke,2011,6(1):47-59.
3 Okroglic S,Widmann CN,Urbach H,et al.Clinical symptoms and risk factors in cerebral microangiopathy patients[J].PLoS One,2013,8(2):e53455.
4 Pantoni L,Garcia JH.Pathogenesis of leukoaraiosis:a review[J].Stroke,1997,28(3):652-659.
5 Debette S,Markus HS.The clinical importance of white matter hyperintensities on brain magnetic resonance imaging:systematic review and meta-analysis[J].BMJ,2010,341:c3666.
6 M?ntyl? R,Pohjasvaara T,Vataja R,et al.MRI pontine hyperintensity after supratentorial ischemic stroke relates to poor clinical outcome[J].Stroke,2000,31(3):695-700.
7 Park KY,Chung PW,Kim YB,et al.Association between small deep cerebellar ischemic lesion and small-vessel disease[J].Cerebrovasc Dis,2009,28(3):314-320.
8 Grueter BE,Schulz UG.Age-related cerebral white matter disease(leukoaraiosis):a review[J].Postgrad Med J,2012,88(1036):79-87.
9 Hainsworth AH,Brittain JF,Khatun H.Pre-clinical models of human cerebral small vessel disease:utility for clinical application[J].J Neurol Sci,2012,322(1/2):237-240.
10 Stewart AR.White matter hyperintensities:age appropriate or risk indicator?[J].J Insur Med,2012,43(2):84-91.

