早期糖尿病腎病泛素-核糖體融合蛋白52和尿微量清蛋白關系研究
張 艷,任 榮,梁新華,張 蕾
糖尿病腎病(DN)在糖尿病人群中發病率為20%~40%,是糖尿病的主要并發癥和死亡原因。近年來,隨著糖尿病患者數量的快速增長,DN發病率亦逐年上升,已經成為終末期腎病(ESRD)的首位病因。因此,早發現、早治療對于改善DN患者預后、降低醫療開支及社會經濟負擔有著積極作用。而尿微量清蛋白(microalbuminuria,MAU)是目前公認的診斷早期DN的標志性尿蛋白,但易受多種因素影響,如血糖、血壓控制不佳、24 h內劇烈活動、全身或尿路感染、血尿、充血性心力衰竭、發熱、使用非甾體抗炎藥和血管緊張素轉換酶抑制劑、吸煙、妊娠等[1],使其在早期DN診斷中準確性及預測價值降低。
DN是以腎小球系膜細胞病變為主的疾病,內皮細胞損傷和足細胞丟失在DN發病過程中起關鍵作用。近期研究發現,相對于腎小球病變,腎小管病變與腎功能惡化有更密切的關系[2]。腎小管間質改變并非繼發于腎小球病變,而是DN早期病變和原始特征之一[3-6]。近年來,隨著蛋白質組學技術在生物醫學領域的廣泛應用,研究者已經開始利用蛋白質組學技術篩選出能更早、更準確地預測或診斷DN病情進展與監測預后的生物標志物。Dihazi等[7]研究DN及糖尿病合并其他腎病患者尿液蛋白質譜發現,DN患者尿液特異性表達質核比為14∶766,并提出該蛋白可作為DN診斷性尿蛋白;后證實該蛋白為泛素-核糖體融合蛋白52(UBA52),DN可通過高糖和各種應激反應激活相應增強子,加強轉錄,表達UBA52[8-9]。本研究通過檢測血UBA52、尿UBA52、MAU及尿蛋白定量等指標,初探早期DN患者UBA52的表達及其與MAU的關系。
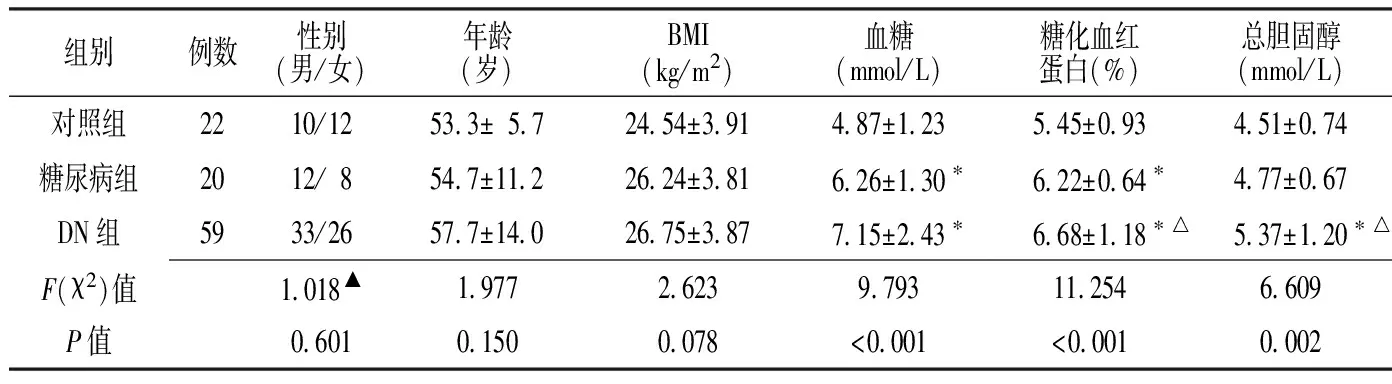
表1 3組臨床資料比較
注:與對照組比較,*P<0.05;與糖尿病組比較,△P<0.05;▲為χ2值
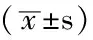
表2 3組血UBA52、尿UBA52、尿蛋白定量和MAU比較
注:與對照組比較,*P<0.05;與糖尿病組比較,△P<0.05;UBA52=泛素-核糖體融合蛋白52,MAU=尿微量清蛋白
1 資料與方法
1.1 納入標準 (1)年齡≥18歲,血肌酐<265 μmol/L,自愿參加試驗;(2)符合2010年《中國2型糖尿病防治指南》中的糖尿病診斷標準,且尿蛋白肌酐比率(ACR)≥30 μg/mg。
1.2 排除標準 (1)合并發熱、腫瘤、妊娠、充血性心力衰竭;(2)DN患者內生肌酐清除率≥265 μmol/L,其他原因所致的腎臟損害,如高血壓腎損害、原發性腎炎、腎病綜合征、IgA腎病。
1.3 一般資料 選取2012年2月—2013年3月新疆醫科大學第五附屬醫院收治的糖尿病患者20例(糖尿病組),DN患者59例(DN組)。另選取同期在本院體檢健康者22例作為對照組。
1.4 方法
1.4.1 血標本采集 于清晨空腹狀態下采集3組受試者靜脈血3 ml,分別裝入免疫管和生化管。
1.4.2 尿標本采集 尿標本:空腹8 h后晨起采集第1次清潔中段尿5 ml。尿蛋白定量標本:試驗前24 h禁服利尿劑,留取24 h尿,期間保持適當的水分攝入,禁服咖啡、茶等利尿性物質,準確計量全部尿量(ml)。
1.4.3 MAU、UBA52檢測方法 采用免疫透射比濁法檢測3組受試者MAU,檢測儀器為BECKMAN 8000,由同一名經驗豐富的檢驗醫師檢驗;采用ELISA法檢測3組受試者UBA52,試劑盒購自北京華夏遠洋公司,酶標比色計波長為450 nm,由3名培訓合格的研究人員進行檢驗操作。
2 結果
2.1 3組臨床資料比較 3組性別、年齡、BMI比較,差異均無統計學意義(P>0.05);3組血糖、糖化血紅蛋白、總膽固醇比較,差異均有統計學意義(P<0.05),其中DN組血糖、糖化血紅蛋白、總膽固醇均高于對照組,糖尿病組血糖和糖化血紅蛋白均高于對照組,DN組糖化血紅蛋白和總膽固醇均高于糖尿病組,差異有統計學意義(P<0.05,見表1)。
2.2 3組血UBA52、尿UBA52、尿蛋白定量和MAU比較 3組血UBA52、尿UBA52、尿蛋白定量和MAU比較,差異均有統計學意義(P<0.05),其中DN組血UBA52、尿UBA52、尿蛋白定量和MAU均高于對照組和糖尿病組,糖尿病組尿蛋白定量、MAU均高于對照組,差異有統計學意義(P<0.05,見表2)。
2.3 多元線性回歸分析 以DN患者尿UBA52為因變量,以血糖、糖化血紅蛋白、總膽固醇、MAU為自變量,進行多元線性回歸分析,結果顯示,MAU和糖化血紅蛋白進入回歸方程(P<0.05,見表3)。
表3 DN患者尿UBA52水平影響因素的多元線性回歸分析
Table3 Multiple linear regression analysis on influencing factors for urine UBA52 in DN patients
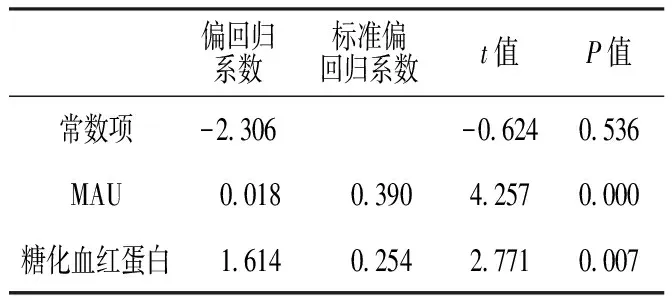
偏回歸系數標準偏回歸系數t值P值常數項-2306-06240536MAU 0018 039042570000糖化血紅蛋白 1614 025427710007
3 討論
糖尿病是全球最常見的慢性病之一,已成為重大的社會衛生問題。據統計,至2010年全球糖尿病患者達2.8億,預計其每年增長率為2.2%。發展中國家傳統生活方式改變、糖尿病診斷標準改變、公眾意識提高、總體人群病死率下降、肥胖率增加等,均會導致2型糖尿病的發生。WHO調查顯示,到2025年,中國和印度將有1.3億糖尿病患者,將消耗醫療預算的40%,嚴重阻礙經濟的發展。DN是常見的糖尿病微血管病并發癥,臨床上以微量清蛋白尿到大量蛋白尿為主要表現。在美國,30%~40%的DN由糖尿病導致[10]。然而,DN發病機制尚未完全清楚,臨床治療措施有限。2013年,本科住院患者DN患病率達17.8%,而40%的DN患者在住院開始即進行血液透析。目前就DN的診斷而言,傳統的腎活檢由于具有一定的創傷性,限制了其臨床應用,而尿清蛋白的檢測又存在特異度不高的缺陷[11-12]。因此,篩選早期、更準確的DN生物標志物不僅有助于更好地闡明DN的發生機制,且對DN的早期診斷、治療效果的檢測及預后的判斷均具有重大意義。最新研究發現,相對于腎小球病變,腎小管病變對腎功能惡化有更密切的關系,故選擇UBA52,其表達在腎小管,且證實與DN進展密切相關[13]。DN可以通過高糖和各種應激反應激活相應增強子,加強轉錄,表達UBA52,在泛素水解酶的作用下可水解釋放大量游離泛素分子維系泛素-蛋白酶體途徑(ubiquitin-ptoteasome path,UPP)的活性[14]。UPP是真核生物降解蛋白質的主要途徑,80%~90%的蛋白質被泛素蛋白酶系統降解。國內外多項研究提示,UPP參與了DN腎臟纖維化多條信號通路中重要蛋白分子,如轉化生長因子-β(TGF-β)、絲裂原活化蛋白激酶(MAPK)、核因子-κB(NF-κB)負調節因子的降解[15-16],引起信號通路的過度持久活化,對腎小球系膜細胞凋亡、抗原提呈、炎性演進和基因轉錄等多方面進行上調或下調,并促進腎臟纖維化,在DN的進展中起到重要作用。因UPP在DN患者中特異性表達,故其可以提高診斷早期DN的特異度。
本研究分別測定3組患者血UBA52、尿UBA52、尿蛋白定量及MAU等指標。結果顯示,DN組血UBA52、尿UBA52顯著高于糖尿病組和對照組,而糖尿病組與對照組比較無差異,具有干擾因素少、取材方便、無創性等優勢;而DN組和糖尿病組MAU均高于對照組,故在DN早期缺乏特異性。本研究結果亦顯示,MAU和糖化血紅蛋白水平升高可增加UBA52水平。近年來,許多研究證明,腎小管損傷在DN發生發展中起著重要作用。DN腎小管損傷的主要病理表現是小管細胞增生、肥大、萎縮、凋亡、轉分化等改變,同時腎小管周圍有炎性細胞浸潤及不同程度腎小管間質纖維化,重視并深入研究DN小管細胞損傷的機制對防治DN進展具有重要意義。動態監測尿UBA52,并對DN按照腎小球濾過率(GFR)進行分期,檢測其與腎小球濾過功能的關系,在給予血管緊張素Ⅱ受體拮抗劑(ARB)干預,評價其是否可作為臨床疾病轉歸的指標具有重要意義。
1 汪年松.繼發性腎臟病[M].北京:科學技術文獻出版社,2009:181-183.
2 Phillips AO,Steadman R.Diabetic nephropathy:the central role of renal proximal tubular cells in tubulointerstitial injury[J].Histol Histopathol,2002,17(1):247-252.
3 Tang SC,Leung JC,Lai KN.Diabetic tubulopathy:an emerging entity[J].Contrib Nephrol,2011,170:124-134.
4 Kanwar YS,Sun L,Xie P,et al.A glimpse of various pathogenetic mechanisms of diabetic nephropathy[J].Annu Rev Pathol,2011,6:395-423.
5 Najafian B,Kim Y,Crosson JT,et al.Atubular glomeruli and glomerulotubular junction abnormalities in diabetic nephropathy[J].J Am Soc Nephrol,2003,14(4):908-917.
6 Dalla Vestra M,Saller A,Bortoloso E,et al.Structural involvement in type 1 and type 2 diabetic nephropathy[J].Diabetes Metab,2000,26(Suppl 4):8-14.
7 Dihazi H,Müller GA,Lindner S,et al.
Characterization of diabetic nephropathy by urinary proteomic analysis:identification of a processed ubiquitin form as a differentially excreted protein in diabetic nephropathy patients[J].Clin Chem,2007,53(9):1636-1645.
8 Sun L,Pan X,Wada J,et al.Isolation and functional analysis of mouse UbA52 gene and its relevance to diabetic nephropathy[J].J Biol Chem,2002,277(33):29953-29962.
9 Wada J,Sun L,Kanwar YS.Discovery of genes related to diabetic nephropathy in various animal models by current techniques[J].Contrib Nephrol,2011,169:161-174.
10 Caramori ML,Fioretto P,Mauer M.Enhancing the predictive value of urinary albumin for diabetic nephropathy[J].J Am Soc Nephrol,2006,17(2):339-352.
11 Sun L,Pan X,Wada J,et al.Isolation and functional analysis of mouse UbA52 gene and its relevance to diabetic nephropathy[J].J Biol Chem,2002,277(33):29953-29962.
12 熱衣漢·西里甫,帕提古麗·阿斯討拜,桑曉紅.糖尿病腎病患者尿微量清蛋白相關因素研究[J].中國全科醫學,2012,15(8):2755.
13 Yin ST,Huang H,Zhang YH,et al.A fluorescence assay for elucidating the substrate specificities of deubiquitinating enzymes[J].Biochem Biophys Res Commun,2011,416(1/2):76-79.
14 Liu FY,Li XZ.The roles of Arkadia in renal tubular epithelial to mesenchymal transition[J].Med Hypotheses,2006,67(5):1205-1207.
15 Huo LJ,Fan HY,Zhong ZS,et al.Ubiquitin-proteasome pathway modulates mouse oocyte meiotic maturation and fertilization via regulation of MAPK cascade and cyclin B1 degradation[J].Mech Dev,2004,121(10):1275-1287.
16 Feng B,Zhang YQ,Mu J,et al.Uraemic serum induces dysfunction of vascular endothelial cells:role of ubiquitin-proteasome pathway[J].Exp Physiol,2011,96(8):801-815.

