系統性硬化癥合并類風濕關節炎三例并文獻復習
魯芙愛,王 慧,王永福
重疊綜合征(overlap syndrome,OS)指同一患者同時或先后出現兩種或兩種以上的結締組織病(connective tissue diseases,CTD)。CTD主要包括系統性紅斑狼瘡(systemic lupus erythematosus,SLE)、類風濕關節炎(rheumatoid arthritis,RA)、系統性硬化癥(systemic sclerosis,SSc)、多發性肌炎/皮肌炎(polymyositis/dermatomyositis,PDM)和干燥綜合征(sj?gren syndrome,SS)。CTD中的任何兩種或多種疾病都可能重疊,OS中最常見的為PDM合并SLE或SSc,而SSc合并RA者較為少見,且SSc合并其他CTD時可使患者臨床癥狀加重,易導致肺臟、腎臟、心血管系統、消化系統及關節受累[1]。因此,早期明確SSc患者是否合并其他CTD對于治療方案的選擇及患者預后至關重要。我科近年收治了3例SSc合并RA患者,具有部分特征性臨床共性,經檢索文獻發現此類型的OS報道較少。本文結合這3例患者的診治經過并復習國內外文獻,以提高臨床醫生對此類型OS的認識,為SSc合并RA的診斷及治療提供參考。
1 病例簡介
患者1,女,36歲,因“皮膚遇冷變色10年,皮膚緊硬5年”于2010年8月入住我院。患者10年前無誘因出現雙手掌指關節(MCPJ)以遠皮膚遇冷變色,呈變白-變紫-變紅三相反應,未予重視;5年前出現雙手掌指關節以遠皮膚緊硬,不易捏起,指端點狀潰瘍,診斷為SSc,曾口服甲氨蝶呤片5 mg/周、來氟米特片10 mg/d,療效可,后自行停藥致病情復發。既往史無殊。入院查體:面具臉,鼻尖變尖,張口受限;雙手掌指關節以遠皮膚緊硬,不易捏起,局部皮溫減低,雙手指指墊變薄,雙肺底可聞及爆裂音,雙側手近端指間關節(PIPJ)、掌指關節、腕關節有壓痛,雙手近端指間關節屈曲畸形。實驗室檢查:紅細胞沉降率(ESR)46 mm/h(參考值<15 mm/h),C反應蛋白(CRP)8.60 mg/L(參考值<8.00 mg/L),免疫球蛋白A(IgA)4.28 g/L(參考值0.70~4.00 g/L),免疫球蛋白G(IgG)12.10 g/L(參考值7.00~16.00 g/L),免疫球蛋白M(IgM)1.42 g/L(參考值0.40~2.30 g/L);抗核抗體(ANA)1∶100顆粒型;類風濕因子(RF)抗體:IgM-RF>588 U/ml(參考值0~15 U/ml),IgA-RF>300 U/ml(參考值0~15 U/ml),IgG-RF >300 U/ml(參考值0~15 U/ml);抗核周因子(APF)陽性,抗角蛋白抗體(AKA)、抗環瓜氨酸肽(CCP)抗體、抗RA33抗體均陰性。心臟彩超:肺動脈輕度高壓〔肺動脈收縮壓(PASP)=37 mm Hg(1 mm Hg=0.133 kPa)〕。肺CT檢查提示雙肺間質性改變。雙手X線檢查見部分關節間隙變窄,雙手小指關節畸形,關節面鄰近骨質密度減低,部分骨質可見囊狀低密度影(見圖1)。診斷為OS(SSc合并RA)、間質性肺病、肺動脈高壓癥。給予潑尼松片25 mg/d口服,環磷酰胺針0.4 g靜脈滴注,1次/2周,依地酸鈣鈉針1.0 g靜脈滴注,1次/d及對癥治療;經治療后患者病情緩解,復查ESR 23 mm/h,CRP<3.36 mg/L,好轉出院,隨診。
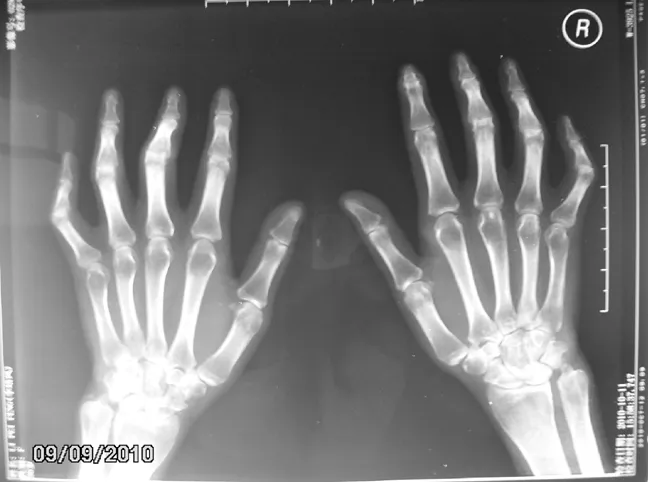
圖1 患者1雙手X線檢查結果
Figure1 Hand X-ray examination of the first patient
患者2,女,56歲,因“皮膚緊硬3年”于2009年7月入住我院。患者3年前無誘因出現皮膚緊硬,累及雙手掌指關節以遠皮膚及顏面,伴有雙手近端指間關節以遠皮膚遇冷變色,呈變白-變紅兩相反應,有疼痛,無腫脹及麻木。曾就診于外院,診斷為SSc,予口服中藥治療效果不理想,為求系統診治而入住我院。既往史:青霉素過敏。入院查體:面具臉,鼻尖變尖,張口受限;雙手掌指關節以遠皮膚緊硬,不易捏起,雙肺可聞及爆裂音,雙手攣縮畸形,雙足第2跖趾騎跨畸形。實驗室檢查:ESR 36 mm/h,CRP<3.36 mg/L,IgA 1.99 g/L,IgG 16.30 g/L,IgM 2.27 g/L;ANA 1∶320核仁型,抗拓撲異構酶抗體(Scl-70抗體)陽性;RF抗體:IgM-RF 233 U/ml,IgA- RF<15 U/ml,IgG-RF<15 U/ml;抗CCP抗體陽性,APF、AKA、抗RA33抗體均陰性。心臟彩超:肺動脈輕度高壓(PASP=42 mm Hg)。肺CT檢查提示雙肺下葉間質性改變。雙手X線檢查見雙手末節指骨部分骨質缺失,周圍軟組織包繞,右手拇指近遠節指骨及左手拇指近遠節指骨、左手示指掌指關節間隙變窄,并見骨質破壞,左手拇指近遠節指骨及示指掌指關節見關節半脫位,雙腕關節骨質見多枚囊性透亮區,雙手骨質密度均減低(見圖2)。診斷為OS(SSc合并RA)、間質性肺病、肺動脈高壓癥。給予潑尼松片25 mg/d口服,環磷酰胺針0.4 g靜脈滴注,1次/2周,依地酸鈣鈉針1.0 g靜脈滴注,1次/d及對癥治療;經治療后患者病情緩解,復查ESR 23 mm/h,CRP<3.36 mg/L,好轉出院,隨診。
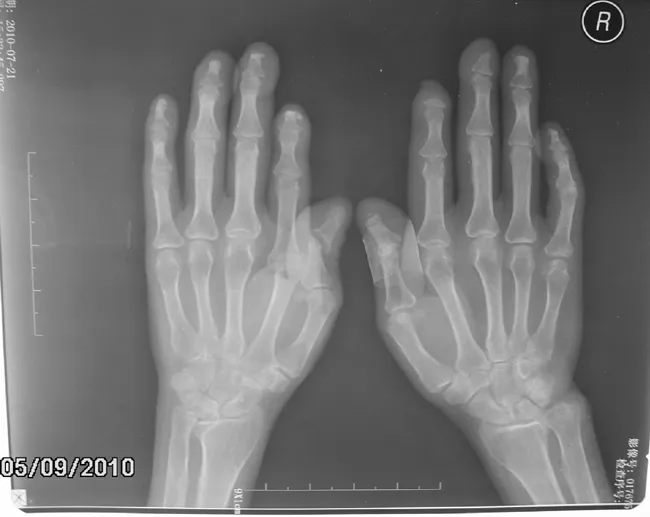
圖2 患者2雙手X線檢查結果
Figure2 Hand X-ray examination of the second patient
患者3,女,55歲,因“雙手遇冷變色20年,皮膚緊硬18年,趾端壞疽3個月”于2010年4月入住我院。患者20年前無誘因出現雙手近端指間關節以遠皮膚遇冷變色,呈變白-變紫-變紅三相反應,伴疼痛,未予重視;18年前上述癥狀加重,并出現雙手掌指關節以遠皮膚緊硬,不易捏起,當時就診于外院診斷為“CTD”,予潑尼松片35 mg/d口服,之后逐漸減量至10 mg/d維持。2010年1月份患者左足第1、3跖趾末端出現破潰、壞死,伴疼痛,自行將潑尼松加量至早15 mg、晚10 mg口服,療效不理想,為求進一步診治而入住我院。既往史無殊。入院查體:面部輕度腫脹,張口受限,雙肺底可聞及爆裂音,雙手近端指間關節以遠皮膚緊硬不易捏起,雙手攣縮畸形,左足第1、3跖趾末端壞疽。實驗室檢查:ESR 23 mm/h,CRP 44.80 mg/L,IgA 2.33 g/L,IgG 6.61 g/L,IgM 1.44 g/L;ANA 1∶320著絲點型,可提取性核抗原(ENA)六項均正常;RF抗體:IgM-RF 84 U/ml,IgA- RF 86 U/ml,IgG-RF 60 U/ml;抗CCP抗體、APF、AKA、抗RA33抗體陽性。心臟彩超:肺動脈輕度高壓(PASP=31 mm Hg)。肺CT檢查提示雙肺下葉間質性改變。雙手X線檢查見雙手關節在位,關節間隙變窄,部分消失,關節面鄰近骨質密度減低,部分骨質可見囊性低密度區(見圖3)。診斷為OS(SSc合并RA)、間質性肺病、肺動脈高壓癥。給予潑尼松片50 mg/d口服,環磷酰胺針0.4 g靜脈滴注,1次/2周,依地酸鈣鈉針1.0 g靜脈滴注,1次/d及對癥治療;經治療后患者病情緩解,復查ESR 11 mm/h,CRP<3.36 mg/L,好轉出院,隨診。
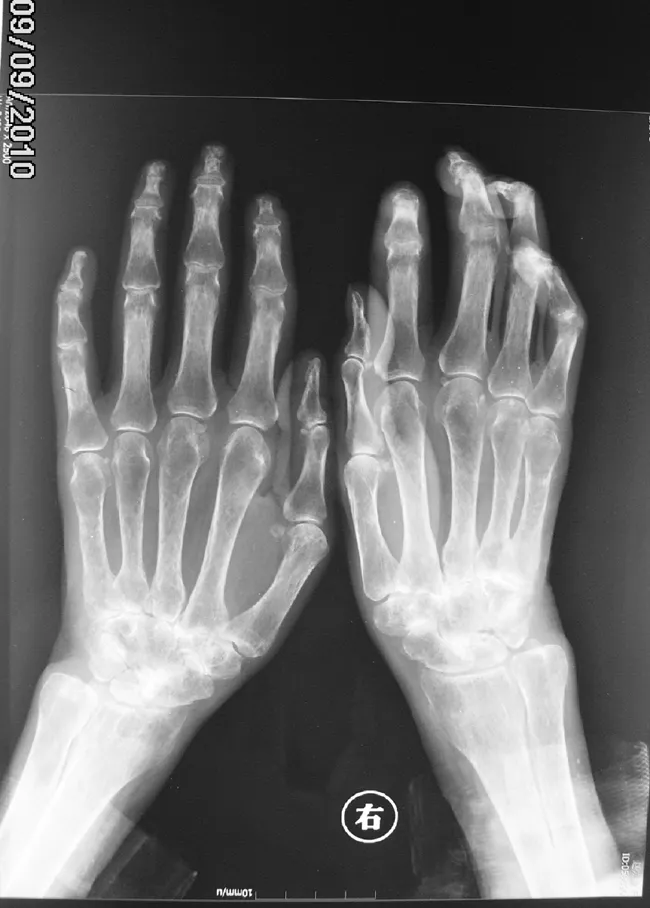
圖3 患者3雙手X線檢查結果
Figure3 Hand X-ray examination of the third patient
2 討論
SSc和RA均是與遺傳和環境等因素有關的自身免疫性疾病,SSc與RA有共同的遺傳基因亞型的表達[2]。RA以關節炎為主要表現,可導致不可逆的關節破壞和嚴重關節功能障礙。SSc雖以血管損害和膠原過度沉著為特征,但關節受累亦較為常見,且可以是SSc的首發癥狀[3],患者可表現為關節痛、關節炎、腱鞘炎,后期可發展為關節攣縮[4]。關節痛是SSc關節受累的特征表現,手關節受累最先出現[5]。SSc出現關節受累的原因可能與皮膚軟組織纖維化、滑膜炎或合并RA有關[5]。因此,對于出現關節受累癥狀或體征的SSc,需鑒別是SSc相關關節受累表現還是合并RA,這需要臨床醫生了解SSc和RA的臨床、血清學及影像學等方面的特征,以做出正確的診斷。
本組3例患者均有雷諾現象、肢端皮膚緊硬、面具臉、鼻尖變尖、張口受限等體征,患者1和患者3有指(趾)端潰瘍,患者1有雙手指指墊變薄,因此,SSc診斷明確;3例患者病程中雖無典型的RA癥狀,但RA標記性抗體陽性并具有RA比較特征性的雙手X線表現,因此,RA診斷明確,OS診斷成立。單純SSc關節受累一般不出現RF抗體陽性,且雙手X線常表現為指端骨質溶解和鈣質沉著,很少發生關節間隙狹窄及骨質囊變或破壞。
歐洲數據庫中登記的SSc患者中,合并RA的發生率為3.6%[1],而我國缺乏此方面的統計數據。自身免疫性疾病以女性好發[6],本組3例患者均為女性,因此,臨床上若遇到女性SSc患者出現關節受累表現,應注意鑒別其是否合并RA,是否為OS。據文獻報道,SSc合并其他CTD時更易出現臟器受累[1],本組3例患者均伴有間質性肺病和肺動脈高壓癥,與文獻報道相符。因此,早期明確SSc患者是否合并其他CTD并給予積極有效的治療,對于防止嚴重和/或不可逆性并發癥具有重要意義。對于SSc合并RA的患者,若能早診斷早治療,可以阻止患者出現不可逆的關節破壞,有助于保證患者生活質量。
本組3例患者雙手X線表現均符合RA改變,且患者1和患者3關節破壞程度較患者2嚴重,進一步分析3例患者的病歷發現,患者1和患者3均有CRP水平升高,而患者2的CRP水平正常。Carrasco等[7]報道,高水平的CRP與關節破壞嚴重程度相關。因此,臨床上對于CRP水平升高的SSc患者,一定要注意其是否有關節受累表現及是否合并RA,早期篩查RA相關項目,以免造成漏診。
單純SSc關節受累最常見的表現是肢端骨質溶解、鈣質沉著和屈曲攣縮,關節間隙狹窄及骨質破壞少見[8],而合并RA者則主要表現為骨質破壞、關節間隙狹窄甚至融合,幾乎不會出現肢端骨質溶解。本組3例患者經雙手X線檢查發現,除肢端骨質溶解外,還可見關節間隙狹窄和骨質囊狀侵蝕破壞,患者1和患者3還見到腕關節的融合,這些都是RA典型的關節受累表現。因此,X線檢查有助于鑒別SSc合并RA與單純SSc關節受累。但部分SSc患者早期即有明顯的關節受累表現,而手部X線檢查卻為陰性,此時需進行手部MRI檢查。雖然X線檢查對骨的顯像較為敏感,但對早期軟骨及骨質破壞的檢出率僅為MRI的10%~15%。研究表明,SSc相關的關節病,手部MRI主要表現為小血管炎(手指小血管壁毛糙、顯影較淡或不顯影)、周圍組織炎癥(包括腱鞘炎)[9],而無骨髓水腫或骨侵蝕表現[10];若合并RA,則早期手部MRI除了周圍組織炎癥表現外,還有滑膜炎、滑膜增生、骨髓水腫、軟骨及骨質破壞表現[11]。Chitale等[10]報道,手部超聲檢查對OS的鑒別診斷亦有幫助,但敏感度和特異度較MRI差。
Zimmermann等[12]報道,ANA的核仁型(ATA)和著絲點型(ACA)是與SSc相關的典型的ANA核型,但SSc合并RA患者的ANA核型尚不確定。本組3例患者ANA均為陽性,其中患者1為斑點型,患者2為核仁型(ATA),患者3為著絲點型(ACA)。因此,ANA核型能否作為診斷SSc合并RA的依據仍需進一步研究驗證。Zimmermann等[12]還認為SSc合并RA患者可同時出現ACA和hnRNP-A2/RA33抗體的陽性。
SSc合并RA患者中約有50%會出現RF抗體陽性,且RF抗體滴度與SSc合并RA的診斷無關[13];SSc患者抗CCP抗體陽性率約為9.1%[14],且其滴度水平在SSc合并RA患者中較單純SSc關節受累患者明顯升高,而幾乎所有存在高滴度抗CCP抗體的SSc合并RA患者均合并間質性肺病[15]。因此,RF抗體和抗CCP抗體可作為鑒別SSc合并RA與單純SSc關節受累的可靠指標[5]。本組3例患者RF抗體全部或部分陽性且均合并間質性肺病,患者2和患者3抗CCP抗體均為陽性。對于SSc合并RA,除了RF抗體和抗CCP抗體,其他與RA相關的自身抗體亦可幫助診斷RA[5],APF、AKA及hnRNP-A2/RA33抗體都是診斷RA的標記性抗體[7]。本組患者1和患者3的APF陽性,患者3的AKA及hnRNP-A2/RA33抗體陽性。但目前國內外關于APF、AKA對SSc合并RA的診斷價值研究報道較少。Zimmermann等[12]報道,單純SSc關節受累患者hnRNP-A2/RA33抗體也可出現陽性,但其陽性率要遠低于RA或SSc合并RA患者。
治療方面,目前尚無新的SSc合并RA治療方案,其治療主要依據RA治療方案,甲氨蝶呤、來氟米特及環孢素均可選擇應用[4]。對于合并間質性肺病患者,糖皮質激素聯合免疫抑制劑治療是有效的[16],且臨床建議免疫抑制劑首選環磷酰胺。此外,生物制劑TNF-α拮抗劑亦可作為SSc合并RA及單純SSc的治療方案[4];Elhai等[17]報道,用于治療RA的托珠單抗注射液或阿巴他塞注射液治療SSc合并RA或SSc合并多關節炎患者也是安全和有效的。本組3例患者均給予糖皮質激素聯合環磷酰胺治療,效果良好,有利于降低患者ESR、CRP等,及時控制了病情進展。
綜上所述,OS中SSc合并RA較為少見,臨床醫生對其關注較少,本文通過分析3例SSc合并RA患者的診治經過并復習文獻,希望借以提高臨床醫生對該病的重視,加深了解。臨床上對于無典型關節癥狀的SSc患者,要積極篩查RF抗體、抗CCP抗體等免疫學指標,而對于有關節癥狀的SSc患者,除血清免疫學檢查外,還要進行雙手及腕關節的影像學檢查,必要時行MRI檢查,以早期診斷早期治療,避免嚴重和/或不可逆性并發癥的發生。
1 Balbir-Gurman A,Braun-Moscovici Y.Scleroderma overlap syndrome[J].Isr Med Assoc J,2011,13(1):14-20.
2 Agarwal SK,Reveille J.The genetics of scleroderma(systemic sclerosis)[J].Curr Opin Rheumatol,2010,22(2):133-138.
3 Generini S,Steiner G,Miniati I,et al.Anti-hnRNP and other autoantibodies in systemic sclerosis with joint involvement[J].Rheumatology(Oxford),2009,48(8):920-925.
4 Avouac J,Clements PJ,Khanna D,et al.Articular involvement in systemic sclerosis[J].Rheumatology(Oxford),2012,51(8):1347-1356.
5 Arslan Tas D,Erken E,Sakalli H,et al.Evaluating hand in systemic sclerosis[J].Rheumatol Int,2012,32(11):3581-3586.
6 Oliver JE,Silman AJ.Why are women predisposed to autoimmune rheumatic diseases?[J].Arthritis Res Ther,2009,11(5):252.
7 Carrasco R,Barton A.Biomarkers of outcome in rheumatoid arthritis[J].Rheumatology Reports,2010,2(1):26-38.
8 Koutaissoff S,Vanthuyne M,Smith V,et al.Hand radiological damage in systemic sclerosis:comparison with a control group and clinical and functional correlations[J].Semin Arthritis Rheum,2011,40(5):455-460.
9 許建榮,鄭霞.磁共振成像在早期風濕病骨關節病的診斷價值[J].磁共振成像,2011,2(2):81-84.
10 Chitale S,Ciapetti A,Hodgson R,et al.Magnetic resonance imaging and musculoskeletal ultrasonography detect and characterize covert inflammatory arthropathy in systemic sclerosis patients with arthralgia[J].Rheumatology(Oxford),2010,49(12):2357-2361.
11 鄧霞,許建榮,路青,等.磁共振成像在早期類風濕性關節炎診斷中的價值[J].磁共振成像,2011,2(2):95-98.
12 Zimmermann C,Steiner G,Skriner K,et al.The concurrence of rheumatoid arthritis and limited systemic sclerosis:clinical and serologic characteristics of an overlap syndrome[J].Arthritis Rheum,1998,41(11):1938-1945.
13 Pakozdi A,Nihtyanova S,Moinzadeh P,et al.Clinical and serological hallmarks of systemic sclerosis overlap syndromes[J].J Rheumatol,2011,38(11):2406-2409.
14 Yin G,Cen XM,Yang M,et al.Detecting anti-cyclic citrullinated peptide antibody in patients with connective tissue diseases[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2011,42(3):374-377.
15 Morita Y,Muro Y,Sugiura K,et al.Anti-cyclic citrullinated peptide antibody in systemic sclerosis[J].Clin Exp Rheumatol,2008,26(4):542-547.
16 Gutsche M,Rosen GD,Swigris JJ.Connective Tissue Disease-associated Interstitial Lung Disease:A review[J].Curr Respir Care Rep,2012(1):224-232.
17 Elhai M,Meunier M,Matucci-Cerinic M,et al.Outcomes of patients with systemic sclerosis-associated polyarthritis and myopathy treated with tocilizumab or abatacept:a EUSTAR observational study[J].Ann Rheum Dis,2013,72(7):1217-1220.

