副溶血弧菌膠體金檢測試紙條的改進
王報貴,王廣峰,武曉麗,董素琴,明 星,魏 華,徐 鋒,*
(1.南昌大學生命科學與食品工程學院中德聯合研究院,江西南昌330047;2.菏澤學院園林工程系,山東菏澤274000;3.江西中醫學院基礎醫學部,江西南昌330004)
副溶血弧菌是一種能夠引起急性腸胃炎且廣泛存在的食源性致病菌,主要存在于海水、水生生物及海底沉淀物中,其特點是在高鹽的環境中才能生長。所以該菌引起的食物中毒主要爆發于沿海地帶,由于從業人員衛生意識薄弱,使食品之間因交叉污染和再次污染所引起的食物中毒的現象經常發生[1-2]。目前副溶血弧菌所引起的微生物性食物中毒、發生規模及人群暴露規模呈明顯上升趨勢,現已成為我國首要的食源性致病菌[3]。為了提高人們對副溶血弧菌的重視程度,降低食源性疾病的風險,建立一種快速、簡便檢測方法對及時控制副溶血弧菌食源性疾病具有重要意義。
針對于副溶血弧菌傳統的檢測方法,包括:生理生化實驗、分子生物學檢測、酶聯免疫吸附法。目前最廣泛的定量檢測方法為最大可能數方法,不僅費時費力,而且操作復雜且靈敏度有限[4]。而以PCR[5]及ELISA為基礎的檢測方法,不僅需要專業的技術研究人員,嚴格的檢測環境而且設備價格昂貴[6]。免疫膠體金層析技術近幾年來在生物醫學各領域中得到了日益廣泛的應用,具有方便快捷、特異敏感、穩定性強、不需要特殊設備和試劑、結果判斷直觀等優點,但常規免疫膠體金層析技術顯色強度具有一定的局限性,不利于肉眼對陽性信號的判斷。本實驗為了對副溶血弧菌進行快速準確的檢測,降低疾病發生范圍和危害,在常規試紙條免疫反應的基礎上,首次利用金標二抗增強副溶血弧菌試紙條的顯色強度,15m in檢測結果即達到穩定,滿足了非專業人員在現場快速檢測的要求。
1 材料與方法
1.1 材料與儀器
副溶血弧菌單抗 購自上海慧耘生物技術有限公司;弗氏佐劑、K2CO3、BSA、氯金酸(HAuCl4)、檸檬酸鈉 購自美國Sigma公司;二抗(羊抗鼠、羊抗兔、驢抗鼠)、TMB顯色液、LB培養基、MRS培養基 購自北京中杉金橋生物技術有限公司;副溶血弧菌顯色培養基 購自廣東環凱微生物技術有限公司;健康日本大耳朵白兔(雌性) 購自南昌實驗動物中心;新鮮活魚 購自南昌市周圍超市;濾紙、樣品墊、膠金墊、NC膜、吸水紙、PVC底板、PNPB重懸液復溶液 中德伯爾生物技術有限公司提供;副溶血弧菌(ATCC 17802)、副溶血弧菌(CMCC 1.1616)、副溶血弧菌(CMCC 1.997)、副溶血弧菌(PVPA 0125)、霍亂弧菌(ATCC 14035)、霍亂弧菌(ATCC27562)、阪崎腸桿菌(ATCC 51329)、阪崎腸桿菌(CMCC 45402)、鼠傷寒沙門氏菌(ATCC 13311)、福氏志賀氏菌(ATCC 29903)、粉塵腸桿菌(PESA5)、單核增生李斯特(ATCC 19115)、大腸桿菌O157∶H 7(EDC)、腸致病性大腸桿菌(CMCC 44496)、鼠傷寒沙門氏菌(ATCC 13311)、陰溝腸桿菌(CMCC 45301)、白假絲酵母(Z1)、藤黃微球菌(CMCC 28003)、短雙岐桿菌(WBBR 04)、長雙歧桿菌(WBLO 01)、青春雙岐桿菌(WBAD 08)、動物雙歧桿菌(WBBR 05)、乳雙歧桿菌(WLABO 9)、嬰兒雙岐桿菌(WBAN 07)、兩歧雙歧桿菌(WBBI 01)、唾液乳桿菌(ATCC 11741)、德式乳桿菌(ATCC 9649)、鼠李糖乳桿菌(ATCC 7469)、嗜酸乳桿菌(ATCC 4356)、保加利亞乳桿菌(WLAB 02)、植物乳桿菌(ATCC 8014) 共30株菌株等均為實驗室保存,用20%的甘油保菌,-80℃保存。
BIO-DOT XYZ-3050點噴系統、M illi-Q水處理系統、HGS-201可編程切條機、ZX-6090B真空干燥箱、卡殼、HG-8膠體金試紙條讀取儀 江西中德生物工程有限公司提供;超聲破碎儀 浙江新芝生物科技公司;DNM 9026全自動酶標儀 北京普朗新技術有限公司。
1.2 實驗方法
1.2.1 菌株生長條件 副溶血弧菌采用含有3.5% NaCl的Luria-Bertani(LB)高鹽液體培養基,35℃過夜,其他所用菌株采用LB或MRS液體培養基進行常規培養,所有菌株用PBS洗滌經甲醛滅活后,-20℃保存備用。
1.2.2 多克隆抗體的制備 副溶血弧菌免疫日本大耳朵兔獲得兔抗副溶血弧菌的多克隆抗體[7]。采用間接ELISA方法測定多抗血清效價[8]。采用斑點雜交檢測多抗血清及鼠單抗的特異性,以便于觀察是否與其他雜菌具有交叉反應。
1.2.3 多克隆抗體的純化 本實驗參照[9-10]等方法,采用辛酸硫酸銨沉淀和菌體逆向吸附法除去雜蛋白及非特異性的抗體,已獲得特異性針對副溶血弧菌的兔多抗,但與金黃色葡萄球菌有一定的交叉反應[11]。
1.2.4 多克隆抗體與單克隆抗體的配對實驗 采用雙抗夾心ELISA進行抗體的配對實驗[12]。捕獲抗體的包被:純化的多克隆抗體,從400倍開始稀釋,100μL/孔,設無捕獲抗體空白對照,37℃反應1h。用PBST洗滌3次后,用3%的BSA于37℃封閉1h,再用PBST洗滌3次后加入抗原(108CFU/m L)100μL/孔反應1h,設無抗原對照孔,洗滌去除多余抗原后,加入購買的單克隆抗體,從200倍開始稀釋,設無檢測抗體對照孔,37℃溫育1h,PBST洗滌3次后加入經5000倍稀釋的酶標羊抗鼠的IgG,100μL/孔,37℃溫育30m in后,用PBST洗滌干凈,加入顯色液,100μL/孔,37℃溫育15min后,加入10%的H2SO4,50μL/孔,終止顯色,于450nm下測定OD值。本實驗中設無捕獲抗體、無檢測抗體和無抗原孔作為陰性對照孔,排除假陽性的干擾。
1.2.5 膠體金的制備 膠體金的制備采用檸檬酸三鈉還原法[13]。將100m L 0.01%的HAuCl4溶液加熱煮沸,立即加入1.2m L 1%的檸檬酸三鈉溶液,并不斷攪拌,溶液的顏色由淺黃-藍色-深藍-紅色依次變化,當溶液的顏色完全變為透明的紅色時,停止加熱,冷卻至室溫,4℃保存。
1.2.6 免疫膠體金的標記 將1個干凈的小燒杯加入2m L膠體金,用48μL的0.2mol/L的K2CO3溶液將pH調整為8.0。緩慢滴加200μL單抗或羊抗鼠的二抗,使終濃度分別為25μg/m L,磁力攪拌并避光反應1h后緩慢加入10%BSA使終濃度1%,常溫下避光攪拌封閉1h。4℃8000r/min轉離心30min,棄上清,沉淀用含0.4%Tween-20的PNPB重懸液復溶,重懸液的用量為標記時膠體金體積的1/10,于4℃保存一周觀察標記膠體金的穩定性。
1.2.7 免疫層析紙條的制備 硝酸纖維素膜(CN140,檢測帶為1.5mg/m L的兔多抗,質控線為1.0mg/m L驢抗鼠IgG)、吸水墊,依次固定于PVC底板上,切割成4mm的條子,組裝成卡,用放入干燥劑的薄膜包裝,封口,備用。
1.2.8 免疫膠體金標記的檢測 將80μL的106CFU/m L副溶血弧菌菌液(實驗組)及PBS(對照組)分別加入到2個組裝好的試紙條(標記為0和1)中進行層析,5m in后在標記為1的試紙條樣品墊上加入4μL的羊抗鼠標記的膠體金,再加入80μL的PBS進行層析。2m in后由膠體金讀卡儀每隔30s讀取試紙條T線、C線吸光值以及T/C比值,連續監控30m in。以反應時間為橫坐標,T線、C線吸光值以及T/C比值為縱坐標繪制試紙條免疫動力學曲線,檢測加入羊抗鼠標記的膠體金是否提高顯色效果及確定試紙條定量檢測的最佳時間。檢測線與質控線均有條帶為陽性,僅質控線顯色為陰性,如質控線無條帶,說明試紙條失效[14]。
1.2.9 免疫層析試紙條靈敏性的檢測 副溶血弧菌純培養物,用PBS稀釋成不同的濃度(108、107、106、105CFU/m L),備用。將80μL不同梯度的副溶血菌液滴入加樣孔中,15m in后進行檢測。增強顯色實驗,將80μL不同梯度的副溶血菌液滴入加樣孔中,5min后在加樣孔加入4μL的羊抗鼠標記的膠體金,再加入80μL的PBS,根據1.2.8所確定的最佳時間,用膠體金讀卡儀進行顯色強度的測定。
1.2.10 食品中試紙條靈敏度的檢測 取魚肉樣品,碾磨成糜,經2層濾紙過濾后,取濾液混入阪崎腸桿菌與志賀氏菌至終濃度為108CFU/g后,然后摻入不同稀釋度的副溶血弧菌于混入阪崎腸桿菌與志賀氏菌的濾液中,至終濃度為108、107、106、105CFU/g,分別取80μL加入到制備好的試紙條加樣孔中,進行增強顯色實驗后進行結果的觀察。
1.2.11 免疫層系試紙條的異性的檢測 以副溶血弧菌為陽性對照,材料中各菌株為陰性對照,進行試紙條的特異性檢測。調整各菌液的濃度為108CFU/m L,取將80μL各菌液滴入加樣孔中,15m in后進行檢測。1.2.12 檢出率的測定 將副溶血弧菌按照1.2.9的方法隨機混入含108CFU/g阪崎腸桿菌、志賀氏菌的魚肉樣本,共接種80份樣品。同時設定用無菌的PBS代替副溶血弧菌的陰性對照組20份。按照前述方法進行副溶血弧菌檢出率的測定。
2 結果與討論
2.1 實驗原理圖
實驗原理如圖1所示,當加入檢測物后,隨著免疫層析的進行,目標菌與金標墊上偶聯膠體金的鼠單抗發生特異性結合形成抗原抗體復合物,被檢測線上的抗體捕獲,從而使檢測線顯色,而過量的膠體金偶聯的鼠單抗被質控線上的驢抗鼠的二抗捕獲從而使質控線顯色。當加入偶聯膠體金的羊抗鼠二抗時,被已經在檢測線捕獲的鼠單抗結合形成偶聯物,從而進一步提高顯色強度,有利于陽性結果的判斷。
2.2 多克隆抗體和單克隆抗體配對
通過間接ELISA對抗體效價的檢測得出:兔多抗的效價為100萬[11],鼠單抗的效價為32萬。說明單抗、多抗均具有較高的效價。由表1雙抗夾心ELISA的配對實驗可以看出:在捕獲抗體稀釋12800倍,檢測抗體稀釋5400倍時,仍具有較高的OD值(OD值>0.45)且陰性對照組OD值均小于0.1,說明購買的單抗與制備的兔多抗配對成功,可以用于制備膠體金試紙條。
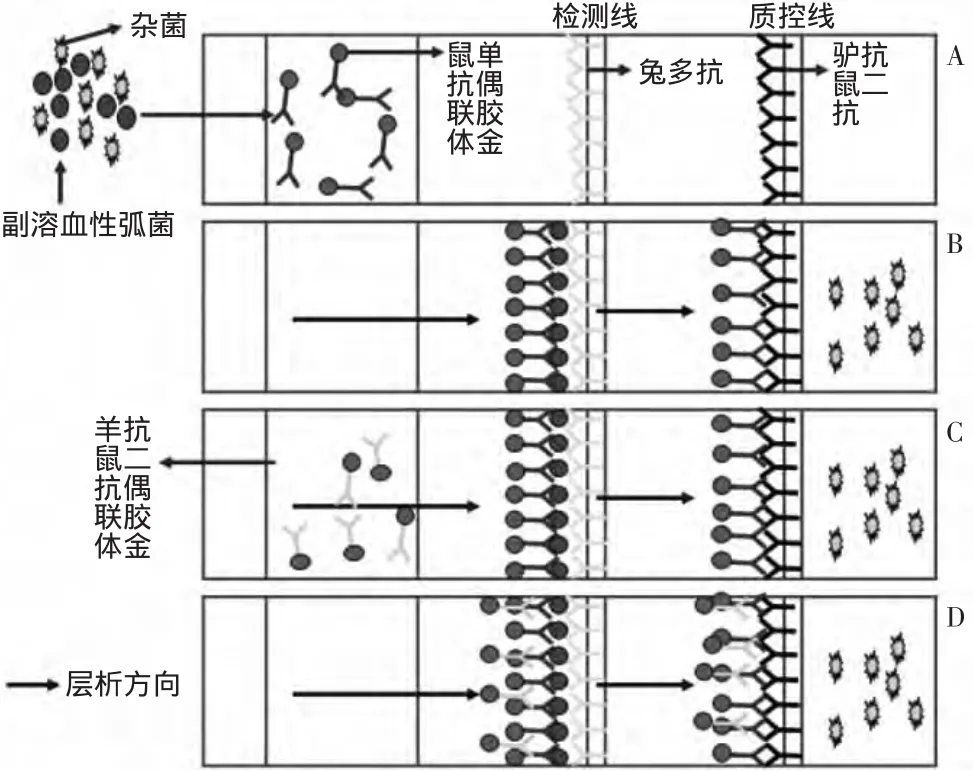
圖1 試紙條原理圖Fig.1 Test-strip diagram
2.3 試紙條檢測結果
偶聯的膠體金放于4℃一周未發現死金現象,說明偶聯的膠體金具有很好的穩定性。T、C線吸光度比值(T/C比值法)在一定程度上可有效地消除內在因素(環境溫度、不同試紙條的加工差異、樣品中基質效應)的干擾,實現試紙條的定量檢測。
本實驗實時記錄了30m in內試紙條T線、C線的顯色強度的變化,結果如圖2所示,T線、C線吸光值25m in后進入穩定期(圖2-A,圖2-B),而T/C比值僅需15m in即可進入穩定(圖2-C)。從圖2可以看出,加入羊抗鼠二抗偶聯的膠體金可明顯的提高T線的顯色強度,但對C線及T/C比值影響較小。
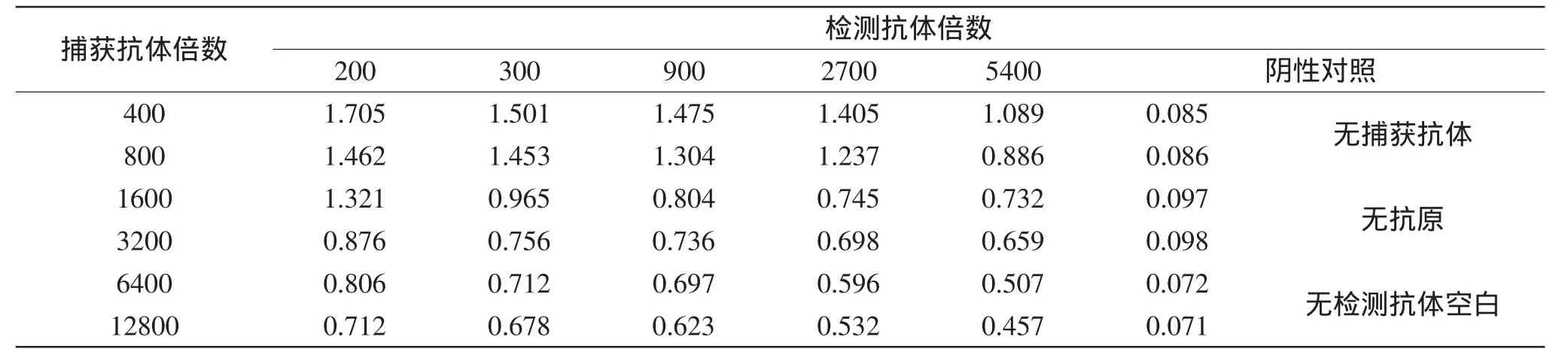
表1 多克隆抗體與單克隆抗體雙抗夾心ELISA結果Table1 Resultof double-antibody sandwich ELISA
從圖3對106CFU/m L的副溶血弧菌的檢測實驗可以看出:加入羊抗鼠二抗偶聯的膠體金能將顯色強度提高5倍,有利于肉眼進行觀察,更準確的對陽性信號加以判斷,同時由對照組(PBS組)可以看出加入羊抗鼠二抗偶聯的膠體金不會產生非特異性的反應而引起假陽性,說明了該方法的可行性。因此下面的實驗均采用該方法進行實驗。
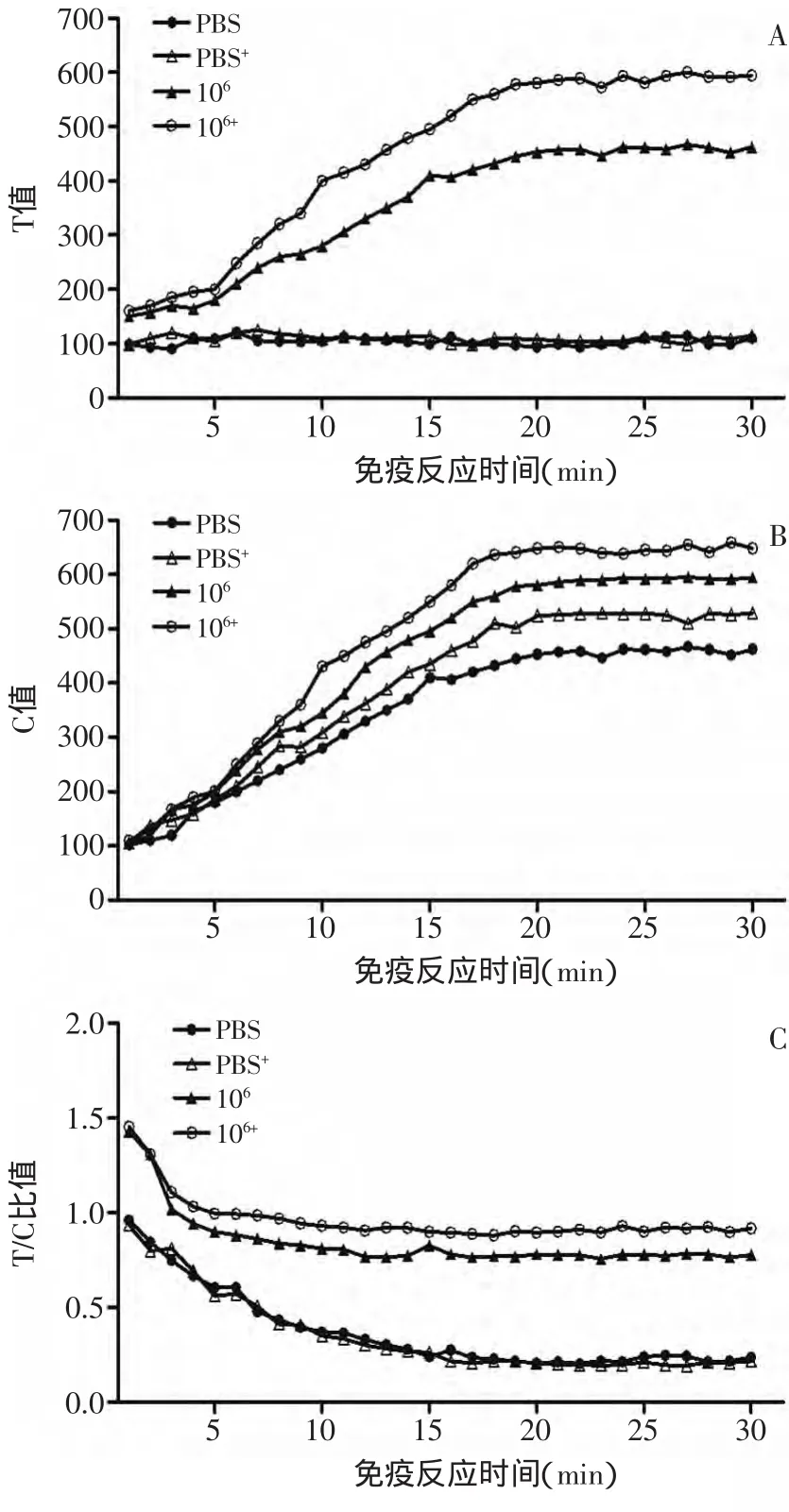
圖2 膠體金試紙條免疫動力學曲線Fig.2 The immune kinetic reaction curve of colloidal gold test strip

圖3 免疫層析試紙條檢測結果Fig.3 Detection results of Vibrio parahemolyticusis by using the strip test
2.4 免疫層析試紙條靈敏性的檢測
將80μL不同稀釋度的副溶血弧菌純培養物滴入加樣孔中,待樣品層析完畢后觀察檢測結果。如圖4所示,用肉眼可以觀測到檢測限為106CFU/m L。

圖4 不同濃度副溶血性弧純培養菌膠體金免疫層析試紙條檢測結果Fig.4 Detection results of the strip test for Vibrio parahemolyticusis samples at different concentrations
2.5 食品中試紙條靈敏度的檢測
為了模擬實際樣本的檢測效果,驗證在魚肉糜樣本的檢測中,檢測限是否會受到食品基質和雜菌的影響。本實驗通過人工添加副溶血弧菌到含阪崎腸桿菌、志賀氏菌的魚肉糜樣本測定最低檢出限。實驗結果表明,在魚肉糜樣本的模擬檢測中,最低檢測限均為107CFU/g,如圖5所示。比在純培養物樣本中的檢測限要高(見圖4),可能是由于魚肉糜樣本成分的復雜對檢測限有一定的影響,但高濃度雜菌不影響該方法的特異性。

圖5 魚肉糜樣品中副溶血弧菌膠體金免疫層析試紙條檢測結果Fig.5 Detection results of the strip test for Vibrio parahemolyticusis in fish paste samples
2.6 試紙條特異性的檢測
以副溶血弧菌(ATCC 17802)為陽性對照,材料中各菌的菌液分別取80μL用膠體金試紙條進行檢測。結果如圖6所示,副溶血弧菌不同菌株檢測后試紙條的T、C線均顯色,結果為陽性。各常見菌株及PBS空白組只有C線顯色,結果為陰性,如表2所示。結果說明改進的膠體金試紙條能對不同的副溶血性弧菌檢測成陽性結果,但對相近種屬的霍亂弧菌及其他常見菌株均無交叉反應,表明該方法制備的膠體金試紙條較高的特異性。

表2 副溶血弧菌膠體金免疫層系試紙條特異性檢測結果Table2 Specificity of the strip test in detection of Vibrio parahemolyticusis

圖6 3株不同副溶血性弧菌膠體金免疫層析試紙條檢測結果Fig.6 Detection results of the strip test for three different Vibrio parahemolyticusis
2.7 模擬實際樣本的檢出測定
模擬實際樣本檢測的結果在80個陽性樣本中有79份顯示陽性,檢出率為98.7%,在陰性對照組中均未檢出,說明該方法可用于實際樣品的檢測。
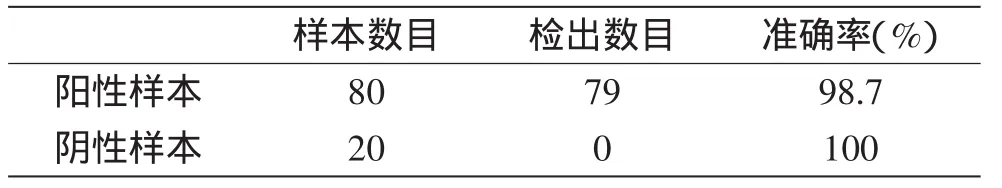
表3 模擬實際樣本的檢出測定Table3 Determination of actual sample
3 結論與討論
免疫膠體金層析技術是繼免疫熒光、酶免疫和放射免疫后發展的一種新技術,因具有操作簡單,檢測速度快,樣品不需要特殊處理及不需借助復雜設備僅用肉眼就能判斷結果等優點,特別適用于野外及實驗條件不具備的場所使用[15],現已經在醫學檢測和診斷方面得到廣泛應用[16]。
試紙條的靈敏度、特異性與所用的捕獲抗體與檢測抗體具有直接的關系,當抗體的特異性好時,實驗結果具有較好的靈敏性與特異性。本實驗所用的單抗較好的特異性相關,所以膠體金標記的單抗對常見的一些菌株均沒有交叉反應的現象。在副溶血弧菌試紙條檢測中,為了進一步提高檢測的靈敏度,本研究在常規試紙條免疫反應的基礎上,利用羊抗鼠的抗體能與鼠單抗特異性免疫結合,而與兔多抗不結合的原理,進行免疫試紙條的檢測。當檢測線上的兔多抗捕獲到抗原抗體復合物時,即能與膠體金標記的羊抗鼠的二抗免疫結合,從而使更多的膠體金在檢測線上得到聚集,提高了顯色強度,有利于肉眼進行觀察。當檢測線上未捕獲到鼠單抗時,即不能與膠體金標記的羊抗鼠的二抗免疫結合,因此不會改變試紙條的特異性。加入膠體金標記的羊抗鼠的二抗時,能明顯的提高檢測限的顯色強度,方便了結果的判斷。由于在周邊超市所購買的魚肉樣本中副溶血弧菌均未檢出,所以實驗中采用添加菌到魚肉糜樣本中模擬實際樣品。實驗中檢測模擬樣品時出現1例假陰性可能的原因:溫度的影響,溫度過低反應速度降低,從而使弱陽性不能完全顯示出來;灰塵、風的影響,灰塵落在試紙條上及風吹影響樣品的擴散速度,導致結果不能正常觀察。本實驗中,在對純培養物及魚肉糜樣本中的檢測限分別為106CFU/m L和107CFU/g,且高濃度雜菌的存在不影響檢測靈敏度和特異性。
實驗結果表明,副溶血弧菌膠體金免疫層系試紙條具有較好的特異性及靈敏度,結合試紙條在15m in內就可以完成快速檢測的優點,說明該試紙條比酶聯免疫技術、PCR技術具有更廣泛的適用范圍,對常見細菌性食物中毒的初篩具有重要意義。
[1]林秋云,曾樹權,尹映華,等.一起副溶血性弧菌引起食物中毒的實驗室檢測[J].中國微生態學雜志,2012,24(2):178-180.
[2]丁建華,周壽榮.一起副溶血弧菌引起的學生集體食物中毒[J].中國校醫,2004,18(12):155-157.
[3]劉秀梅.食源性疾病監控技術的研究[J].中國食品衛生雜志,2004,16(1):3-9.
[4]Habib I,Sampers I,Uyttendaele M,et al.Performance characteristics and estimation of measurement uncertainty of three plating procedures for Campylobacter enumeration in chickenmeat[J].Food Microbiology,2008,25(1):65-74.
[5]Lehmann LE,Hunfeld K-P,Emrich T,et al.A multiplex real-time PCR assay for rapid detection and differentiation of 25 bacterial and fungal pathogens from whole blood samples[J].MedicalMicrobiology and Immunology,2008,197(3):313-324.
[6]Madi M,Hamilton A,Squirrell D,et al.Rapid detection of foot-and-mouth disease virus using a field-portable nucleic acid extraction and real-time PCR amplification platform[J].The Veterinary Journal,2012,193(1):67-72.
[7]鄭晶,申洪.創傷弧菌溶細胞毒素及金屬蛋白酶的基因克隆,蛋白表達,抗體制備及其致病性研究[D].廣州:南方醫科大學,2008.
[8]王謙.抗鏈霉素單克隆抗體制備與ELISA方法的建立[D].北京:中國農業大學,2003.
[9]Perosa F,Carbone R,Ferrone S,et al.Purification of human immunoglobulins by sequential precipitation with caprylic acid and ammonium sulphate[J].Journal of Immunological Methods,1990,128(1):9-16.
[10]張燕欣,趙云英,李富桂.應用辛酸硫酸銨法提純兔抗雞傳染性法氏囊病IgG抗體[J].黑龍江畜牧獸醫,2013(1):106-108.
[11]王報貴,武曉麗,董素琴,等.副溶血弧菌的磁珠捕獲及檢測[J].食品工業科技,2013,34(13):147-152.
[12]黃嶺芳.快速檢測大腸桿菌O157∶H7膠體金免疫層析方法的建立[D].南昌:南昌大學,2011.
[13]宋宏新,符海英,薛海燕,等.兩種膠體金制備方法的比較研究[J].河南工業大學學報:自然科學版,2012,33(1):53-56.
[14]Banchongaksorn T,Hurtado A JC,Chauhan V,etal.A rapid dipstick antigen capture assay for the diagnosis of falciparum malaria[J].Bulletin of the World Health Organization,1996,74(1):47-54.
[15]王振東,姜超,楊宇,等.貝氏柯克斯體重組抗原P1表達純化及膠體金免疫層析方法的建立[J].中國媒介生物學及控制雜志,2012,23(4):285-288.
[16]曾小軍,陳紅根,袁建華,等.快速膠體金免疫層析法的建立及其對血吸蟲病的診斷效果[J].中國血吸蟲病防治雜志,2005,17(1):24-27.

