TAT-tCNTF對CD損傷細胞的作用機制研究
張 宏,張 琴,劉澤源,徐亞飛,曲恒燕(軍事醫學科學院附屬醫院,北京 100071)
·實驗研究·
TAT-tCNTF對CD損傷細胞的作用機制研究
張 宏,張 琴,劉澤源,徐亞飛,曲恒燕(軍事醫學科學院附屬醫院,北京 100071)
目的:探討TAT-tCNTF對細胞松弛素D(CD)導致的人臍靜脈內皮細胞株(HUVECs)損傷的作用機制。方法:TAT-tCNTF處理經CD損傷的細胞,CCK-8法檢測其對細胞活力的影響;熒光顯微鏡觀察羅丹明-鬼筆環肽標記的F-actin的變化;熒光顯微鏡和流式細胞術(FCM)檢測細胞內Fluo 4-AM標記的Ca2+濃度變化;Western blot檢測F-actin蛋白水平變化。結果:10 μmol·L-1CD降低HUVECs的細胞活動度(P < 0.000 1),而10 μg·mL-1的TAT-tCNTF明顯升高HUVECs的細胞活動度(P = 0.003);熒光顯微鏡下觀察到CD作用后的細胞F-actin斷裂且分布減少,而TAT-tCNTF可改善這一現象;TAT-tCNTF可降低由CD引起的細胞內Ca2+超載;FCM顯示CD組Ca2+熒光強度(MFI)較對照組增強,而(CD + TAT-tCNTF)組的MFI較CD組減弱。Western blot結果顯示各組F-actin表達量無明顯差異。結論:TAT-tCNTF對CD引起的細胞損傷有改善作用,其機制與維持細胞骨架結構和緩解細胞內Ca2+超載有關。
TAT-tCNTF;細胞松弛素D;F-actin;Ca2+超載
睫狀神經營養因子(ciliary neurotrophic factor,CNTF)支持營養神經元并修復受損的神經元[1-2],增加肌纖維細胞的數量[3]。但其本身透膜能力較差,難以通過細胞膜進入細胞內發揮生物學功能。人類免疫缺陷病毒-1的反義激活轉錄(trans-activator transcription,TAT)蛋白片段是有效的蛋白轉導域,能攜帶外源性蛋白質進入細胞[4]。本實驗室將TAT與截短式的CNTF(truncated CNTF)的基因序列進行重組表達,獲得融合蛋白TAT-tCNTF。前期實驗證明其活性與CNTF基本一致[5],但TAT-tCNTF進入細胞的機制并不清楚。TAT主要是以巨胞飲方式穿過細胞膜[6],故采用巨胞飲抑制劑CD研究TAT-tCNTF的透膜機制。本實驗著重研究CD對細胞活力、構成微絲的纖維狀肌動蛋白( fi lamentous actin,F-actin)及支撐其運動的Ca2+的變化,進而考察TAT-tCNTF對CD所致內皮細胞損傷的作用和機制。
1 材料和方法
1.1 儀器
iMark全自動酶標儀(美國Bio-Rad公司),熒光顯微鏡-Axio Observer A1(德國Zeiss公司),流式細胞儀(Becton Dickinson公司)。
1.2 藥物與試劑
TAT-tCNTF(本實驗室制備),細胞松弛素D(Calbiochem公司),胎牛血清(杭州四季青生物工程材料有限公司),DMEM培養基(HyClone公司),CCK-8試劑(日本株式會社同仁化學研究所),羅丹明-鬼筆環肽(Cytoskeleton公司),DAPI(MP公司),Fluo 4-AM(日本株式會社同仁化學研究所),F-actin抗體(北京博奧森生物技術有限公司),GAPDH抗體(Sigma公司)。
1.3 實驗細胞
人臍靜脈內皮細胞株(human umbilical vein endothelial cells,HUVECs)由本實驗室保存提供。
1.4 細胞培養
HUVECs培養于含10%胎牛血清的DMEM高糖培養液中,置于5% CO2、37 ℃、飽和濕度的培養箱中,隔天傳代。
1.5 CCK-8法檢測細胞活動度
總的來說,教學內容的實踐也是小學數學教學中一大重點板塊之一,對于提高學生的學習興趣和學習積極性都有著十分重要的正面影響作用,需要在實際教學過程中給予重視。
取對數生長期細胞,以5×105個·mL-1的懸液種植于96孔板。實驗分組為對照組、CD組、CD+TAT-tCNTF組和TAT-tCNTF組,并設立空白組。細胞加入10 μmol·L-1的CD孵育30 min,洗滌之后加入10 μg·mL-1的TAT-tCNTF孵育24 h。加入CCK-8溶液孵育2 h,在450 nm波長處測定吸光度值(A450)。細胞活動度 = A450(試驗組-空白組)/A450(對照組-空白組)×100%。
1.6 羅丹明-鬼筆環肽標記觀察F-actin
將種植于24孔板的HUVECs經CD和TAT-tCNTF同前處理后,去除培養基,PBS清洗,4%多聚甲醛固定細胞,0.5% Triton X-100滲透細胞,PBS清洗,每孔加入100 nmol·L-1的羅丹明-鬼筆環肽工作液,室溫避光孵育30 min。PBS清洗,用1 μg·mL-1的DAPI工作液孵育30 s后,熒光顯微鏡下拍照,羅丹明用綠光激發,DAPI用紫光激發。
1.7 Fluo 4-AM標記的細胞內Ca2+變化情況
將種植于6孔板的HUVECs經CD和TAT-tCNTF同上處理后,除盡培養基,PBS洗滌,加入5 μmol·L-1的Fluo 4-AM工作液,37 ℃孵育30 min,陰性對照采用PBS代替。除去工作液,PBS洗滌,加入PBS覆蓋細胞,37 ℃孵育20 min。熒光顯微鏡下觀察拍照;另將其消化離心收集于流式細胞儀檢測熒光強度,激發光波長為494 nm,發射光波長為516 nm。
1.8 Western blot檢測F-actin的蛋白表達水平
將藥物處理后的HUVECs提取蛋白,同時將蛋白樣品進行SDS-聚丙烯酰胺凝膠電泳后并轉膜,加兔源F-actin一抗(1∶300)4 ℃孵育過夜,加HRP標記的山羊抗兔二抗(1∶7000)室溫孵育2 h,然后于暗室加入ECL化學發光液,X膠片顯影、定影。
1.9 統計學分析
2 結果
2.1 TAT-tCNTF改善CD對HUVECs的生長抑制
CD降低HUVECs的細胞活動度(P < 0.000 1),而TAT-tCNTF可明顯升高CD作用后的HUVECs的細胞活動度(P = 0.003)。詳見圖1。
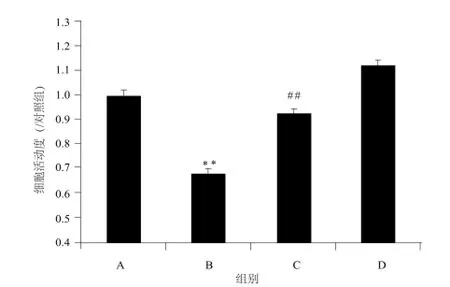
圖1 HUVECs細胞活動度的變化.n= 6A – 對照組,B – CD(10 μmol·L-1)組,C – CD(10 μmol·L-1) + TAT-tCNTF(10 μg·mL-1)組,D – TAT-tCNTF(10 μg·mL-1)組注:與A組比較,**P < 0.000 1;與B組比較,##P = 0.003Fig 1 Variation of the cell viability of HUVECs.n= 6A – control group, B – CD (10 μmol·L-1) group, C – CD (10 μmol·L-1) + TAT-tCNTF (10 μg·mL-1) group, D – TAT-tCNTF (10 μg·mL-1) groupNote: compared with group A,**P < 0.000 1; compared with group B,##P = 0.003
2.2 TAT-tCNTF穩定F-actin結構
羅丹明-鬼筆環肽將F-actin直接熒光染色,呈紅色;DAPI將細胞核染成藍色。如圖2所示,經CD作用后F-actin相對于對照組減少,其細胞微絲斷裂;而經TAT-tCNTF處理受損細胞后,F-actin的纖維絲連接相對較緊密。
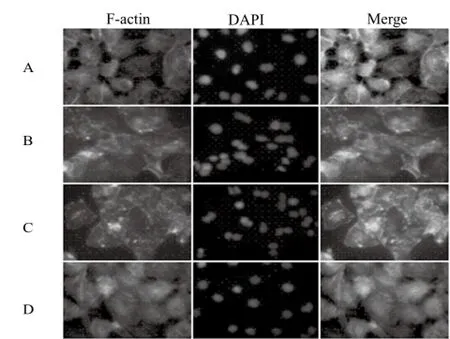
圖2 CD和TAT-tCNTF對F-actin的影響(×40)A – 對照組,B – CD(10 μmol·L-1)組,C – CD(10 μmol·L-1)+ TAT-tCNTF(10 μg·mL-1)組,D – TAT-tCNTF(10 μg·mL-1)組Fig 2 Effect of CD and TAT-tCNTF on F-actin (×40)A – control group, B – CD (10 μmol·L-1) group, C – CD (10 μmol·L-1) + TAT-tCNTF (10 μg·mL-1) group, D – TAT-tCNTF (10 μg·mL-1) group
2.3 TAT-tCNTF緩解CD引起的細胞內Ca2+超載
熒光顯微鏡下觀察到Fluo 4-AM將Ca2+染成綠色。相對于對照組,經CD作用后的細胞,胞內綠色熒光明顯增加,表明細胞內Ca2+濃度較高;而再經TAT-tCNTF處理的細胞綠色熒光相對減少。詳見圖3。

圖3 Fluo 4-AM標記的細胞內Ca2+的顯微觀察(×10)A – 對照組,B – CD(10 μmol·L-1)組,C – CD(10 μmol·L-1)+TAT-tCNTF(10 μg·mL-1)組,D – TAT-tCNTF(10 μg·mL-1)組Fig 3 Microscopic observation of intracellular Ca2+labeled by Fluo 4-AM staining (×10)A – control group, B – CD (10 μmol·L-1) group, C – CD (10 μmol·L-1) + TAT-tCNTF (10 μg·mL-1) group, D – TAT-tCNTF (10 μg·mL-1) group
流式細胞術檢測Ca2+染色的平均熒光強度(mean fluorescene intensity,MFI)。相對于對照組(MFI為440),CD組(MFI為539)的MFI增加,說明其細胞內Ca2+濃度較高;而CD + TAT-tCNTF組的MFI為499,較CD組降低,表明TAT-tCNTF能夠降低CD引起的細胞內Ca2+的增加。詳見圖4。
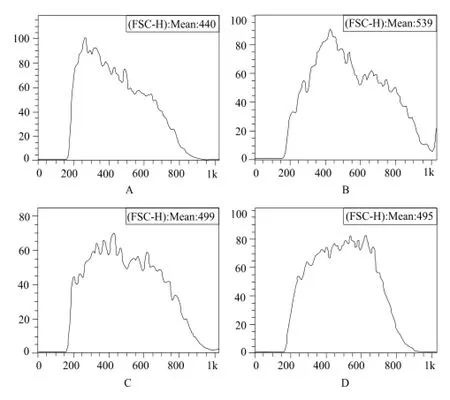
圖4 流式細胞術檢測細胞內Fluo 4-AM標記的Ca2+的熒光強度A – 對照組,B – CD(10 μmol·L-1)組,C – CD(10 μmol·L-1)+ TAT-tCNTF(10 μg·mL-1)組,D – TAT-tCNTF(10 μg·mL-1)組Fig 4 MFI of Fluo 4-AM labeled intracellular Ca2+by flow cytometryA – control group, B – CD (10 μmol·L-1) group, C – CD (10 μmol·L-1) + TAT-tCNTF (10 μg·mL-1) group, D – TAT-tCNTF (10 μg·mL-1) group
2.4 F-actin蛋白表達量基本不改變
F-actin蛋白表達量如圖5示,在內參GAPDH表達基本一致的基礎上,CD組與其他組的F-actin蛋白表達量無明顯差異。
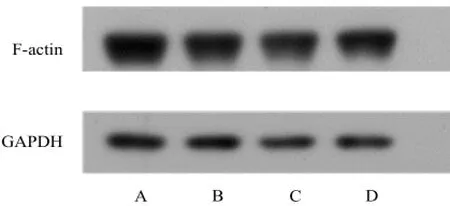
圖5 F-actin蛋白表達量A – 對照組,B – CD(10 μmol·L-1)組,C – CD(10 μmol·L-1)+ TAT-tCNTF(10 μg·mL-1)組,D – TAT-tCNTF(10 μg·mL-1)組Fig 5 Expression of F-actin proteinA – control group, B – CD (10 μmol·L-1) group, C – CD (10 μmol·L-1) + TAT-tCNTF (10 μg·mL-1) group, D – TAT-tCNTF (10 μg·mL-1) group
3 討論
本實驗室制備的可穿膜重組TAT-tCNTF,在前期實驗已證實其與CNTF的藥理作用相似,甚至在一些活性方面超過CNTF[5]。這可能由于重組的TAT-tCNTF的通透性增強,使TAT-tCNTF與CNTFα受體結合更加充分,從而發揮更好的藥理作用,如通過抗氧化作用保護神經元[7]。
CD結合于actin和F-actin的生長端,從而阻抑肌動蛋白的聚合,導致肌動蛋白解聚[8],本實驗采用TAT-tCNTF對CD損傷細胞進行了作用機制研究。CD可抑制細胞的增長,這與CD切斷微絲,抑制細胞的分裂一致[9]。實驗結果表明,經TAT-tCNTF作用后細胞活動度明顯增加,說明TAT-tCNTF能夠從增加細胞活力上緩解CD所致的細胞損傷,也證實TAT-tCNTF促進細胞的增長,不僅發生在神經元細胞,也發生在非神經元細胞。
本實驗采用羅丹明-鬼筆環肽直接標記F-actin,結果顯示經CD作用后細胞的F-actin明顯斷裂且分布減少;而給予TAT-tCNTF后,F-actin分布和形態基本得以恢復。說明TAT-tCNTF能夠調節F-actin來維持細胞的微絲結構。
采用Fluo 4-AM熒光標記細胞內的Ca2+,結果表明CD可使細胞內Ca2+熒光強度增加,跟以往報道一致[10],說明CD使F-actin結合的Ca2+釋放,造成細胞內Ca2+超載;而TAT-tCNTF可緩解由CD所致的細胞內Ca2+超載。另外,各組處理方式不影響F-actin表達量,說明CD只切斷微絲,不引起微絲解聚。以上結果表明TAT-tCNTF在一定程度上穩定F-actin,即能固定和支持微絲的形態結構,維持細胞內穩態。
綜上,本實驗中CD降低細胞活力并破壞細胞骨架結構,而TAT-tCNTF對細胞活力和細胞骨架有明顯的改善修復作用,說明TAT-tCNTF對CD損傷的細胞具有緩解作用。其機制可能與TAT-tCNTF促進細胞生長、維持F-actin的形成和修復、維持細胞骨架穩態等有關。該結果為研究TAT-tCNTF的藥理作用以及藥物透膜機制提供了新的思路,由于通過基因工程構建的TAT-tCNTF的藥理作用及作用機理較為復雜,仍需進一步的研究證明。
[1]Noble M, Davies JE, Mayer-Pr?schel M, et al. Precursor cell biology and the development of astrocyte transplantation therapies: lessons from spinal cord injury[J]. Neurotherapeutics, 2011, 8(4): 677-693.
[2]Cagnon L, Braissant O. CNTF protects oligodendrocytes from ammonia toxicity: intracellular signaling pathways involved[J]. Neurobiol Dis, 2009, 33(1): 133-142.
[3]Halum SL, Hiatt KK, Naidu M, et al. Optimization of autologous muscle stem cell survival in the denervated hemilarynx[J]. Laryngoscope, 2008, 118(7): 1308-1312.
[4]Min D, Kim H, Park L, et al. Amelioration of diabetic neuropathy by TAT-mediated enhanced delivery of metallothionein and SOD[J]. Endocrinology, 2012, 153(1): 81-91.
[5]Qu HY, Zhang T, Li XL, et al. Transducible P11-CNTF rescues the learning and memory impairments induced by amyloid-beta peptide in mice[J]. Eur J Pharmacol, 2008, 594(1-3): 93-100.
[6]Mishra A, Lai GH, Schmidt NW, et al. Translocation of HIV TAT peptide and analogues induced by multiplexed membrane and cytoskeletal interactions[J]. Proc Natl Acad Sci U S A, 2011, 108(41): 16883-16888.
[7]吳行偉,張琴,唐希,等.TAT-tCNTF提高Aβ損傷細胞模型的GSH水平和SOD酶活性研究[J].中國藥物應用與監測,2012,9(5):256-261.
[8]Blase C, Becker D, Kappel S, et al. Microfilament dynamics during HaCaT cell volume regulation[J]. Eur J Cell Biol, 2009, 88(3): 131-139.
[9]Tian Q, Pahlavan S, Oleinikow K, et al. Functional and morphological preservation of adult ventricular myocytes in culture by sub-micromolar cytochalasin D supplement[J]. J Mol Cell Cardiol, 2012, 52(1): 113-124.
[10]Godbout C, Castella LF, Smith EA, et al. The mechanical environment modulates intracellular calcium oscillation activities of myo fi broblasts[J]. PLoS One, 2013, 8(5): e64560.
Studies of the mechanism of TAT-tCNTF on cell injury caused by cytochalasin D
ZHANG Hong, ZHANG Qin, LIU Ze-yuan, XU Ya-fei, QU Heng-yan(Af fi liated Hospital of Academy of Military Medical Sciences, Beijing 100071, China)
Objective:To investigate the mechanism of TAT-tCNTF on human umbilical vein endothelial cells (HUVECs) injured by cytochalasin D (CD).Methods:After HUVECs were treated with CD and TAT-tCNTF, cell viability was determined by CCK-8. The structural changes of F-actin stained by rhodamine labeled ghost cyclic peptide were observed through the fl uorescence microscope. Concentrations of intracellular free calcium by Fluo 4-AM loading were detected through the fl uorescence microscope and fl ow cytometry. Western blot was used to detect the expression of F-actin protein.Results:CD (10 μmol·L-1) reduced the cell viability of HUVECs (P < 0.000 1), while TAT-tCNTF (10 μg·mL-1) significantly increased the cell viability of HUVECs (P = 0.003). F-actin with CD was fractured and reduced, while it was improved after subsequent treatment with TAT-tCNTF. TAT-tCNTF alleviated the calcium overload caused by CD. Flow cytometry showed mean fl uorescence intensity (MFI) of Ca2+in CD group was stronger than that in control group, the MFI of Ca2+in (CD + TAT-tCNTF) group was lower than that in CD group. Western blot showed the expression of F-actin protein had almost no change among all groups.Conclusion:TAT-tCNTF ameliorated the cell injury caused by CD. The mechanism was associated with maintaining actin cytoskeleton and alleviating the calcium overload.
TAT-tCNTF; Cytochalasin D; F-actin; Calcium overload
R965
A
1672 – 8157(2014)03 – 0145 – 04
2013-09-03
2014-01-07)
國家自然科學基金資助項目(81001438)
曲恒燕,女,碩士生導師,研究方向:藥理學。E-mail:quhymail@126.com
張宏,男,碩士,研究方向:生物醫學工程。E-mail:13601192278@126.com

